利拉鲁肽经抑制M1巨噬细胞极化减轻AngII诱导的主动脉夹层和主动脉瘤
2025-09-23 来源:本站 点击次数:58主动脉作为人体最大的循环导管,由内膜、中膜(含平滑肌细胞)和外膜(含成纤维细胞)构成,负责向全身输送血液以完成物质交换。主动脉瘤和主动脉夹层(AAD)是致命性心血管疾病,以血管壁内膜与中膜分离为特征,常由高速血流灌注主动脉壁破裂处引发。
近期研究表明巨噬细胞极化在 AAD 的发展中起关键作用。巨噬细胞可在不同刺激下极化为 M1(促炎)和 M2(抗炎)两种主要表型,在 Ang II 诱导的 AAD 模型中,巨噬细胞倾向于向 M1 型极化。M1 型巨噬细胞会分泌 iNOS、IL-1、IL-6 等炎症介质(其中 IL-6 是加速 AAD进展的关键因素,沉默其表达可产生保护作用),还会促进血管平滑肌细胞表型转换,并增加降解细胞外基质的 MMP2、MMP9 的分泌,这些都是 AAD 发病的重要原因。
胰高血糖素样肽 - 1(GLP-1)是小肠 L 细胞进食时释放的激素,结合 GLP-1 受体后可调节细胞代谢。利拉鲁肽作为长效 GLP-1 受体激动剂,对心肌梗死、动脉粥样硬化等多种心血管疾病有积极作用,还能抑制 M1 型巨噬细胞极化。
鉴于此,南京鼓楼医院心胸外科心胸血管病研究所的研究团队推测利拉鲁肽可能对 AAD 有保护作用,并通过体内外实验验证该假设并探究其潜在机制。研究成果发表在Biochemical pharmacology期刊,题为“Liraglutide attenuates angiotensin II-induced aortic dissection and aortic aneurysm via inhibiting M1 macrophage polarization in APOE mice-/-”。

首先 ,研究人员检测了主动脉夹层(AD)患者和对照组患者主动脉中 M1 型巨噬细胞极化水平及 GLP-1R 的表达水平。结果显示,与对照组相比,AD 患者的 M1 型巨噬细胞标志物(诱导型一氧化氮合酶 iNOS、CD68)(图 1A)和 GLP-1R(图 1B)的表达水平显著升高。IF进一步证实了这些发现,显示 AD 患者中 CD68、iNOS 和 GLP-1R 的荧光强度更高, 且 GLP-1R 与 CD68、iNOS 存在高度共定位(图 1C 和 D)。这表明,外源性补充 GLP-1 受体激动剂(如利拉鲁肽)可能通过抑制 M1 型巨噬细胞极化,对 AAD 的发展起到保护作用。
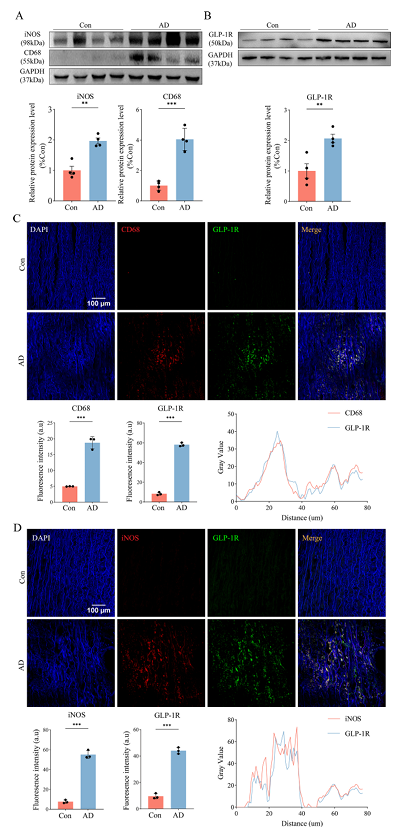
图1 AD 患者主动脉中 M1 型巨噬细胞极化增强及 GLP-1R 表达升高
为了验证假设,研究人员通过对 APOE 基因敲除小鼠连续输注 Ang II 诱导AAD,并同时注射利拉鲁肽。结果显示,Ang II 会导致小鼠血压升高(图 2A)、AAD 发生率和死亡率增加(图 2B-D)、腹主动脉直径扩大(图 2E - G)及弹性蛋白降解加剧(图 2H)。而利拉鲁肽可显著改善这些损伤,表明其能抑制 AAD形成并降低死亡率,具有潜在治疗作用。
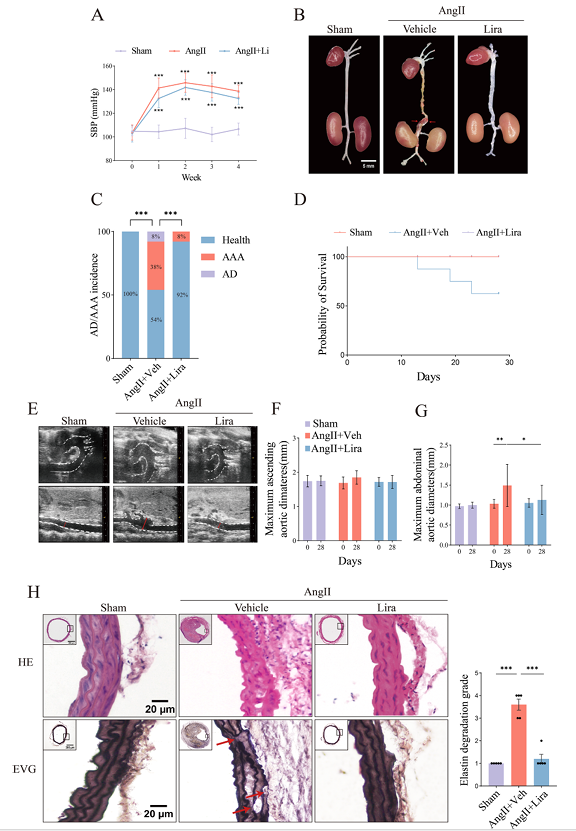
图2 利拉鲁肽减轻 Ang II 诱导的 APOE 基因敲除小鼠主动脉瘤和 AAD 的发生
接下来,为了探究利拉鲁肽保护作用的潜在机制,研究人员检测了各组小鼠主动脉中 M1 型巨噬细胞标志物 iNOS 以及炎症因子 IL-6、IL-1α 和 IL-1β 的表达水平。结果显示, Ang II 会使小鼠主动脉中 M1 型巨噬细胞标志物 iNOS(图 3A -C)及炎症因子 IL-6、IL-1α、IL-1β(图 3F) 的表达水平升高,还会增加主动脉中 GLP-1R 的表达,而利拉鲁肽可逆转这些变化(图 3A 和 C)。不过,单独用 Ang II 或其与利拉鲁肽联合处理,对小鼠血清胰岛素和 GLP-1 水平无显著影响(图 3D)。
接着,研究人员利用 LPS 处理的骨髓来源巨噬细胞(BMDM)来探究利拉鲁肽对巨噬细胞极化的调控作用,经确认实验所用 LPS 浓度为 0.1 μg/ml(图 3G),细胞为 F4/80 阳性 BMDM(图 3H)。结果显示,LPS 会诱导 M1 型巨噬细胞极化,使上清液中 iNOS(图 3I 至 3M)、IL-6、IL-1α 和 IL-1β 的表达水平升高(图 3N 至 3Q),而利拉鲁肽可缓解此情况,且其保护作用会被 GLP-1 受体拮抗剂减弱(图 3J 和 2L),这一结果在 Raw 264.7 巨噬细胞系中也得到验证(图 3R-3V)。这些结果表明,利拉鲁肽在体内外均可通过激活 GLP-1 受体抑制 M1 型巨噬细胞极化。

图3 利拉鲁肽在体内和体外均能抑制 M1 型巨噬细胞极化
血管平滑肌细胞(VSMC)表型转换是 AAD 进展的关键机制,且由 M1 型巨噬细胞极化介导。因此,研究人员探究了利拉鲁肽对各组小鼠主动脉中血管平滑肌细胞表型转换的影响。检测发现,Ang II 会使小鼠主动脉中 VSMC 的收缩型标志物(αSMA、SM22)表达降低(图 4A 和 B),合成型相关的 MMP9、MMP2 表达升高(图 4C 和 D),即诱导 VSMC 向合成型转换,而利拉鲁肽可逆转这一转换过程。
然后,为了进一步探究利拉鲁肽对 VSMC 表型转换的影响是否通过调控 M1 型巨噬细胞极化实现,研究将原代 VSMC 暴露于不同处理的 BMDM 条件培养基中。结果显示,LPS 处理的 BMDM 条件培养基会降低 VSMC 伤口愈合速率(图 4E),抑制收缩型标志物(αSMA、SM22)表达(图 4F 和 G),促进合成型相关酶(MMP9、MMP2)表达(图 4H 和 I),而利拉鲁肽与 LPS 联合处理的 BMDM 条件培养基则不影响 VSMC 表型转换。这表明利拉鲁肽可通过调节巨噬细胞极化来调控 VSMC 表型转换。

图4 利拉鲁肽通过调控巨噬细胞极化调节 VSMC 表型转换
为了进一步明确利拉鲁肽介导 M1 型巨噬细胞极化的机制,研究对不同处理的 BMDM 进行 RNA 测序,发现 499 个交互作用的差异表达基因(图 5A),这些基因主要富集在细胞因子 - 细胞因子受体相互作用通路(图 5B),其详细情况展示于热图中(图 5C)。经 RT-qPCR 验证,CXCL3 的表达差异显著,其中,IL1a 未被检测到,尽管其变化倍数很高(图 5D) 。同时,AD患者血清中 CXCL3 浓度显著高于对照组(图 5E)。
最后,为了验证 CXCL3 在利拉鲁肽介导 M1 型巨噬细胞极化中的作用,研究发现:将 BMDM 与 CXCL3 共孵育会使相关炎症因子表达增加,利拉鲁肽预处理可缓解(图 5F)。后续选择 siCXCL3-1 用于实验(图 5G)。 结果显示,siCXCL3-1 显著逆转了 M1 型巨噬细胞极化(图 5H)。KEGG 分析提示 PI3K/AKT 信号通路可能参与其中,使用 PI3K 抑制剂 LY294002 后,利拉鲁肽下调 CXCL3 表达的作用被逆转(图 5I)。这表明利拉鲁肽可能通过 PI3K/AKT 信号通路调控 CXCL3 表达,进而影响 M1 型巨噬细胞极化。
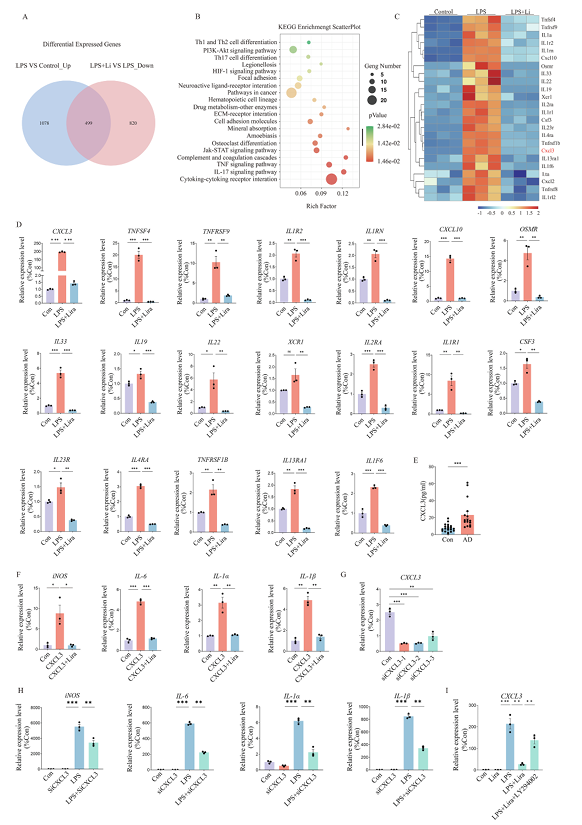
图5 CXCL3 参与利拉鲁肽介导的 M1 型巨噬细胞极化,并成为AAD的潜在生物标志物及治疗靶点
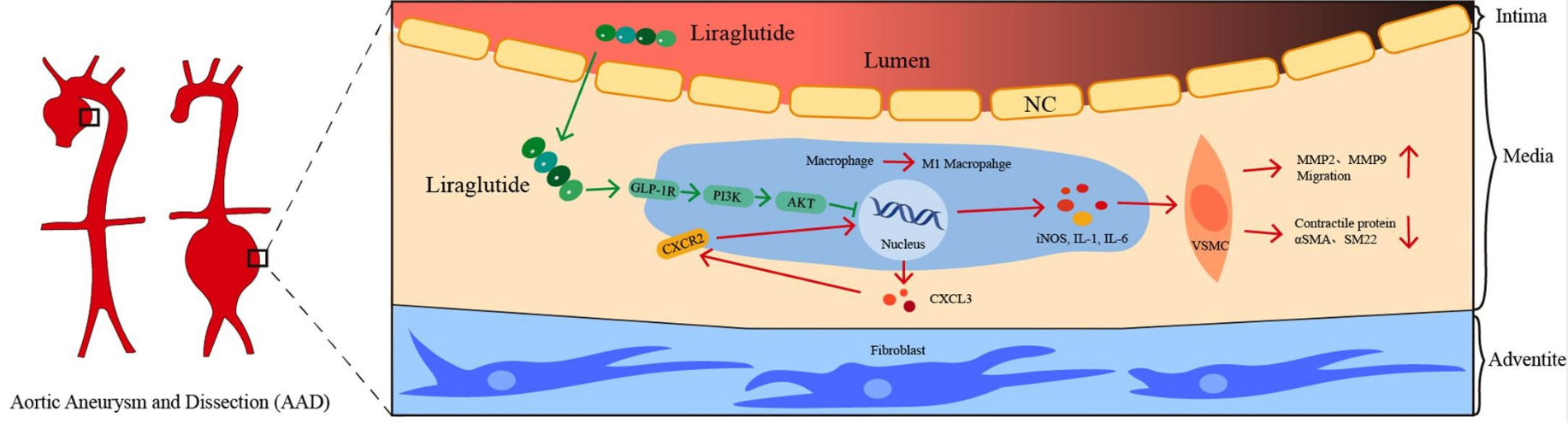
图6 示意图
总之,该研究表明,利拉鲁肽通过调控 M1 型巨噬细胞极化,经 PI3K/AKT 信号通路抑制 CXCL3 的表达,从而对主动脉瘤和主动脉夹层发挥保护作用(图6)。这使其成为 AAD极具潜力的治疗靶点,为 AAD 的管理提供了新途径。
参考文献:Zhang K, Li R, Matniyaz Y, Yu R, Pan J, Liu W, Wang D. Liraglutide attenuates angiotensin II-induced aortic dissection and aortic aneurysm via inhibiting M1 macrophage polarization in APOE -/- mice. Biochem Pharmacol. 2024 May;223:116170. doi: 10.1016/j.bcp.2024.116170. Epub 2024 Mar 26. Erratum in: Biochem Pharmacol. 2025 Feb;232:116707. doi: 10.1016/j.bcp.2024.116707. PMID: 38548245.
原文链接:https://pubmed.ncbi.nlm.nih.gov/38548245/
图片来源:所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生多细胞动态共培养系统

