阿尔兹海默症研究备受关注的10个热门靶点及其抑制剂/激动剂的机制
2025-11-21 来源:本站 点击次数:111
阿尔茨海默症(AD)的病理机制涉及β-淀粉样蛋白(Aβ)沉积、Tau蛋白过度磷酸化、神经信号通路异常、神经炎症反应失调等多重因素。近年来,针对上述AD不同生理过程的抑制剂研究取得显著突破,在大鼠、小鼠、恒河猴等多种动物AD模型中有着广泛的研究应用。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、神经递质与信号通路调节剂
1. 乙酰胆碱酯酶(AChE)抑制剂
AD的早期特征之一是基底前脑(BFB)区域中的胆碱能神经元丢失,导致乙酰胆碱的释放减少,进而影响大脑多个区域中神经元的功能活性,并最终导致学习和记忆功能障碍。在动物AD模型中,通过注射乙酰胆碱酯酶(AChE)抑制剂可增加大脑中乙酰胆碱的水平,从而改改善上述状况。在科研领域中,备受关注的AChE抑制剂有Donepezil(E2020,AbMole,M3601)、Rivastigmine(ENA 713,AbMole,M10928)、Galantamine(AbMole,M14548)、Tacrine(AbMole,M54846)等,它们可有效抑制AChE家族的活性。上述抑制剂除了能提高AD模型中的乙酰胆碱酶水平,还能抑制Aβ蛋白的产生,其机制如下:AChE抑制剂可通过升高乙酰胆碱的水平促进淀粉样前体蛋白(APP)通过非淀粉样蛋白途径代谢,减少Aβ肽的产生[1];部分乙酰胆碱酯酶抑制剂如Donepezil(E2020)、Rivastigmine(ENA 713)等可通过增加乙酰胆碱水平间接抑制γ-分泌酶的活性。γ-分泌酶负责切割APP产生Aβ肽,其活性的抑制可以减少Aβ蛋白的生成[2]。
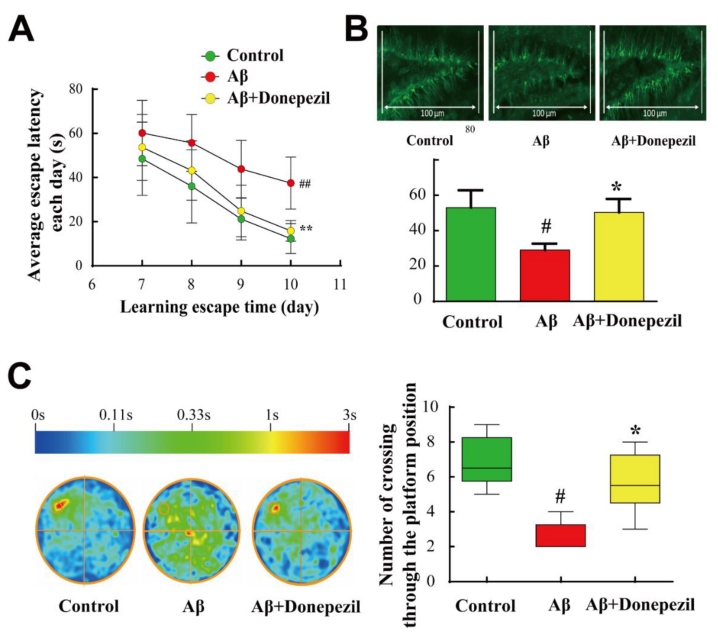

2. N-甲基-D-天冬氨酸(NMDA)受体抑制剂
NMDA受体(N-甲基-D-天冬氨酸受体)是中枢神经系统中的一种离子型谷氨酸受体,广泛表达于大脑的各个区域。NMDA受体的过度激活将导致钙离子内流增加,破坏细胞内钙稳态,进而引发一系列细胞内信号通路的紊乱,最终导致神经元死亡和AD样变化。NMDA受体拮抗剂如Memantine(AbMole,M3326)可通过抑制NMDA受体保护神经元,在多种动物模型(大鼠、小鼠)中表现出良好的AD抑制效果。例如Memantine可保护由Aβ1-40 诱导的大鼠神经元细胞损伤[4]。
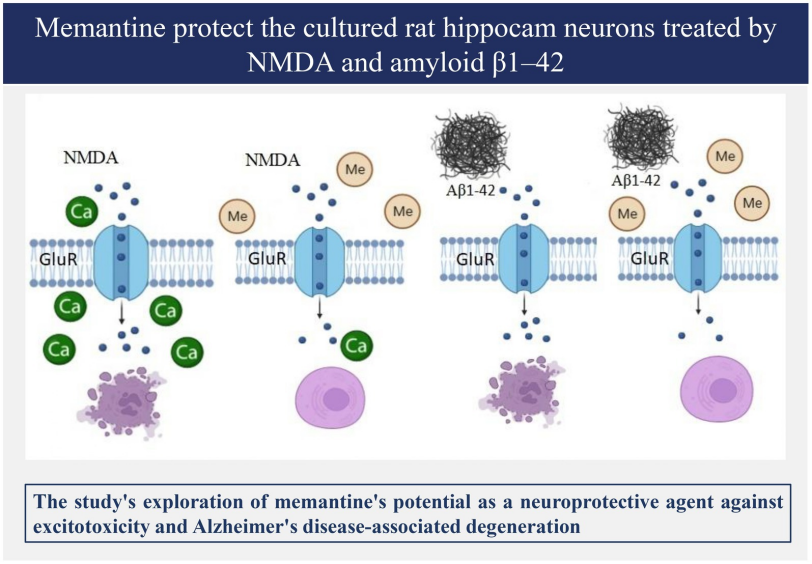

3. 毒蕈碱受体(mAChR)激活剂
毒蕈碱受体(mAChR)在哺乳动物的认知功能中扮演着重要的角色,分为M1至M5五个亚型,广泛分布于大脑皮层、海马和基底神经节等区域,与认知功能密切相关。Blarcamesine(AbMole,M6203)和ML380(AbMole,M28716)是mAChR的激动剂,可通过调节细胞内钙稳态,减少Aβ蛋白对神经元的毒性作用,这种调节作用有助于维持神经元的正常功能,减少神经退行性变化。
4. 烟碱型乙酰胆碱受体(nAChRs)激动剂
烟碱型乙酰胆碱受体(nAChRs)激动剂也是AD动物模型研究中常用的一类工具化合物。ABT-089(Pozanicline,AbMole,M8553)是烟碱 α4β2和α6β2受体的激动剂,可显著改善实验动物的认知功能[5]。Varenicline(CP 526555,AbMole,M6268)、Isopronicline(TC-1734,ACD3480AbMole,M29693)作为α4β2或α7 nAChR的激动剂可以在多种动物体内调节神经递质释放、减少氧化应激和炎症反应,提供神经保护以及增强突触可塑性,促进学习和记忆[5]。
二、作用于淀粉样蛋白(Aβ)的抑制剂
淀粉样蛋白的异常聚集是AD的核心标志之一。Aβ蛋白的异常产生和清除失衡导致其在脑内聚集,形成寡聚体和原纤维并破坏突触的结构与功能。Aβ蛋白的形成是一个多步骤的蛋白水解过程,核心涉及淀粉样前体蛋白(APP)的切割。APP是一种表达于神经元表面的跨膜蛋白,在正常生理条件下,APP 更易被α-分泌酶切割。但当APP被 β-分泌酶(如BACE1)首先切割时,则会产生 C 端片段(C99),C99则进一步被γ-分泌酶切割后将产生不同长度的 Aβ肽段,包括Aβ1-40(约占 90%)和 Aβ1-42(约占 10%)。Aβ1-42 (Amyloid β-Peptide 1-42)因疏水性更强,更易发生错误折叠并形成聚集物,也是动物AD模型最常用的造模剂之一[6]。
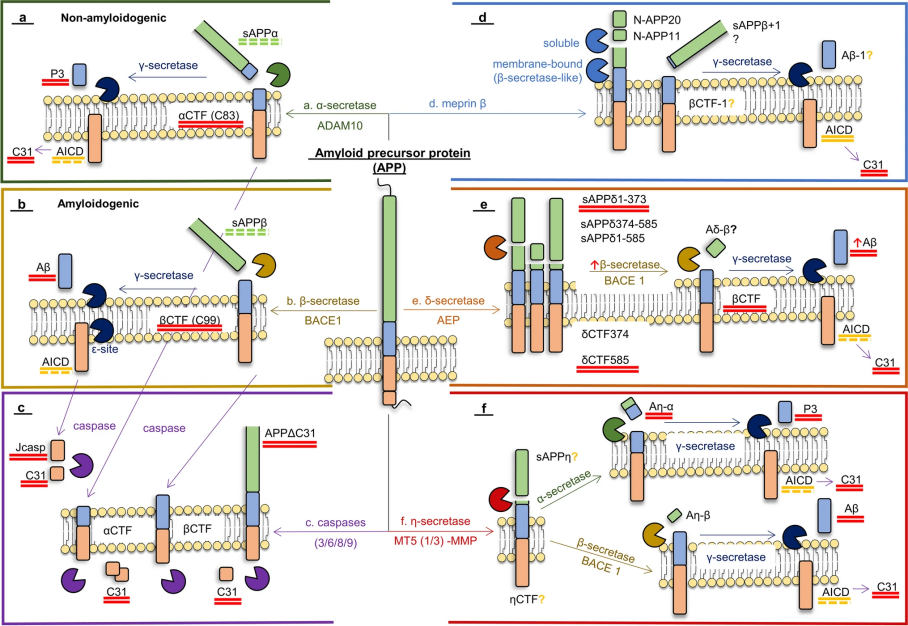

1. Aβ蛋白合成抑制剂
β分泌酶抑制剂
β-分泌酶(也称为β位点APP裂解酶; BACE1),是切割APP并产生Aβ蛋白的起始和核心步骤。β-分泌酶在AD研究领域中一直是热门靶点,Verubecestat (MK-8931,AbMole,M9386) 可通过高亲和力结合BACE1的疏水位点,抑制其活性,Verubecestat在小鼠和灵长类动物模型中显著降低了脑脊液和大脑中的Aβ蛋白水平[7]。此外, AZD3293 (Lanabecestat,AbMole,M5227) 、Atabecestat (JNJ-54861911,AbMole,M10943) 、Elenbecestat (E2609,AbMole,M10942) 、Umibecestat(CNP520,AbMole,M28304)、LY2886721(AbMole,M1987)等也是动物实验中常用的β-分泌酶(BACE1)抑制剂。
γ分泌酶抑制剂和调节剂
γ-分泌酶是负责Aβ生成最后一步的酶,也是AD研究的另一个重要靶点。Semagacestat(LY450139,AbMole,M2277)是一种经典的γ-分泌酶抑制剂(GSIs),通过抑制γ-分泌酶的活性,减少Aβ蛋白的产生。Avagacestat(BMS-708163,AbMole,M1947)则是一种选择性的γ-分泌酶抑制剂,能够在降低Aβ蛋白水平的同时减少对Notch信号通路的影响。Nirogacestat(PF-3084014,AbMole,M9041)是一种可以通过灌胃形式或混在动物饮用水中给予实验动物的γ-分泌酶抑制剂,适合长期研究使用。Begacestat(GSI-953,AbMole,M3619)也是一种对Notch-1通路具有低抑制活性的γ-分泌酶抑制剂,能够优先抑制APP的切割,保留Notch1的信号。除了上述几款抑制剂,LY-411575(LSN-411575,AbMole,M2130)、MK-0752(AbMole,M2120)等抑制剂也可用于动物AD模型的研究,抑制Aβ的产生。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
α-分泌酶激活剂
α分泌酶活性的上调可以促进APP 以非淀粉样蛋白的形式切割,以此减少 Aβ蛋白的形成并增加可溶性结构域(sAPPα)的产生。Etazolate(AbMole,M56752)是磷酸二酯酶 (PDE4) 抑制剂和GABAα受体调节剂,有文献证实Etazolate可激活神经元α分泌酶,在具体实验中Etazolate可以通过口服形式给与动物,便于开展实验研究[7]。Bryostatin-1(苔藓抑素1,AbMole,M7647)、Epigallocatechin Gallate(EGCG,表没食子儿茶素没食子酸酯,AbMole,M4208)等调节剂可通过激活蛋白激酶C(PKC)提高α-分泌酶的活性,促进APP的非淀粉样蛋白途径代谢[8]。Gemfibrozil(AbMole,CI-719,M7822)则可通过刺激ADAM10(α-分泌酶家族重要亚型)的启动子活性,增加ADAM10的表达,从而减少Aβ蛋白的产生。雌二醇(Estradiol,β-Estradiol,AbMole,M5625)是一种激素,最近的文献发现雌二醇可通过激活Akt和mTOR信号通路,增加α-分泌酶的活性,促进APP的非淀粉样蛋白途径代谢[9]。
2. Aβ蛋白聚集抑制剂
Aβ蛋白产生神经毒性的主要机制之一是聚集体的形成。在动物实验中,Aβ蛋白聚集抑制剂通过阻止Aβ蛋白的聚集,可减少后者对神经元的毒性。铜和锌离子等金属离子在Aβ蛋白的聚集过程中起关键作用,Clioquinol(PBT1,AbMole,M5528)是一种羟基喹啉离子载体,可通过螯合上述金属离子减少Aβ蛋白的聚集[10]。Scyllo-inositol(Scyllitol,AZD103, ELND-005,AbMole,M21016)可通过稳定Aβ1-42的低聚态构象,阻止Aβ蛋白的进一步聚集。在动物研究中,Scyllo-inositol(ELND-005)降低了可溶性和不溶性 Aβ1–40的浓度,并改善了突触丢失和神经胶质炎症反应。此外,胰岛素信号传导在维持突触功能和认知功能中起着重要作用,Scyllo-inositol(AZD 103, ELND-005)还能增强胰岛素信号传导改善实验动物的认知和学习能力[11]。
三、靶向Tau蛋白的调节剂
Tau(微管相关蛋白Tau,MAPT)是一种细胞质蛋白,主要的生理功能是与微管蛋白结合,稳定微管。在阿尔茨海默症中,Tau蛋白异常磷酸化,产生对神经元有害的聚集体(神经原纤维缠结)。以Tau蛋白为靶点的调节剂主要分为两类,第一类是调节Tau磷酸化相关的信号通路、激酶或者去磷酸化酶(如GSK3、PP2A等);第二类则是抑制磷酸化Tau蛋白形成缠结。
1. Tau蛋白磷酸化调节剂
Valproic acid(AbMole,M1876)、SB216763(AbMole,M2061)、Tideglusib (NP-12,NP031112,AbMole,M2306)等化合物是高效的GSK3抑制剂,可通过抑制GSK-3β的活性,减少Tau蛋白在多个位点(如 Ser396、Thr231)的磷酸化。在动物模型中,这类抑制剂可降低Tau磷酸化水平,并改善与Tau相关的神经元结构异常。还有研究发现细胞周期蛋白依赖性激酶 5(CDK5)在神经元中过度激活时会导致Tau磷酸化。Roscovitine(Seliciclib, CYC202,AbMole,M1974)可特异性抑制CDK5的活性,在实验中能减少Tau磷酸化产物的生成。蛋白磷酸酶2A(PP2A)是Tau去磷酸化的主要酶类,Forskolin被文献证实可以通过激活PP2A,增强Tau的去磷酸化。Davunetide(NAP,AbMole,M29256)是一种由8个氨基酸组成的多肽,来源于活性依赖性神经保护蛋白 (ADNP)。Davunetide已在阿尔茨海默症动物模型中进行了测试,并表现出调节微管组装,以及抑制Tau过度磷酸化和减少Aβ蛋白等功能。
2. Tau蛋白聚集抑制剂
Methylene blue(亚甲蓝,亚甲基蓝,AbMole,M5783)可与Tau蛋白的聚集核心结合,抑制Tau原纤维的形成,并促进已形成的聚集体解聚,Methylene blue被用于减少小鼠模型中Tau聚集物的沉积,改善神经元的存活状态。TRx0237(Leucomethylene blue mesylate,AbMole,M14554)是一种Methylene blue (亚甲基蓝)的一种还原形式,在阿尔兹海默症动物模型中的早期Tau蛋白的聚集表现出显著的抑制活性。Curcumin(Diferuloylmethane,姜黄素,AbMole,M2198)是一种具有多种活性的天然产物,近期有研究发现Curcumin可抑制Tau蛋白的聚集。Lithium chloride(LiCl,氯化锂,M9977)也是一种GSK3抑制剂,广泛用于中枢神经系统特别是AD模型的研究。
3. 靶向Tau蛋白的其它调节剂
Salsalate(Disalicylic acid,双水杨酸酯,AbMole,M2998)是一种小分子非甾体抗炎剂,已被证明可以抑制Tau乙酰化。在转基因小鼠模型中,Salsalate降低了海马萎缩并减少了记忆缺陷。LY3372689(Ceperognastat,AbMole,M29407)是一种O-GlcNAcase (OGA) 酶抑制剂,O-GlcNAcase酶负责去除蛋白质上的O-GlcNAc修饰。LY3372689通过抑制OGA,进而增加Tau蛋白的O-GlcNAcylation水平,减少Tau蛋白在相关位点的磷酸化,降低Tau蛋白的聚集倾向。TPI-287(Abeotaxane,AbMole,M30686)是一种合成的紫杉烷衍生物,最初用于研究中枢神经系统恶性肿瘤。TPI-287通过靶向微管蛋白(Tubulin),发挥微管稳定作用。在正常神经元中,Tau蛋白有助于微管的稳定,而当Tau蛋白功能失调时,微管会变得不稳定,导致轴突运输受损。TPI-287通过稳定微管,有助于补偿因Tau蛋白功能失调导致的微管不稳定性。在Tau转基因小鼠模型中,TPI-287能够降低大脑中过度磷酸化的Tau蛋白水平,并改善认知表现。Nicotinamide(Niacinamide,烟酰胺,AbMole,M4896)是NAD和NADP的活性成分,烟酰胺可以预防阿尔茨海默症小鼠模型的认知缺陷,并能降低磷酸化Tau蛋白(Thr231)在大脑中的浓度。此外,烟酰胺还能抑制大脑sirtuin脱乙酰酶,上调乙酰基α-微管蛋白、蛋白 p25 和 MAP2c,上述这些变化都与微管稳定性的增加有关。
四、靶向线粒体功能障碍的调节剂
靶向细胞器(例如线粒体)是抑制阿尔茨海默症的一种新方法,与目前主导研究的以蛋白质为重点的策略不同。线粒体功能障碍在阿尔茨海默症早期发生,促进突触损伤和细胞凋亡,并被认为是神经退化的重要因素[12]。 MitoQ(Mitoquinone,AbMole,M9068)是一种线粒体靶向抗氧化剂,能够穿透线粒体并中和自由基,从而减少氧化应激[13]。 Latrepirdine(Dimebolin,AbMole,M2231)是一种具有神经保护、抗凋亡作用等多种活性的化合物,Dimebon抑制线粒体通透性转换孔(mPTP)的开放,增加线粒体膜电位,改善ATP合成。Latrepirdine在动物实验中显示出改善认知和学习的效果。除了上述几种化合物,Resveratrol(SRT501,白藜芦醇,AbMole,M2267)等也可以增强线粒体功能、减少氧化应激并抑制AD动物模型中的退行性神经变化。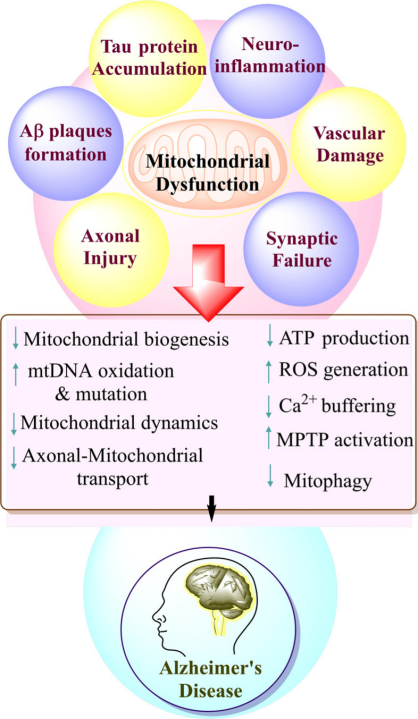

五、靶向神经炎症的抑制剂

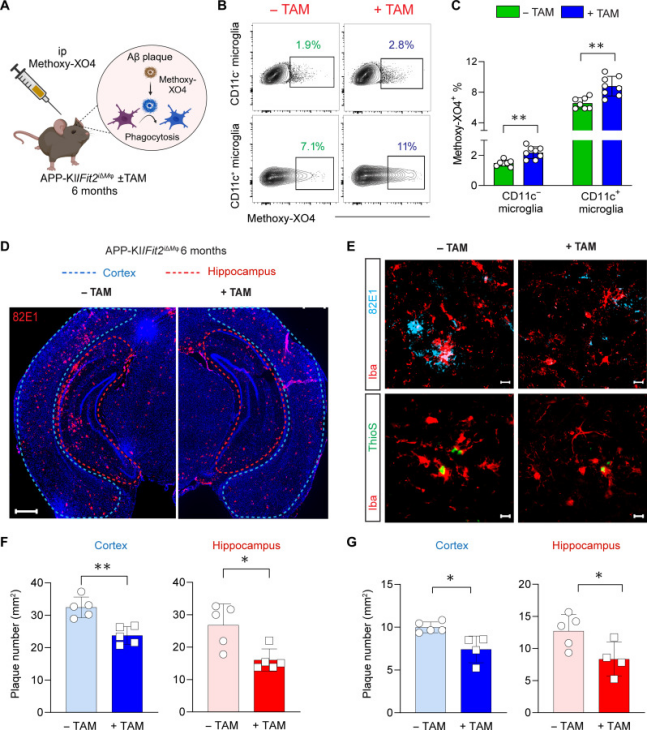
图 5. Microglial FIT2 deficiency reduces Aβ load in the AD brain[15]
2. Small Struct. 2024, 5, 2400241.
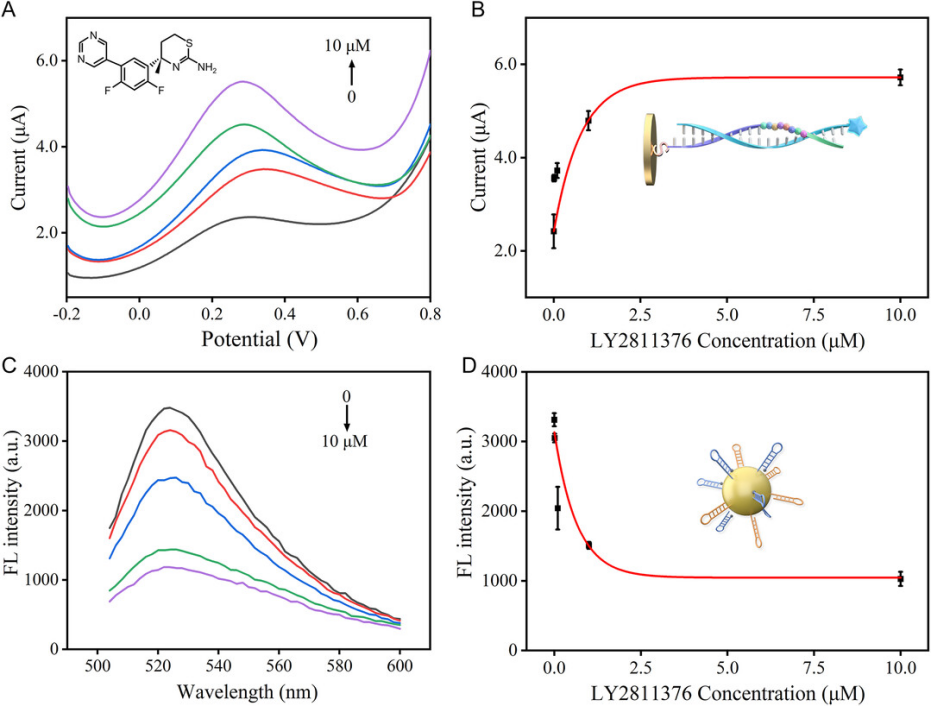

图 6. Inhibition of BACE1 by the LY2811376. A) SWV curves of incubation with different concentrations of LY2811376 (0, 0.01, 0.1, 1, and 10 μm)[16]


参考文献及鸣谢
[1] Marco Racchi, Michela Mazzucchelli, S. Carolina Lenzken, et al., Role of acetylcholinesterase inhibitors in the regulation of amyloid β precursor protein (AβPP) metabolism, Chemico-Biological Interactions 157-158 (2005) 335-338.
[2] Marta Goschorska, Izabela Gutowska, Irena Baranowska-Bosiacka, et al., Influence of Acetylcholinesterase Inhibitors Used in Alzheimer’s Disease Treatment on the Activity of Antioxidant Enzymes and the Concentration of Glutathione in THP-1 Macrophages under Fluoride-Induced Oxidative Stress, 16(1) (2019) 10.
[3] Jae-Kwon Jo, Gihyun Lee, Cong D. Nguyen, et al., Effects of Donepezil Treatment on Brain Metabolites, Gut Microbiota, and Gut Metabolites in an Amyloid Beta-Induced Cognitive Impairment Mouse Pilot Model, Molecules (Basel, Switzerland), 2022.
[4] N. M. Rozumna, V. V. Hanzha, E. A. Lukyanetz, Memantine protects the cultured rat hippocampal neurons treated by NMDA and amyloid β1-42, Frontiers in neuroscience 17 (2023) 1269664.
[5] A. Crestini, E. Carbone, R. Rivabene, et al., A Systematic Review on Drugs Acting as Nicotinic Acetylcholine Receptor Agonists in the Treatment of Dementia, Cells 13(3) (2024).
[6] A. Delport, R. Hewer, The amyloid precursor protein: a converging point in Alzheimer's disease, Molecular neurobiology 59(7) (2022) 4501-4516.
[7] S. Singh, F. Yang, A. Sivils, et al., Amylin and Secretases in the Pathology and Treatment of Alzheimer's Disease, Biomolecules 12(7) (2022).
[8] A. E. Abdallah, Review on anti-alzheimer drug development: approaches, challenges and perspectives, RSC advances 14(16) (2024) 11057-11088.
[9] Y. J. Cheng, C. H. Lin, H. Y. Lane, From Menopause to Neurodegeneration-Molecular Basis and Potential Therapy, International journal of molecular sciences 22(16) (2021).
[10] Y. J. Kang, Y. N. Diep, M. Tran, et al., Therapeutic Targeting Strategies for Early- to Late-Staged Alzheimer's Disease, International journal of molecular sciences 21(24) (2020).
[11] J. Pitt, M. Thorner, D. Brautigan, et al., Protection against the synaptic targeting and toxicity of Alzheimer's-associated Aβ oligomers by insulin mimetic chiro-inositols, FASEB journal : official publication of the Federation of American Societies for Experimental Biology 27(1) (2013) 199-207.
[12] P. H. Reddy, M. F. Beal, Amyloid beta, mitochondrial dysfunction and synaptic damage: implications for cognitive decline in aging and Alzheimer's disease, Trends in molecular medicine 14(2) (2008) 45-53.
[13] S. Bhatia, R. Rawal, P. Sharma, et al., Mitochondrial Dysfunction in Alzheimer's Disease: Opportunities for Drug Development, Current neuropharmacology 20(4) (2022) 675-692.
[14] D. Kothandan, D. S. Singh, G. Yerrakula, et al., Advanced Glycation End Products-Induced Alzheimer's Disease and Its Novel Therapeutic Approaches: A Comprehensive Review, Cureus 16(5) (2024) e61373.
[15] X. Wu, J. A. Miller, B. T. K. Lee, et al., Reducing microglial lipid load enhances β amyloid phagocytosis in an Alzheimer's disease mouse model, Science advances 11(6) (2025) eadq6038.
[16] Tao Cheng, Peifen Lu, Yixi Dong, et al., A Bilingual Nanobiosensor for Cross‐Category Integrated Decoding of the Beta‐Site Amyloid Precursor Protein‐Cleaving Enzyme 1–Aβ Oligomer Signaling Pathway, Small Structures 5(11) (2024).
一、神经递质与信号通路调节剂
1. 乙酰胆碱酯酶(AChE)抑制剂
AD的早期特征之一是基底前脑(BFB)区域中的胆碱能神经元丢失,导致乙酰胆碱的释放减少,进而影响大脑多个区域中神经元的功能活性,并最终导致学习和记忆功能障碍。在动物AD模型中,通过注射乙酰胆碱酯酶(AChE)抑制剂可增加大脑中乙酰胆碱的水平,从而改改善上述状况。在科研领域中,备受关注的AChE抑制剂有Donepezil(E2020,AbMole,M3601)、Rivastigmine(ENA 713,AbMole,M10928)、Galantamine(AbMole,M14548)、Tacrine(AbMole,M54846)等,它们可有效抑制AChE家族的活性。上述抑制剂除了能提高AD模型中的乙酰胆碱酶水平,还能抑制Aβ蛋白的产生,其机制如下:AChE抑制剂可通过升高乙酰胆碱的水平促进淀粉样前体蛋白(APP)通过非淀粉样蛋白途径代谢,减少Aβ肽的产生[1];部分乙酰胆碱酯酶抑制剂如Donepezil(E2020)、Rivastigmine(ENA 713)等可通过增加乙酰胆碱水平间接抑制γ-分泌酶的活性。γ-分泌酶负责切割APP产生Aβ肽,其活性的抑制可以减少Aβ蛋白的生成[2]。


图 1. Donepezil可以改善Aβ25-35肽诱导的小鼠AD模型的水迷宫测试表现[3]
2. N-甲基-D-天冬氨酸(NMDA)受体抑制剂
NMDA受体(N-甲基-D-天冬氨酸受体)是中枢神经系统中的一种离子型谷氨酸受体,广泛表达于大脑的各个区域。NMDA受体的过度激活将导致钙离子内流增加,破坏细胞内钙稳态,进而引发一系列细胞内信号通路的紊乱,最终导致神经元死亡和AD样变化。NMDA受体拮抗剂如Memantine(AbMole,M3326)可通过抑制NMDA受体保护神经元,在多种动物模型(大鼠、小鼠)中表现出良好的AD抑制效果。例如Memantine可保护由Aβ1-40 诱导的大鼠神经元细胞损伤[4]。


图 2. Memantine对淀粉样β蛋白1-42处理的大鼠海马神经元细胞的保护作用示意图[4]
3. 毒蕈碱受体(mAChR)激活剂
毒蕈碱受体(mAChR)在哺乳动物的认知功能中扮演着重要的角色,分为M1至M5五个亚型,广泛分布于大脑皮层、海马和基底神经节等区域,与认知功能密切相关。Blarcamesine(AbMole,M6203)和ML380(AbMole,M28716)是mAChR的激动剂,可通过调节细胞内钙稳态,减少Aβ蛋白对神经元的毒性作用,这种调节作用有助于维持神经元的正常功能,减少神经退行性变化。
4. 烟碱型乙酰胆碱受体(nAChRs)激动剂
烟碱型乙酰胆碱受体(nAChRs)激动剂也是AD动物模型研究中常用的一类工具化合物。ABT-089(Pozanicline,AbMole,M8553)是烟碱 α4β2和α6β2受体的激动剂,可显著改善实验动物的认知功能[5]。Varenicline(CP 526555,AbMole,M6268)、Isopronicline(TC-1734,ACD3480AbMole,M29693)作为α4β2或α7 nAChR的激动剂可以在多种动物体内调节神经递质释放、减少氧化应激和炎症反应,提供神经保护以及增强突触可塑性,促进学习和记忆[5]。
二、作用于淀粉样蛋白(Aβ)的抑制剂
淀粉样蛋白的异常聚集是AD的核心标志之一。Aβ蛋白的异常产生和清除失衡导致其在脑内聚集,形成寡聚体和原纤维并破坏突触的结构与功能。Aβ蛋白的形成是一个多步骤的蛋白水解过程,核心涉及淀粉样前体蛋白(APP)的切割。APP是一种表达于神经元表面的跨膜蛋白,在正常生理条件下,APP 更易被α-分泌酶切割。但当APP被 β-分泌酶(如BACE1)首先切割时,则会产生 C 端片段(C99),C99则进一步被γ-分泌酶切割后将产生不同长度的 Aβ肽段,包括Aβ1-40(约占 90%)和 Aβ1-42(约占 10%)。Aβ1-42 (Amyloid β-Peptide 1-42)因疏水性更强,更易发生错误折叠并形成聚集物,也是动物AD模型最常用的造模剂之一[6]。


图 3. 淀粉样蛋白的产生示意图[6]
1. Aβ蛋白合成抑制剂
β分泌酶抑制剂
β-分泌酶(也称为β位点APP裂解酶; BACE1),是切割APP并产生Aβ蛋白的起始和核心步骤。β-分泌酶在AD研究领域中一直是热门靶点,Verubecestat (MK-8931,AbMole,M9386) 可通过高亲和力结合BACE1的疏水位点,抑制其活性,Verubecestat在小鼠和灵长类动物模型中显著降低了脑脊液和大脑中的Aβ蛋白水平[7]。此外, AZD3293 (Lanabecestat,AbMole,M5227) 、Atabecestat (JNJ-54861911,AbMole,M10943) 、Elenbecestat (E2609,AbMole,M10942) 、Umibecestat(CNP520,AbMole,M28304)、LY2886721(AbMole,M1987)等也是动物实验中常用的β-分泌酶(BACE1)抑制剂。
γ分泌酶抑制剂和调节剂
γ-分泌酶是负责Aβ生成最后一步的酶,也是AD研究的另一个重要靶点。Semagacestat(LY450139,AbMole,M2277)是一种经典的γ-分泌酶抑制剂(GSIs),通过抑制γ-分泌酶的活性,减少Aβ蛋白的产生。Avagacestat(BMS-708163,AbMole,M1947)则是一种选择性的γ-分泌酶抑制剂,能够在降低Aβ蛋白水平的同时减少对Notch信号通路的影响。Nirogacestat(PF-3084014,AbMole,M9041)是一种可以通过灌胃形式或混在动物饮用水中给予实验动物的γ-分泌酶抑制剂,适合长期研究使用。Begacestat(GSI-953,AbMole,M3619)也是一种对Notch-1通路具有低抑制活性的γ-分泌酶抑制剂,能够优先抑制APP的切割,保留Notch1的信号。除了上述几款抑制剂,LY-411575(LSN-411575,AbMole,M2130)、MK-0752(AbMole,M2120)等抑制剂也可用于动物AD模型的研究,抑制Aβ的产生。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
α-分泌酶激活剂
α分泌酶活性的上调可以促进APP 以非淀粉样蛋白的形式切割,以此减少 Aβ蛋白的形成并增加可溶性结构域(sAPPα)的产生。Etazolate(AbMole,M56752)是磷酸二酯酶 (PDE4) 抑制剂和GABAα受体调节剂,有文献证实Etazolate可激活神经元α分泌酶,在具体实验中Etazolate可以通过口服形式给与动物,便于开展实验研究[7]。Bryostatin-1(苔藓抑素1,AbMole,M7647)、Epigallocatechin Gallate(EGCG,表没食子儿茶素没食子酸酯,AbMole,M4208)等调节剂可通过激活蛋白激酶C(PKC)提高α-分泌酶的活性,促进APP的非淀粉样蛋白途径代谢[8]。Gemfibrozil(AbMole,CI-719,M7822)则可通过刺激ADAM10(α-分泌酶家族重要亚型)的启动子活性,增加ADAM10的表达,从而减少Aβ蛋白的产生。雌二醇(Estradiol,β-Estradiol,AbMole,M5625)是一种激素,最近的文献发现雌二醇可通过激活Akt和mTOR信号通路,增加α-分泌酶的活性,促进APP的非淀粉样蛋白途径代谢[9]。
2. Aβ蛋白聚集抑制剂
Aβ蛋白产生神经毒性的主要机制之一是聚集体的形成。在动物实验中,Aβ蛋白聚集抑制剂通过阻止Aβ蛋白的聚集,可减少后者对神经元的毒性。铜和锌离子等金属离子在Aβ蛋白的聚集过程中起关键作用,Clioquinol(PBT1,AbMole,M5528)是一种羟基喹啉离子载体,可通过螯合上述金属离子减少Aβ蛋白的聚集[10]。Scyllo-inositol(Scyllitol,AZD103, ELND-005,AbMole,M21016)可通过稳定Aβ1-42的低聚态构象,阻止Aβ蛋白的进一步聚集。在动物研究中,Scyllo-inositol(ELND-005)降低了可溶性和不溶性 Aβ1–40的浓度,并改善了突触丢失和神经胶质炎症反应。此外,胰岛素信号传导在维持突触功能和认知功能中起着重要作用,Scyllo-inositol(AZD 103, ELND-005)还能增强胰岛素信号传导改善实验动物的认知和学习能力[11]。
三、靶向Tau蛋白的调节剂
Tau(微管相关蛋白Tau,MAPT)是一种细胞质蛋白,主要的生理功能是与微管蛋白结合,稳定微管。在阿尔茨海默症中,Tau蛋白异常磷酸化,产生对神经元有害的聚集体(神经原纤维缠结)。以Tau蛋白为靶点的调节剂主要分为两类,第一类是调节Tau磷酸化相关的信号通路、激酶或者去磷酸化酶(如GSK3、PP2A等);第二类则是抑制磷酸化Tau蛋白形成缠结。
1. Tau蛋白磷酸化调节剂
Valproic acid(AbMole,M1876)、SB216763(AbMole,M2061)、Tideglusib (NP-12,NP031112,AbMole,M2306)等化合物是高效的GSK3抑制剂,可通过抑制GSK-3β的活性,减少Tau蛋白在多个位点(如 Ser396、Thr231)的磷酸化。在动物模型中,这类抑制剂可降低Tau磷酸化水平,并改善与Tau相关的神经元结构异常。还有研究发现细胞周期蛋白依赖性激酶 5(CDK5)在神经元中过度激活时会导致Tau磷酸化。Roscovitine(Seliciclib, CYC202,AbMole,M1974)可特异性抑制CDK5的活性,在实验中能减少Tau磷酸化产物的生成。蛋白磷酸酶2A(PP2A)是Tau去磷酸化的主要酶类,Forskolin被文献证实可以通过激活PP2A,增强Tau的去磷酸化。Davunetide(NAP,AbMole,M29256)是一种由8个氨基酸组成的多肽,来源于活性依赖性神经保护蛋白 (ADNP)。Davunetide已在阿尔茨海默症动物模型中进行了测试,并表现出调节微管组装,以及抑制Tau过度磷酸化和减少Aβ蛋白等功能。
2. Tau蛋白聚集抑制剂
Methylene blue(亚甲蓝,亚甲基蓝,AbMole,M5783)可与Tau蛋白的聚集核心结合,抑制Tau原纤维的形成,并促进已形成的聚集体解聚,Methylene blue被用于减少小鼠模型中Tau聚集物的沉积,改善神经元的存活状态。TRx0237(Leucomethylene blue mesylate,AbMole,M14554)是一种Methylene blue (亚甲基蓝)的一种还原形式,在阿尔兹海默症动物模型中的早期Tau蛋白的聚集表现出显著的抑制活性。Curcumin(Diferuloylmethane,姜黄素,AbMole,M2198)是一种具有多种活性的天然产物,近期有研究发现Curcumin可抑制Tau蛋白的聚集。Lithium chloride(LiCl,氯化锂,M9977)也是一种GSK3抑制剂,广泛用于中枢神经系统特别是AD模型的研究。
3. 靶向Tau蛋白的其它调节剂
Salsalate(Disalicylic acid,双水杨酸酯,AbMole,M2998)是一种小分子非甾体抗炎剂,已被证明可以抑制Tau乙酰化。在转基因小鼠模型中,Salsalate降低了海马萎缩并减少了记忆缺陷。LY3372689(Ceperognastat,AbMole,M29407)是一种O-GlcNAcase (OGA) 酶抑制剂,O-GlcNAcase酶负责去除蛋白质上的O-GlcNAc修饰。LY3372689通过抑制OGA,进而增加Tau蛋白的O-GlcNAcylation水平,减少Tau蛋白在相关位点的磷酸化,降低Tau蛋白的聚集倾向。TPI-287(Abeotaxane,AbMole,M30686)是一种合成的紫杉烷衍生物,最初用于研究中枢神经系统恶性肿瘤。TPI-287通过靶向微管蛋白(Tubulin),发挥微管稳定作用。在正常神经元中,Tau蛋白有助于微管的稳定,而当Tau蛋白功能失调时,微管会变得不稳定,导致轴突运输受损。TPI-287通过稳定微管,有助于补偿因Tau蛋白功能失调导致的微管不稳定性。在Tau转基因小鼠模型中,TPI-287能够降低大脑中过度磷酸化的Tau蛋白水平,并改善认知表现。Nicotinamide(Niacinamide,烟酰胺,AbMole,M4896)是NAD和NADP的活性成分,烟酰胺可以预防阿尔茨海默症小鼠模型的认知缺陷,并能降低磷酸化Tau蛋白(Thr231)在大脑中的浓度。此外,烟酰胺还能抑制大脑sirtuin脱乙酰酶,上调乙酰基α-微管蛋白、蛋白 p25 和 MAP2c,上述这些变化都与微管稳定性的增加有关。
四、靶向线粒体功能障碍的调节剂
靶向细胞器(例如线粒体)是抑制阿尔茨海默症的一种新方法,与目前主导研究的以蛋白质为重点的策略不同。线粒体功能障碍在阿尔茨海默症早期发生,促进突触损伤和细胞凋亡,并被认为是神经退化的重要因素[12]。 MitoQ(Mitoquinone,AbMole,M9068)是一种线粒体靶向抗氧化剂,能够穿透线粒体并中和自由基,从而减少氧化应激[13]。 Latrepirdine(Dimebolin,AbMole,M2231)是一种具有神经保护、抗凋亡作用等多种活性的化合物,Dimebon抑制线粒体通透性转换孔(mPTP)的开放,增加线粒体膜电位,改善ATP合成。Latrepirdine在动物实验中显示出改善认知和学习的效果。除了上述几种化合物,Resveratrol(SRT501,白藜芦醇,AbMole,M2267)等也可以增强线粒体功能、减少氧化应激并抑制AD动物模型中的退行性神经变化。


图 4. AD模型中与线粒体功能的破坏[13]
五、靶向神经炎症的抑制剂
在阿尔茨海默症(AD)的形成机制中,神经炎症被认为是驱动神经元损伤和认知功能衰退的关键环节之一。这种炎症反应主要由小胶质细胞、星形胶质细胞的异常激活及促炎因子的过度释放介导,并与β-淀粉样蛋白(Aβ)沉积、Tau蛋白聚集形成恶性循环。Masitinib(AB1010,AbMole,M1838)是一种新型的,具有口服活性的Kit和PDGFRα/β抑制剂,可通过调节小胶质细胞和星形胶质细胞的激活来减轻神经炎症,可用于研究动物AD模型。Triolex(NE3107,AbMole,M40910)、Selnoflast(RO-7486967,AbMole,M54582)等免疫调节剂也在AD研究中有着重要的应用。Azeliragon(TTP488,AbMole,M9483)是一种RAGE(晚期糖基化终末产物受体)抑制剂,Azeliragon通过与RAGE的细胞外结构域竞争结合,阻止RAGE与其配体(如Aβ、AGEs、HMGB1和S100B)的结合,从而抑制RAGE的激活,这种抑制作用可以减少炎症信号的传导,减轻神经炎症。在转基因小鼠模型中,Azeliragon显著减少了中枢神经系统中的Aβ沉积和炎症标志物(如TNF-α、TGF-β和IL-1)的表达,并改善了认知功能[14]。
范例详解
1. Sci Adv. 2025 Feb 7;11(6):eadq6038.
南洋理工大学的科研团队在上述研究中探究了阿尔茨海默症(AD)小鼠模型中脑内巨噬细胞(包括小胶质细胞和边界相关巨噬细胞,BAMs)的脂滴(LDs)积累与 β 淀粉样蛋白(Aβ)清除功能的关系,核心发现如下:AD模型小鼠(APP-KI)中,靠近 Aβ 斑块的小胶质细胞(尤其是CD11c⁺激活亚型)和 CD206⁺BAMs脂滴积累显著增多。小胶质细胞的脂滴含量与吞噬 Aβ蛋白、凋亡细胞的能力呈负相关,脂滴积累导致其吞噬功能受损。AbMole的Methoxy-XO4(AbMole,M6952)是一种能穿过血脑屏障的荧光探针,可特异性标记脑内的 Aβ。在上述文章中被实验人员用于探究小胶质细胞对Aβ蛋白的吞噬能力:通过检测小胶质细胞对 Methoxy-XO4 标记的Aβ的摄取率,直接评估小胶质细胞的体内Aβ吞噬活性[15]。


图 5. Microglial FIT2 deficiency reduces Aβ load in the AD brain[15]
2. Small Struct. 2024, 5, 2400241.
中国科学院苏州生物医学工程与技术研究所、山东第一医科大学的科研人员在该文章中,开发了一种序列响应肽-DNA(SRPD)纳米生物传感器,用于检测阿尔茨海默症(AD)相关的淀粉样蛋白信号通路中的上游分子β-分泌酶(BACE1)的活性和下游β淀粉样蛋白寡聚体(Aβ蛋白)的水平。由AbMole提供的LY2811376 (AbMole,M2172)作为一种已知的高效 BACE1 抑制剂,在该研究中作为阳性对照,用于验证上述传感器对BACE1活性的检测能力:通过检测不同浓度的LY2811376 处理后检测传感器的信号变化,证明该传感器可检测到BACE1的蛋白酶活性变化[16]。


图 6. Inhibition of BACE1 by the LY2811376. A) SWV curves of incubation with different concentrations of LY2811376 (0, 0.01, 0.1, 1, and 10 μm)[16]


参考文献及鸣谢
[1] Marco Racchi, Michela Mazzucchelli, S. Carolina Lenzken, et al., Role of acetylcholinesterase inhibitors in the regulation of amyloid β precursor protein (AβPP) metabolism, Chemico-Biological Interactions 157-158 (2005) 335-338.
[2] Marta Goschorska, Izabela Gutowska, Irena Baranowska-Bosiacka, et al., Influence of Acetylcholinesterase Inhibitors Used in Alzheimer’s Disease Treatment on the Activity of Antioxidant Enzymes and the Concentration of Glutathione in THP-1 Macrophages under Fluoride-Induced Oxidative Stress, 16(1) (2019) 10.
[3] Jae-Kwon Jo, Gihyun Lee, Cong D. Nguyen, et al., Effects of Donepezil Treatment on Brain Metabolites, Gut Microbiota, and Gut Metabolites in an Amyloid Beta-Induced Cognitive Impairment Mouse Pilot Model, Molecules (Basel, Switzerland), 2022.
[4] N. M. Rozumna, V. V. Hanzha, E. A. Lukyanetz, Memantine protects the cultured rat hippocampal neurons treated by NMDA and amyloid β1-42, Frontiers in neuroscience 17 (2023) 1269664.
[5] A. Crestini, E. Carbone, R. Rivabene, et al., A Systematic Review on Drugs Acting as Nicotinic Acetylcholine Receptor Agonists in the Treatment of Dementia, Cells 13(3) (2024).
[6] A. Delport, R. Hewer, The amyloid precursor protein: a converging point in Alzheimer's disease, Molecular neurobiology 59(7) (2022) 4501-4516.
[7] S. Singh, F. Yang, A. Sivils, et al., Amylin and Secretases in the Pathology and Treatment of Alzheimer's Disease, Biomolecules 12(7) (2022).
[8] A. E. Abdallah, Review on anti-alzheimer drug development: approaches, challenges and perspectives, RSC advances 14(16) (2024) 11057-11088.
[9] Y. J. Cheng, C. H. Lin, H. Y. Lane, From Menopause to Neurodegeneration-Molecular Basis and Potential Therapy, International journal of molecular sciences 22(16) (2021).
[10] Y. J. Kang, Y. N. Diep, M. Tran, et al., Therapeutic Targeting Strategies for Early- to Late-Staged Alzheimer's Disease, International journal of molecular sciences 21(24) (2020).
[11] J. Pitt, M. Thorner, D. Brautigan, et al., Protection against the synaptic targeting and toxicity of Alzheimer's-associated Aβ oligomers by insulin mimetic chiro-inositols, FASEB journal : official publication of the Federation of American Societies for Experimental Biology 27(1) (2013) 199-207.
[12] P. H. Reddy, M. F. Beal, Amyloid beta, mitochondrial dysfunction and synaptic damage: implications for cognitive decline in aging and Alzheimer's disease, Trends in molecular medicine 14(2) (2008) 45-53.
[13] S. Bhatia, R. Rawal, P. Sharma, et al., Mitochondrial Dysfunction in Alzheimer's Disease: Opportunities for Drug Development, Current neuropharmacology 20(4) (2022) 675-692.
[14] D. Kothandan, D. S. Singh, G. Yerrakula, et al., Advanced Glycation End Products-Induced Alzheimer's Disease and Its Novel Therapeutic Approaches: A Comprehensive Review, Cureus 16(5) (2024) e61373.
[15] X. Wu, J. A. Miller, B. T. K. Lee, et al., Reducing microglial lipid load enhances β amyloid phagocytosis in an Alzheimer's disease mouse model, Science advances 11(6) (2025) eadq6038.
[16] Tao Cheng, Peifen Lu, Yixi Dong, et al., A Bilingual Nanobiosensor for Cross‐Category Integrated Decoding of the Beta‐Site Amyloid Precursor Protein‐Cleaving Enzyme 1–Aβ Oligomer Signaling Pathway, Small Structures 5(11) (2024).
相关文章
更多 >

