实验研究:慢病毒感染RAW264.7细胞的一般MOI值
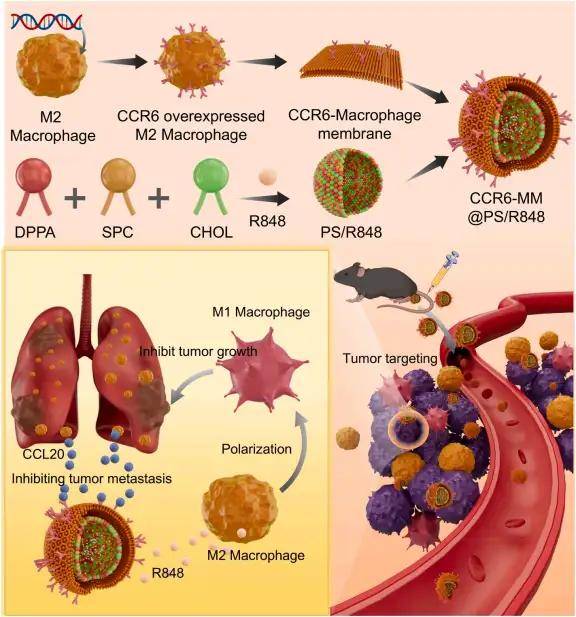
2025-12-08 来源:本站 点击次数:71非小细胞肺癌(NSCLC)是肺癌中最常见的类型,预后较差且转移率高,其转移过程涉及复杂机制,包括肿瘤相关巨噬细胞(TAMs)分泌的趋化因子。现有靶向趋化因子的策略如单克隆抗体、小分子抑制剂等存在肿瘤靶向性差、生物相容性低的问题。2025年11月,中山大学附属第三医院张凯、黄帅、徐建南联合中山大学附属第一医院吉喆研究团队在Materials Today Bio (IF 10.2)发表题为“Targeting chemokine-driven metastasis in non-small cell lung cancer: Development and evaluation of chemokine nanosponges for therapy”的研究论文,构建了CCR6修饰巨噬细胞膜(CCR6-MM)包裹Toll样受体7/8激动剂R848的趋化因子纳米海绵(CCR6-MM@PS/R848),该纳米海绵兼具CCL20吸附靶向能力与M2型TAMs向M1型极化功能,经体外和体内实验验证,其具有良好生物相容性,能双重抑制肿瘤生长与转移,为NSCLC转移治疗提供了新型策略。

· 维真助力·
病毒产品:Lv-CCR6
感染细胞:RAW264.7细胞
MOI:50
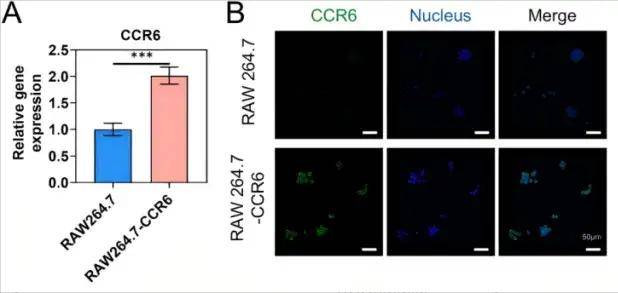
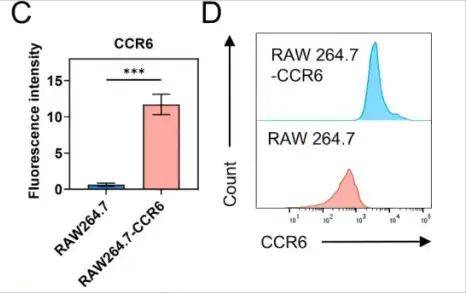
RAW264.7细胞中CCR6表达显著增加
研究结果
1.CCR6-MM@PS/R848的构建、表征及生物相容性评估
单细胞测序分析发现,NSCLC转移灶中M2型巨噬细胞通过高表达趋化因子CCL20驱动肿瘤转移,这为靶向CCL20-CCR6轴提供了理论依据。研究人员利用慢病毒转染RAW264.7细胞,使其高表达CCR6(CCL20的受体),提取其细胞膜制备成CCR6修饰的巨噬细胞膜(CCR6-MM),然后使用薄膜水合法制备含R848(TLR7/8激动剂)的脂质体(PS/R848),将CCR6-MM与PS/R848融合,形成纳米海绵复合物。验证结果显示CCR6-MM@PS/ R848复合物在掺入R848组分的同时保留了原始细胞膜的功能特征,并能在体外和体内有效靶向表达CCR6的细胞和组织。生物相容性评估表明,CCR6-MM@PS/R848纳米颗粒在细胞和动物层面均展现出优异的安全性,该制剂无细胞毒性、溶血和器官毒性,表明其是进一步临床前和临床开发的有希望的候选药物。
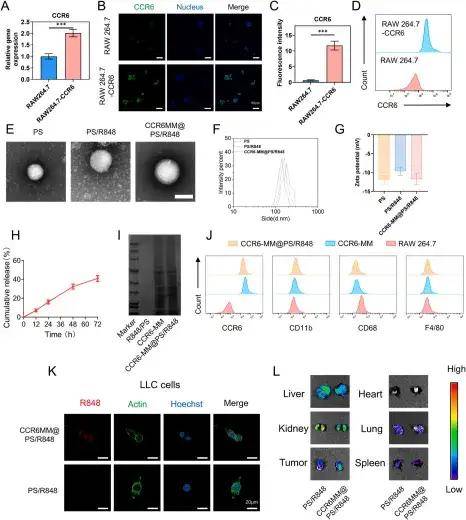 CCR6-MM@PS/R848的表征
CCR6-MM@PS/R848的表征
2.CCR6-MM@PS/R848将M2巨噬细胞重编程为M1表型
接下来,研究团队研究了CCR6-MM@PS/R848将Raw264.7巨噬细胞从M2表型重编程为M1表型的能力。结果显示,经CCR6-MM@PS/R848处理的细胞从M2典型的细长纺锤形转变为M1典型的多角形形态,且M1标志物上调,M2标志物下调;同时细胞因子分泌谱改变,促炎性的M1特征细胞因子分泌增加,抑炎性的M2特征细胞因子分泌减少。这些结果表明,CCR6-MM@PS/R848具有强大的将M2巨噬细胞重编程为M1表型的能力。皮下肿瘤模型中,CCR6-MM@PS/R848组肿瘤体积显著小于其他组,Ki67阳性率最低(细胞增殖受抑),肿瘤组织坏死区域显著。进一步的研究表明,CCR6-MM@PS/R848在体内同样能有效地将肿瘤相关巨噬细胞从促瘤的M2表型重编程为抗瘤的M1表型。
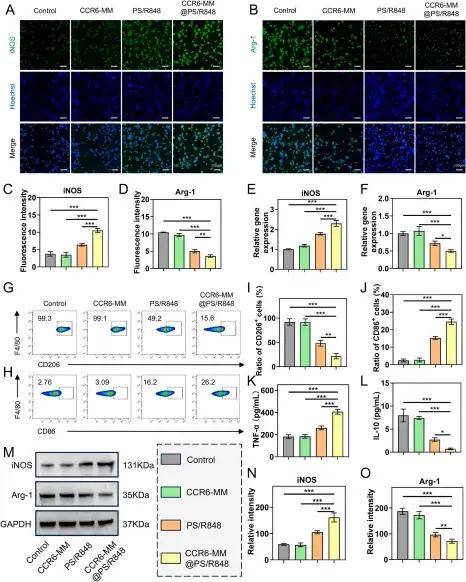
CCR6-MM@PS/R848体外促进RAW264.7细胞M1极化
3.CCR6-MM@PS/R848抑制肺癌细胞转移
最后,研究团队探究了该纳米颗粒对肿瘤细胞恶性行为的影响。ELISA检测证实,经CCR6-MM@PS/R848处理的巨噬细胞,其培养上清中的CCL20浓度因巨噬细胞M2向M1表型重编程和CCR6膜对CCL20的主动吸附而显著下降。使用上述处理后的巨噬细胞培养上清来培养肺癌细胞(LLC),发现肺癌细胞的迁移和侵袭数量均显著减少,表明CCR6-MM@PS/R848对巨噬细胞的重编程有效地抑制了LLC细胞的转移潜能。在实验性肺转移模型中,体内研究进一步验证了其疗效:与对照组相比,CCR6-MM@PS/R848治疗组小鼠的生存期显著延长,肺脏转移结节数量显著减少。免疫组化与ELISA分析均显示,治疗组肿瘤组织中的CCL20水平显著降低,明确了其体内作用机制。上述体内外结果一致表明,CCR6-MM@PS/R848能有效抑制肺癌转移,且在整个过程中保持良好的生物相容性,凸显了其巨大的治疗潜力。
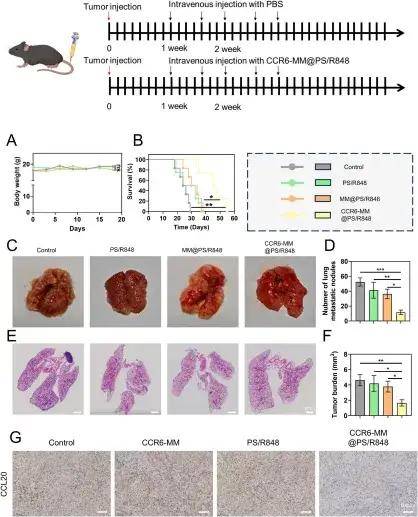
通过CCR6-MM@PS/R848进行的体内抗肿瘤转移
研究结论
本研究通过单细胞RNA测序技术,发现转移灶中M2型肿瘤相关巨噬细胞的趋化因子分泌功能增强,其中CCL20成为关键靶点。体外及体内实验验证了CCR6-MM与R848组合的治疗潜力,证实其具有良好生物相容性、巨噬细胞极化效能,并能双重抑制肿瘤生长与转移,揭示了趋化因子纳米海绵作为NSCLC转移治疗新策略的巨大潜力。