小鼠肝胆管类器官构建试剂助力RG7388通过靶向p53抑制SFTSV复制
2026-01-28 来源:本站 点击次数:80
研究背景:SFTSV的威胁与抗病毒研究需求
严重发热伴血小板减少综合征病毒(SFTSV)是一种新兴布尼亚病毒,可引起严重的发热伴血小板减少综合征(SFTS),且呈现全球传播趋势,对人类健康构成重大威胁。然而,SFTSV的致病机制尚未完全明确,缺乏有效的抗病毒药物。
研究思路:从“现象矛盾”到“机制突破”的逻辑链
核心研究成果:三大突破推动抗病毒研究
Absin助力科研:从工具到解决方案
本研究的突破不仅揭示了SFTSV的致病机制,更展示了类器官模型在抗病毒研究中的重要价值。Absin作为生命科学百宝箱,始终致力于为科研工作者提供高质量的实验试剂与服务——从类器官构建、细胞生物学检测到分子机制研究,Absin的产品覆盖研究全流程,助力更多像“RG7388抗SFTSV”这样的突破性成果诞生。
文中使用产品 更多类器官培养试剂盒
严重发热伴血小板减少综合征病毒(SFTSV)是一种新兴布尼亚病毒,可引起严重的发热伴血小板减少综合征(SFTS),且呈现全球传播趋势,对人类健康构成重大威胁。然而,SFTSV的致病机制尚未完全明确,缺乏有效的抗病毒药物。
近期,天津大学等团队在《Science Bulletin》发表研究论文,揭示了SFTSV抑制宿主凋亡的关键机制,并证实MDM2抑制剂RG7388可通过靶向p53-Apaf-1轴抑制SFTSV复制。其中,Absin 的小鼠肝胆管类器官构建试剂为该研究的体外模型验证提供了核心支持。
文献标题:RG7388 inhibits SFTSV replication by suppressing MDM2-mediated p53 degradation and preventing apoptosome disruption
发表期刊:Science Bulletin(IF 21.1)
DOI:https://doi.org/10.1016/j.jtho.2025.02.029
核心试剂:小鼠肝类器官培养基、基质胶
1. 初始矛盾:SFTSV诱导线粒体损伤却不激活凋亡
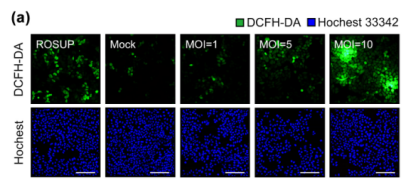
研究团队首先观察到一个关键现象:SFTSV感染会导致宿主细胞线粒体损伤(如活性氧ROS积累、膜电位丢失),但并未引发典型的细胞凋亡(无明显细胞病变CPE、无胱天蛋白酶Caspase激活)。这一矛盾提示SFTSV可能通过特定机制“阻断”凋亡信号通路,为病毒复制创造有利环境。
为解析SFTSV的“抗凋亡”机制,团队通过蛋白质组学、转录组学和泛素化组学分析,发现SFTSV感染后宿主p53信号通路显著下调。p53是关键的抑癌基因,也是凋亡调控的核心分子,可通过转录激活下游靶基因(如Apaf-1)启动凋亡。进一步验证显示,SFTSV以时间和感染复数(MOI)依赖的方式降低p53蛋白水平。
3. 深入验证:MDM2介导的p53泛素化降解
通过泛素化实验和突变体验证,团队发现SFTSV通过MDM2(p53的E3泛素连接酶)介导p53的K48位泛素化降解,且p53的K351位点是关键靶标。敲低MDM2后,SFTSV对p53的降解能力显著减弱,同时病毒复制被抑制,证实MDM2-p53轴是SFTSV的关键作用靶点。
p53可通过转录激活Apaf-1(凋亡小体的核心组分)启动Caspase级联反应。研究发现,SFTSV不仅降解p53,还抑制p53对Apaf-1的转录激活,阻断凋亡小体组装。敲低Apaf-1可显著降低SFTSV感染后的凋亡水平,进一步证实Apaf-1是p53下游的关键效应分子。
RG7388(idasanutlin)是一种MDM2抑制剂,可阻断MDM2与p53的相互作用。研究显示,RG7388可显著恢复SFTSV感染细胞中p53和Apaf-1的水平,激活凋亡并抑制病毒复制。为模拟体内环境,团队还构建了小鼠肝胆管和小肠类器官模型,验证RG7388的抗病毒效果——这一步正是基于Absin的类器官构建试剂实现的。
Absin产品助力:小鼠肝胆管类器官模型的关键构建
研究团队首先观察到一个关键现象:SFTSV感染会导致宿主细胞线粒体损伤(如活性氧ROS积累、膜电位丢失),但并未引发典型的细胞凋亡(无明显细胞病变CPE、无胱天蛋白酶Caspase激活)。这一矛盾提示SFTSV可能通过特定机制“阻断”凋亡信号通路,为病毒复制创造有利环境。
 |
 |
左:SFTSV感染导致HeLa细胞ROS积累(Fig.S1a);右:SFTSV感染后HeLa细胞无明显CPE
2. 机制探索:组学筛选锁定p53通路为解析SFTSV的“抗凋亡”机制,团队通过蛋白质组学、转录组学和泛素化组学分析,发现SFTSV感染后宿主p53信号通路显著下调。p53是关键的抑癌基因,也是凋亡调控的核心分子,可通过转录激活下游靶基因(如Apaf-1)启动凋亡。进一步验证显示,SFTSV以时间和感染复数(MOI)依赖的方式降低p53蛋白水平。
3. 深入验证:MDM2介导的p53泛素化降解
通过泛素化实验和突变体验证,团队发现SFTSV通过MDM2(p53的E3泛素连接酶)介导p53的K48位泛素化降解,且p53的K351位点是关键靶标。敲低MDM2后,SFTSV对p53的降解能力显著减弱,同时病毒复制被抑制,证实MDM2-p53轴是SFTSV的关键作用靶点。

p53可通过转录激活Apaf-1(凋亡小体的核心组分)启动Caspase级联反应。研究发现,SFTSV不仅降解p53,还抑制p53对Apaf-1的转录激活,阻断凋亡小体组装。敲低Apaf-1可显著降低SFTSV感染后的凋亡水平,进一步证实Apaf-1是p53下游的关键效应分子。

RG7388(idasanutlin)是一种MDM2抑制剂,可阻断MDM2与p53的相互作用。研究显示,RG7388可显著恢复SFTSV感染细胞中p53和Apaf-1的水平,激活凋亡并抑制病毒复制。为模拟体内环境,团队还构建了小鼠肝胆管和小肠类器官模型,验证RG7388的抗病毒效果——这一步正是基于Absin的类器官构建试剂实现的。

1. 产品在研究中的核心作用:构建体外生理相关模型
SFTSV主要感染肝脏、小肠等器官,传统细胞系(如HeLa、VERO)难以模拟体内器官的生理结构和细胞组成。为验证RG7388的体内相关性,研究团队需要构建与体内器官结构相似的类器官模型——Absin的小鼠肝胆管类器官构建试剂为这一需求提供了关键支持:
2. 产品价值:提升研究的体内相关性与转化潜力
类器官模型相比传统细胞系更接近体内生理环境,能够更准确地反映药物的体内效果。通过Absin类器官构建试剂获得的小鼠肝胆管类器官:
小鼠肝胆管类器官感染SFTSV后,p53和Apaf-1蛋白水平显著降低,证实该机制在类器官模型中保守存在
SFTSV主要感染肝脏、小肠等器官,传统细胞系(如HeLa、VERO)难以模拟体内器官的生理结构和细胞组成。为验证RG7388的体内相关性,研究团队需要构建与体内器官结构相似的类器官模型——Absin的小鼠肝胆管类器官构建试剂为这一需求提供了关键支持:
- 提供标准化的类器官构建方案,确保从小鼠肝脏分离的胆管细胞高效形成具有生理结构的类器官;
- 支持类器官的长期培养和感染实验,实现SFTSV在类器官中的稳定感染;
- 助力RG7388的体外药效验证,明确药物对类器官形态和病毒复制的影响。

Absin试剂构建的小鼠肝胆管类器官生长形态

RG7388处理后,SFTSV感染的类器官形态恢复,病毒载量降低
类器官模型相比传统细胞系更接近体内生理环境,能够更准确地反映药物的体内效果。通过Absin类器官构建试剂获得的小鼠肝胆管类器官:
- 验证了RG7388在器官水平的抗病毒活性,为后续体内实验提供了可靠依据;
- 证实SFTSV对p53-Apaf-1轴的抑制作用在类器官中同样存在,排除了细胞系特异性的干扰;
- 为其他病毒(如肝炎病毒、肠道病毒)的器官特异性感染研究提供了可复用的模型方案。

小鼠肝胆管类器官感染SFTSV后,p53和Apaf-1蛋白水平显著降低,证实该机制在类器官模型中保守存在
核心研究成果:三大突破推动抗病毒研究
1. 揭示SFTSV的全新致病机制
首次证实SFTSV通过MDM2介导的p53泛素化降解,以及抑制p53-Apaf-1轴阻断凋亡小体组装,为病毒复制创造“免疫逃逸”环境,填补了SFTSV抗凋亡机制的研究空白。
2. 证实RG7388的抗SFTSV潜力
RG7388作为已进入临床试验的MDM2抑制剂,在细胞和类器官模型中均能有效恢复p53功能,抑制SFTSV复制,为SFTSV感染的临床治疗提供了潜在候选药物。
3. 建立类器官抗病毒研究模型
基于Absin类器官构建试剂,成功建立小鼠肝胆管和小肠类器官感染模型,为病毒的器官特异性感染研究和药物筛选提供了更贴近体内的实验平台。
首次证实SFTSV通过MDM2介导的p53泛素化降解,以及抑制p53-Apaf-1轴阻断凋亡小体组装,为病毒复制创造“免疫逃逸”环境,填补了SFTSV抗凋亡机制的研究空白。
2. 证实RG7388的抗SFTSV潜力
RG7388作为已进入临床试验的MDM2抑制剂,在细胞和类器官模型中均能有效恢复p53功能,抑制SFTSV复制,为SFTSV感染的临床治疗提供了潜在候选药物。
3. 建立类器官抗病毒研究模型
基于Absin类器官构建试剂,成功建立小鼠肝胆管和小肠类器官感染模型,为病毒的器官特异性感染研究和药物筛选提供了更贴近体内的实验平台。
Absin助力科研:从工具到解决方案
本研究的突破不仅揭示了SFTSV的致病机制,更展示了类器官模型在抗病毒研究中的重要价值。Absin作为生命科学百宝箱,始终致力于为科研工作者提供高质量的实验试剂与服务——从类器官构建、细胞生物学检测到分子机制研究,Absin的产品覆盖研究全流程,助力更多像“RG7388抗SFTSV”这样的突破性成果诞生。
文中使用产品 更多类器官培养试剂盒
| 分类 | 货号 | 品名 | 规格 |
|---|---|---|---|
| 肝 | abs9544 | Organotial人正常肝类器官培养试剂盒 | 1kit |
| abs9786 | Organotial人肝胆管癌类器官培养试剂盒 | 1kit | |
| abs9516 | Organotial小鼠正常肝类器官培养试剂盒 | 1kit | |
| abs9552 | Organotial小鼠肝癌类器官培养试剂盒 | 1kit | |
| abs9779 | Organotial猪正常肝类器官培养基试剂盒 | 1kit | |
| 肠 | abs9545 | Organotial人正常肠类器官培养试剂盒 | 1kit |
| abs9445 | Organotial人肠癌类器官培养试剂盒 | 1kit | |
| abs9514 | Organotial小鼠正常小肠类器官培养试剂盒 | 1kit | |
| abs9985 | Organotial小鼠正常结肠类器官培养试剂盒 | 1kit | |
| abs9548 | Organotial小鼠肠癌类器官培养试剂盒 | 1kit | |
| abs9757 | Organotial Balb/C小鼠正常小肠类器官培养试剂盒 | 1kit | |
| abs9758 | Organotial Balb/C小鼠正常结肠类器官培养试剂盒 | 1kit | |
| abs9762 | Organotial大鼠正常小肠类器官培养试剂盒 | 1kit | |
| abs9763 | Organotial大鼠正常结肠类器官培养试剂盒 | 1kit | |
| abs9760 | Organotial大鼠胎鼠正常小肠类器官培养试剂盒 | 1kit | |
| abs9761 | Organotial大鼠胎鼠正常结肠类器官培养试剂盒 | 1kit | |
| abs9889 | Organotial猪正常肠类器官培养试剂盒 | 1kit | |
| 肠 | abs9911 | Organotial牛正常肠类器官培养试剂盒 | 1kit |
| abs90066 | Organotial鸡小肠类器官培养基试剂盒 | 1kit | |
| 缓冲液 | abs9731 | 类器官原代培养缓冲液 | 100ml/500ml |
| 辅助耗材 | abs7307 | 100um细胞筛网(160目,黄色) | 100个/箱 |
【免责声明】本文内容基于《Science Bulletin》(DOI: 10.1016/j.jtho.2025.02.029)原文献,由 AI 解读整理;文中涉及的原文献图片、数据等知识产权归原期刊及研究团队所有。若存在侵权情形,敬请及时联系我方删除,我方将积极配合处理。
相关文章
更多 >

