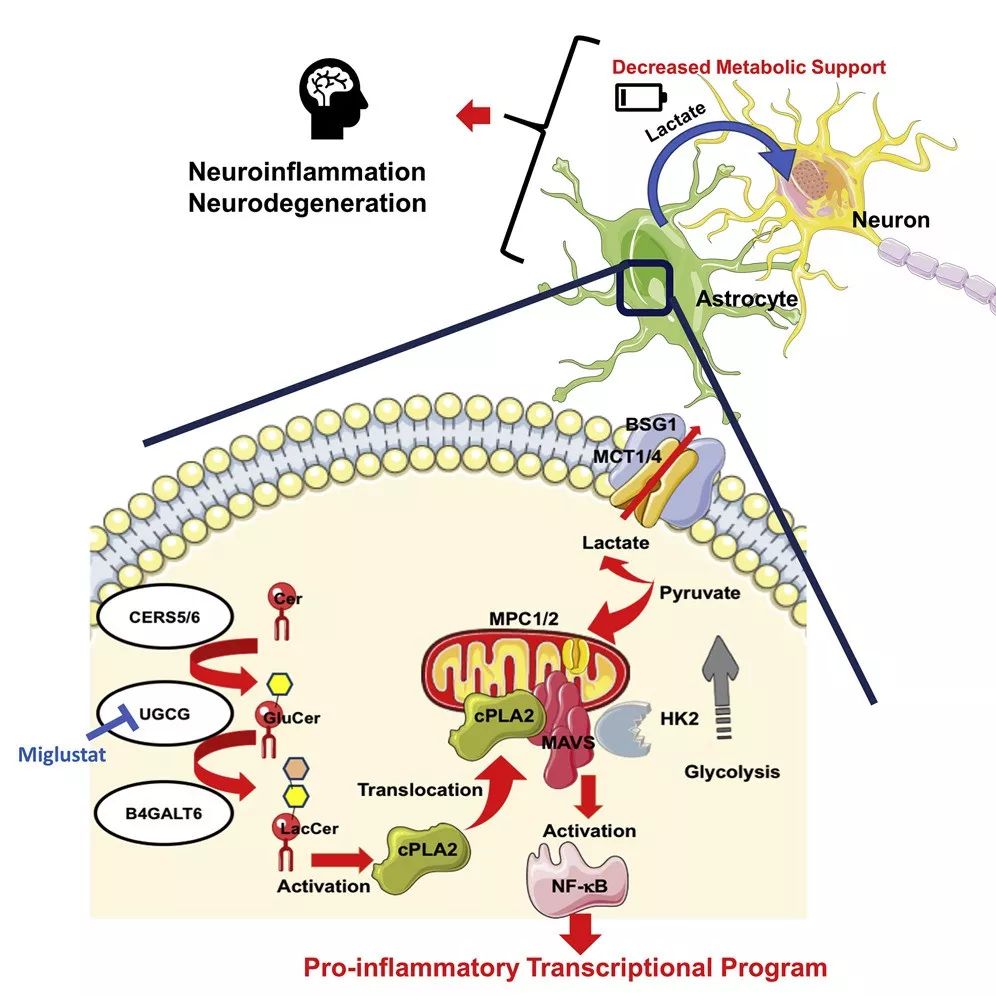
鞘脂代谢调控星形胶质细胞在中枢神经系统炎症中的作用
2021-09-27 来源:MedChemExpress 点击次数:1695研究团队发现,星形胶质细胞中的 cPLA2 的 C2 结构域与 MAVS 中的 CARD 结构域相互作用,在实验性自身免疫性脑脊髓炎 (EAE) 以及潜在的多发性硬化症 (MS) 中上调 NF-κB 驱使的转录,促进中枢神经系统 (CNS) 的炎症发生;cPLA2 被招募到 MAVS,破坏了 MAVS- 己糖激酶 2 (HK2) 间的相互作用,降低了 HK 的酶活以及参与神经元代谢的乳酸水平;Miglustat (一种于治疗 Gaucher 病和 Niemann-Pick 病的药物),能抑制星形胶质细胞的致病活性,改善 EAE。总而言之,这些发现定义了一种能驱动促炎性星形细胞的活动的新的免疫代谢机制,概述了 MAVS 在中枢神经系统炎症中的新作用,为治疗性干预提供了候选靶点。
星形胶质细胞中 LacCer 生物合成途径促进 NOD EAE 发展
研究人员利用非肥胖糖尿病 (NOD) 小鼠建立了 EAE 模型,通过相关基因表达和敲除分析,确定了星形胶质细胞中的乳糖神经酰胺 (LacCer) 生物合成途径促进 NOD EAE 的发展,证明了鞘脂代谢驱使星形胶质细胞活动,促进 CNS 炎症及神经退化。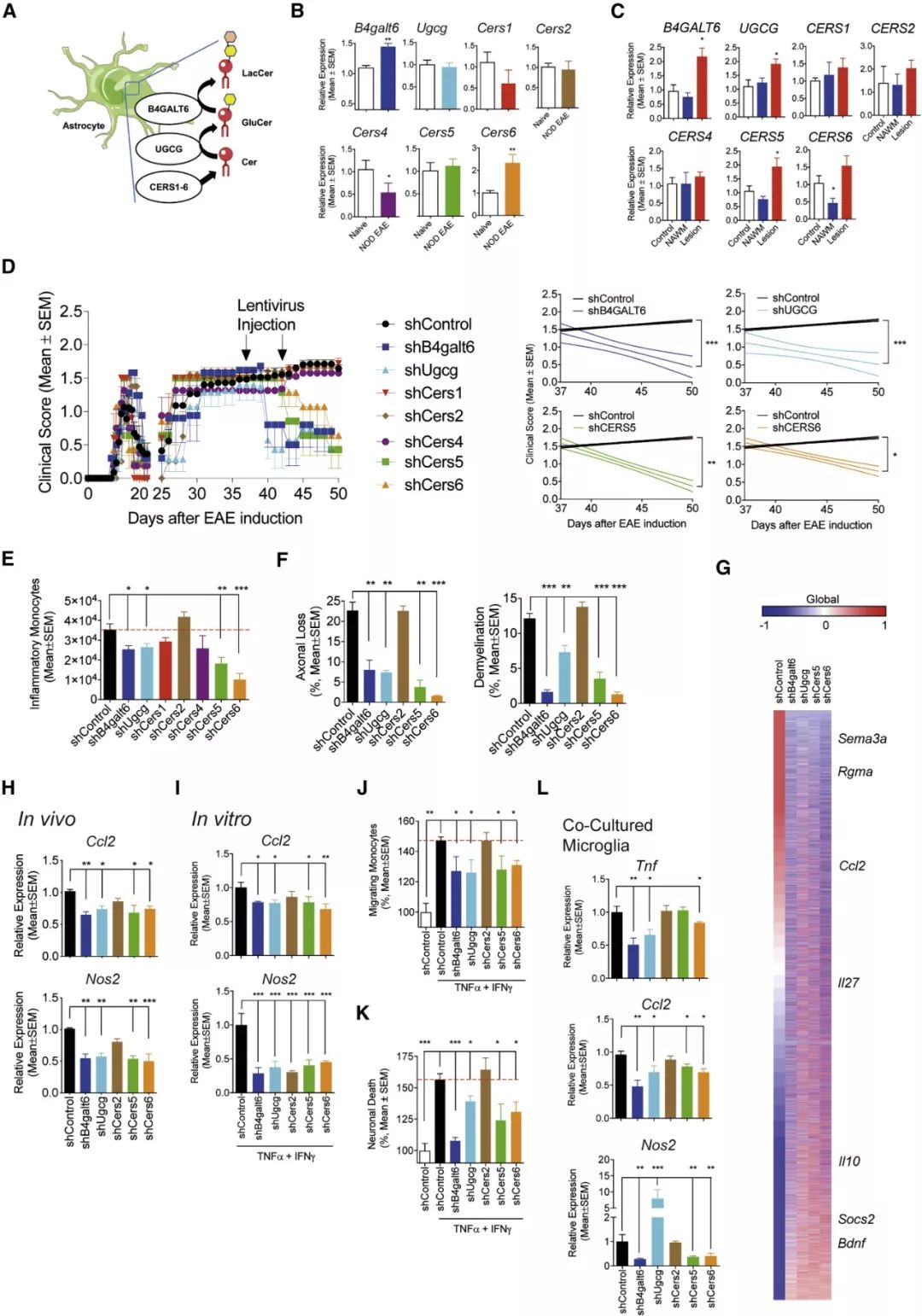
图 1. 星形胶质细胞中的 LacCer 生物合成途径促进 NOD EAE 进展
LacCer 诱导的 cPLA2-MAVS 信号传导驱动 NF-κB 依赖性促炎程序
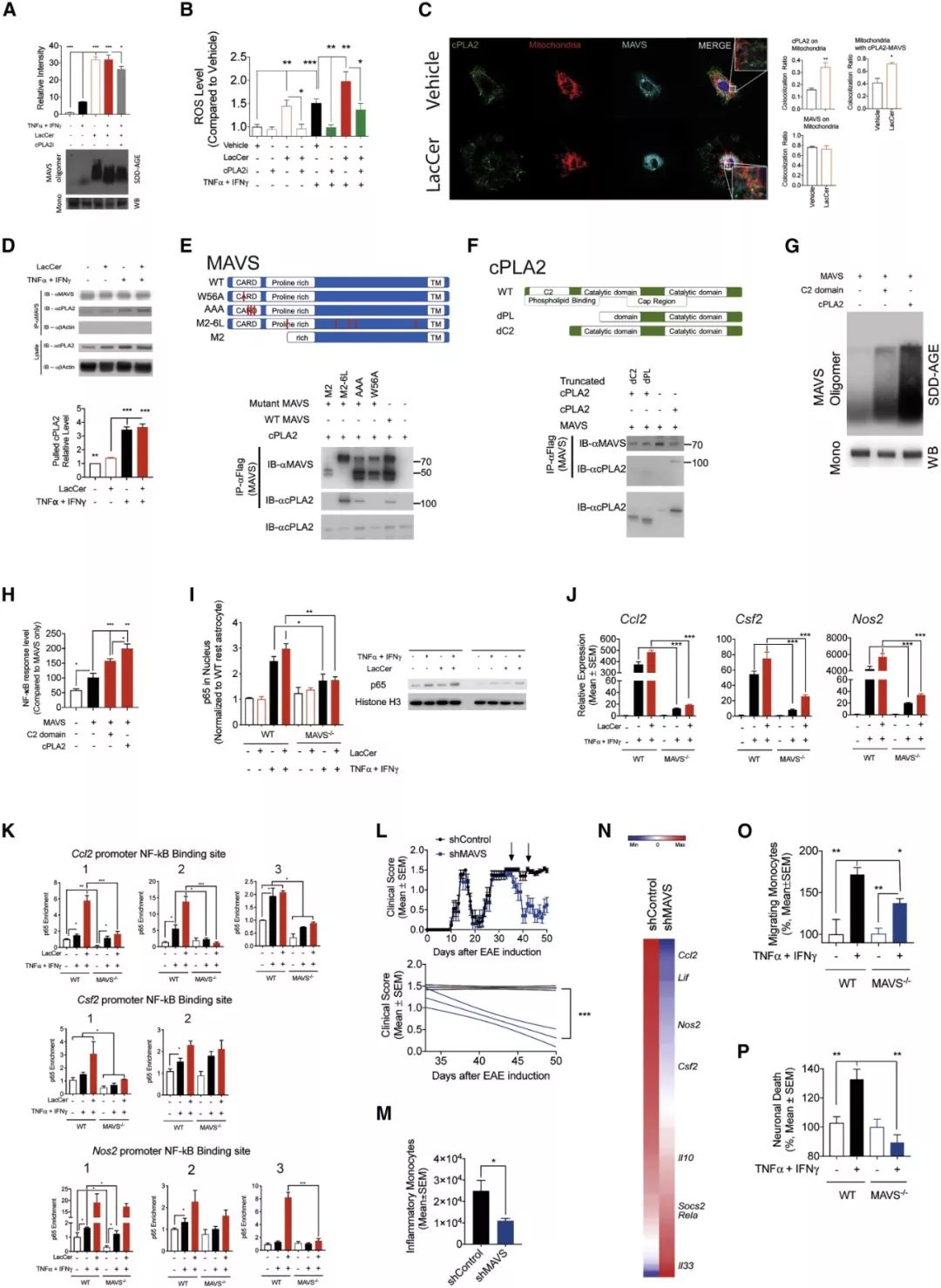
已知 LacCer 与 cPLA2 相互作用,通过小鼠和星形胶质细胞敲除 PLA2G4A (编码 cPLA2 的基因) 实验,发现了 LacCer 通过激活 cPLA2 上调星形胶质细胞中 NF-κB 依赖性促炎症转录程序。
通过相关基因的突变与过表达,CoIP 与 Western blot 等方法检测发现,LacCer 诱导 cPLA2 进入线粒体并与 MAVS 共定位, cPLA2 的 C2 结构域和 MAVS 的 CARD 结构域介导 cPLA2-MAVS 相互作用,激活 MAVS。已知 MAVS 信号可以促进 NF-κB 的激活, 星形胶质细胞 MAVS 的缺失抑制了 LacCer 诱导的 NF-κB 核易位及其靶基因的招募,以及 Nos2, Ccl2 和 Csf2 的表达。敲除 Mavs 抑制了 NOD EAE 进展并减少 CNS 中促炎单核细胞的积累,以及星形细胞的致病活动相关 NF-κB 驱动的促炎症基因的表达。健康对照和 MS 脑样本免疫荧光数据分析进一步证明,鞘磷脂代谢通过 cPLA2-MAVS 信号轴激活 NF-κB,促进星形胶质细胞在 EAE 和 MS 中的致病活动。cPLA2-MAVS 信号调控星形胶质细胞新陈代谢
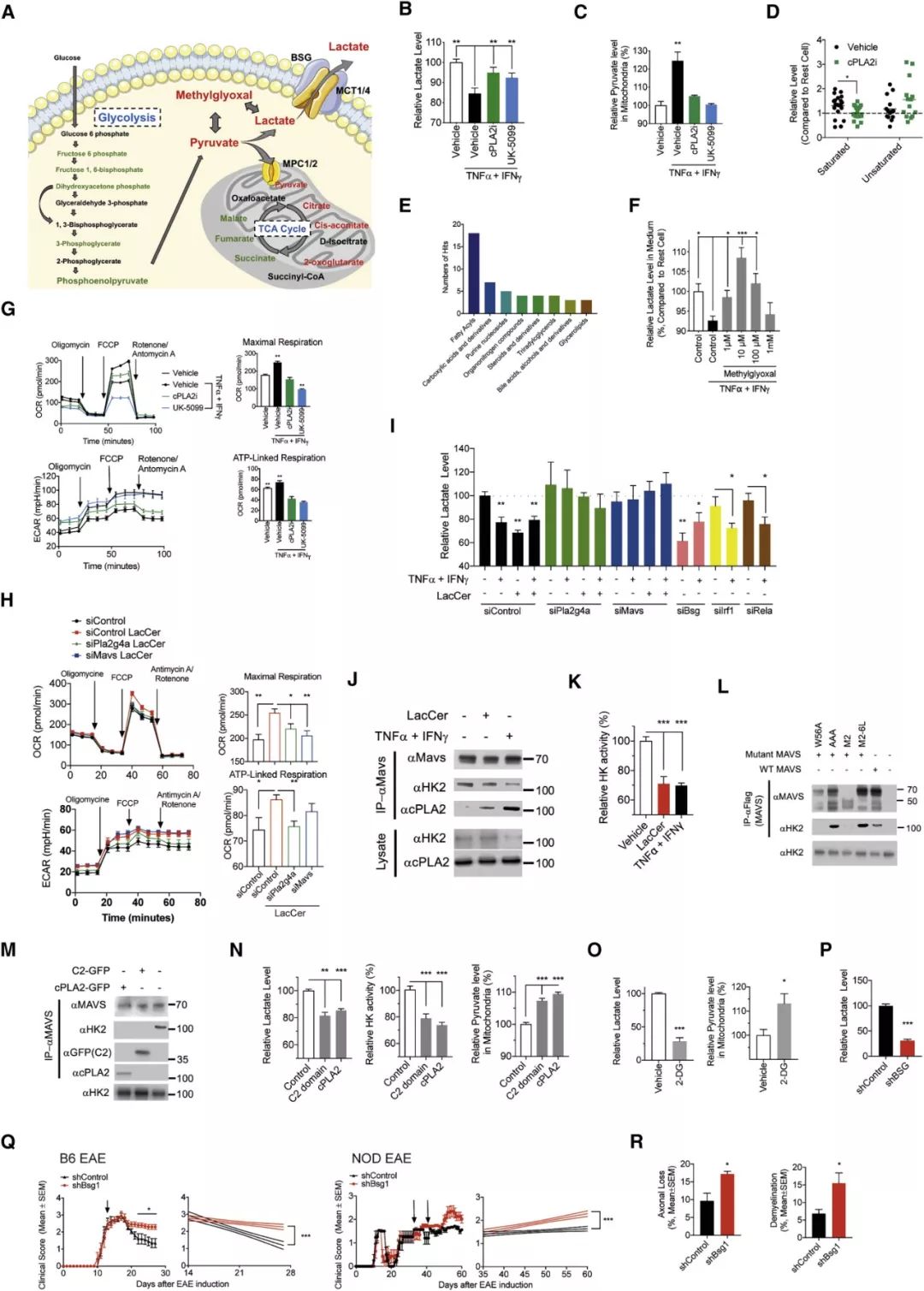
研究人员分析了 LacCer-cPLA2 信号对星形细胞代谢的影响及 MAVS 在其中的作用发现,促炎刺激通过 cPLA2-MAVS 诱导 LacCer 驱动的星状细胞代谢变化,增加了丙酮酸的线粒体氧化,从而降低乳酸的产生和释放。对炎症驱动的 cPLA2-MAVS 信号对 MAVS 与 HK2 相互作用的影响研究发现,cPLA2 C2 结构域可能取代 HK2 与 MAVS CARD 结构域相互作用,cPLA2 的过表达破坏了 HK2-MAVS 相互作用,导致 HK 活性降低,乳酸分泌减少,同时线粒体丙酮酸水平升高。通过乳酸运输胞外相关转运蛋白基因的敲除,揭示了星形胶质细胞中 cPLA2-MAVS 引起的乳酸释放减少可能与中枢神经系统病理有关。综上所述,在中枢神经系统炎症过程中,LacCer 驱动的cPLA2-MAVS 信号调控星形细胞的代谢及其支持神经元的能力。图 3. cPLA2-MAVS 信号调节星形胶质细胞代谢
Miglustat 缓解慢性发展的 EAE
用 Miglustat (Miglustat hydrochloride 购于 MedChemExpress) 处理 NOD EAE 小鼠 ,出现在 CNS 积累,抑制了 NOD EAE 发展,表现为临床评分降低、轴突丢失、脱髓鞘和促炎单核细胞的募集到 CNS,而 Mavs 敲除小鼠情况没有得到改善,说明 Miglustat 的治疗效果与 cPLA2-MAVS 信号相关。Miglustat 抑制了小鼠和人类星形胶质细胞中 Pla2g4 和促炎基因的表达,降低星形胶质细胞的神经毒性,以及它们在趋化实验中招募单核细胞和激活小胶质细胞的能力。
原文链接: Chao CC, et al. Metabolic Control of Astrocyte Pathogenic Activity via cPLA2-MAVS.Cell. 2019 Dec 12;179(7):1483-1498.e22.
相关产品: Miglustat hydrochloride 是一种葡萄糖神经酰胺合成酶抑制剂,可作用于 I 型 Gaucher 病。