质粒构建、转化、提取、鉴定、转染、测定实验操作详解
2024-06-27 来源:MedChemExpress 点击次数:2627
基因研究中常需要通过上调靶基因的表达来观察表型变化。过表达 (Over-Expression,OE) 是上调基因表达最常用的方法,其基本原理是将目的基因构建到质粒或病毒载体中,导入细胞内使基因的表达量增加。
使用质粒法过表达外源基因具有简便、成本低和实验体系成熟等优点,因此大多数实验室会偏向于使用质粒法。
今天我们就来聊聊质粒提取那些事儿~
质粒:一个小型环状双链 DNA 分子,存在于细菌染色体外,能独立复制并稳定遗传。质粒分子小 (0.2-10 KD),因此便于分离和提取,可以携带目的基因进入细菌、动物细胞或植物体内进行扩增与表达。
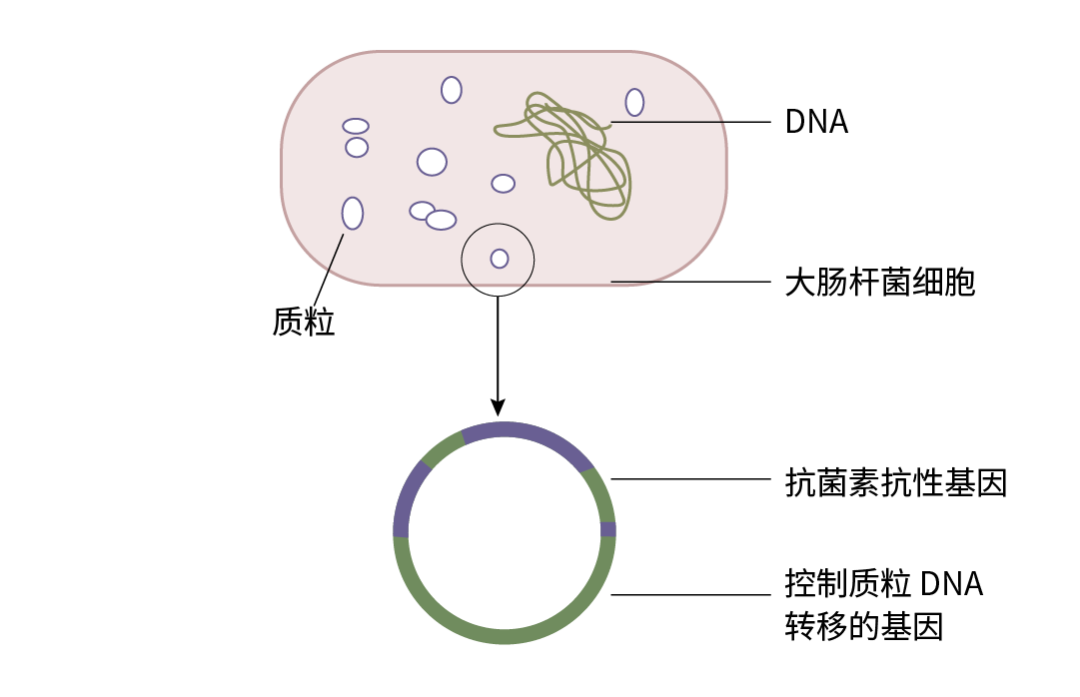
图 1. 大肠杆菌质粒分子结构示意图。

接下来,我们以“Parkin 基因过表达质粒和细胞模型的构建”为例详细展开[1]!
知识链接:
Parkin 是帕金森病的遗传易感基因之一,其突变和蛋白功能缺陷可导致 PD。早期的研究发现,Parkin 蛋白在中脑的黑质和蓝斑处的神经元表达丰富,而帕金森病人黑质的 Parkin 含量明显降低。
So,上调一哈,上调一哈……
1
构建
▐ 带有 GFP 标记的 Parkin 过表达质粒
质粒的构建可经公司购买得到,一般同时提供阴性对照菌液及质粒。
利用限制性内切酶消化获得线性化载体,PCR 扩增制备 Parkin 基因片段,所用扩增引物需在其 5' 端添加同源重组序列,使用该引物扩增基因片段,扩增产物 5' 和 3' 最末端的序列分别与线性化载体两末端序列完全一致。以线性化载体和基因扩增产物配制反应体系,进行重组反应,实现体外环化。


GV146:载 体 编 号 ;CMV-MCS-IRES-EGFP-SV40-Neomycin:元件顺序;EGFP:荧光标记;Kanr:青霉素抗性;MCS:多克隆位点 (Parkin)。
2
转化扩增
(1)配置 LB 肉汤培养基及含 AGAR 的培养液 (含琼脂,用于配制LB固体培养基),倒平板,接种阴性对照菌液和 Parkin 过表达菌液于固体培养皿中,并倒置于 37 ℃ 培养箱中孵育 16 h 左右;
(2)然后各挑取一个独立的、圆形且大小适中的菌落,接种于 5 mL 含抗生素的LB 培养液中,37 ℃,250 rpm,摇菌 10 h;
(3)从两种 5 mL 的菌液中各取 1 mL 分别加入至 LB 培养液中,37 ℃,250 rpm,摇菌 14 h。
3
抽提和鉴定
扩增结束后可按照质粒抽提试剂盒对质粒进行提取。提取的 Parkin 过表达质粒和阴性对照质粒,进行测序 (一般可交由公司完成测序)。将测序结果与目的基因序列进行比对分析,后续进行质粒转染。
质粒抽提怎么选?
质粒提取的目的是去除 RNA,将质粒与细菌基因组 DNA 分开,随后去除蛋白质及其它杂质,以得到相对纯净的质粒。按得到质粒 DNA 的量可将质粒抽提方法和试剂盒分为小提,中提,大提。
表 1. 不同质粒抽提的比较。

质粒提取最常使用的是碱裂解法。即在强碱性条件下,使质粒 DNA 和基因组 DNA 同时从细胞中释放出来,并发生变性而便于纯化出来。市售的大多数试剂盒都是基于碱裂解法原理。碱法抽提适用于小量制备 15 kb 以下的质粒 DNA (大于 15 kb 的 DNA 在碱法提取过程中很容易断裂)。


图 3. 质粒提取过程。
利用离子去污剂 (如 SDS) 裂解宿主细胞(细菌);利用蛋白酶和 RNase 等,从细胞中释放 DNA,去除蛋白等杂质;从层析液中吸收、释放 DNA。如,利用乙醇或者异丙醇沉淀 DNA 去除盐离子。
碱裂解法制备质粒的关键是把握好 SDS-NaOH 处理菌体的时间。如果质粒长时间处于碱性环境,就有可能出现不可逆的变性反应,使质粒变性,无法进行正常的酶切反应等实验,降低终产物品质和可用性。小 M 为大家整理了抽提的主要试剂及注意事项,可自行点赞收藏喔~
表 2. 提取主要试剂、原理与注意事项。


1
细胞培养
小M已做过细胞培养相关推文 (详见往期推文:实验操作 | 小白第一课!基础细胞培养方法及步骤)大家可作为参考,并根据自己的细胞常用培养方法开展实验。
此处以人神经母细胞瘤细胞 SH-SY5Y 细胞株为例[1]:
(1) 用 25 cm2 细胞透气培养瓶,含有 10% 胎牛血清和 1% 青链霉素的 DMEM 完全培养基培养 SH-SY5Y 细胞 (培养条件为:37 ℃、5% CO2)。
(2) 每 1~2 天进行换液,细胞长至 80 %~90 % 时传代:
① 用吸管吸出旧的培养基,PBS 清洗 2 次,每次 5 mL,每瓶加入 0.5 mL 胰酶,消化 30~60s。显微镜下观察大部分细胞收缩、变圆,有少许细胞开始掉落时,立即用吸管吸出胰酶,加入 5 mL 培养基吹打终止消化,使细胞从瓶壁上全部脱落,悬浮在培养基中。
② 将细胞悬液转移至 15 mL 离心管中,4 ℃,1000 rpm,离心 5 min。
③ 弃上清,新鲜培养液重悬细胞并轻轻混匀,根据细胞生长密度选择传代瓶数。一周传代 2~3 次。
(3) 细胞冻存时,冻存液成分:70% 培养基,20% 胎牛血清,10% DMSO;冻存密度为 1~2×106 个 /管,液氮保存。

图 4. 传代流程图。
2
分组
(1) 正常对照组 (C):正常培养 SH-SY5Y 细胞。
(2) 阴性对照组 (NC):SH-SY5Y 细胞转染阴性对照质粒。
(3) 过表达组 (PC):SH-SY5Y 细胞转染过表达质粒。
3
转染
细胞铺板 24 h 后,按照 Lipofectamine 说明书用其进行转染。转染 48 h 后,荧光显微镜下观察其 GFP 的表达情况及统计其转染效率 (对明场及暗场荧光细胞计数,得:转染效率 = 暗场荧光细胞个数 / 明场细胞个数;也可通过流式等观察统计其转染情况)。
结果显示,阴性对照组和 Parkin 过表达组细胞内可观察到较多的绿色荧光蛋白表达,而正常组细胞没有观察到,则质粒成功转染至细胞内。


图 5. 转染后荧光显微镜下观察绿色荧光蛋白的表达[1]。
A. 正常对照组 (明场);B. 正常对照组 (暗场);C. 阴性对照组 (明场);D. 阴性对照 (暗场);E. 过表达组 (明场);F. 过表达组 (暗场)。MCE 转染试剂推荐:







1
RT-PCR
▐ 实时荧光定量 PCR(RT-PCR)检测 EGFP-Parkin mRNA 的表达水平
大家可根据购买的试剂盒进行操作,小 M 在下方为大家整理了文献中的操作步骤,供大家参考[1]。
(1) 提取 RNA 及将 RNA 逆转录为 cDNA:
-
实验分组及处理同上,TRIzol 提取细胞后每管加入 200 µL 氯仿,离心 15 min 后吸取 400 µL 上层水相至新的管中;每管加入 400 µL 异 丙醇,离心 10 min,弃上清;加入 l mL 75 % 的乙醇悬浮沉淀后 离心 5 min,弃上清后晾置并加入 50 µL DEPC 水,吹打混匀, 稀释后用紫外分光光度计测定 RNA 的浓度。
- 各组取 2 µg RNA 与 1 µL 的 Oligo (dT) 及 DEPC 水混合均匀,放置于逆转录仪中 变性,65 ℃,5 min;配制反应混合物 (每管:5× Reaction Buffer: 4 µL, RiboLock RNase Inhibitor: 1 µL, 10 nM dNTP Mix: 2 µL, RevetAid M-Mulv RT: 1 µL) 每管加入 8 µL 混合物;置于逆转录仪中反应,反应条件为 42 ℃,60 min → 70 ℃,5 min → 4 ℃, -20 ℃ 保存备用。
- 用 DEPC 水将 cDNA 稀释 10 倍;分别配制 Parkin 和 β-actin 引物的反应体系 (见下表 3),先加入引物反应混合液 (引物可自行设计或公司购买),每孔 18 µL, 再加入稀释的 cDNA,每孔 2 µL,置于实时荧光定量 PCR 仪内进行检测。
- 采用 Livak (2-△△CT) 法分析 Parkin 的相对表达量:△CT = CTParkin-CTβ-actin,△△CT = △CT 实验组 -△CT 对照组,相对表达量 = 2-△△CT。
表 3. Parkin 和 β-actin 引物的每孔反应体系[1]。

转染后 SH-SY5Y 细胞内 Parkin mRNA 表达情况:
RT-PCR 结果显示,Parkin 过表达质粒转染后,正常对照组与阴性对照组的 Parkin-mRNA 水平没有明显差异 (P>0.05);而与正常对照组和阴性对照组相比,Parkin 对照组的 mRNA 表达量有明显提高 (P<0.01)。
另外,RT-PCR 的溶解曲线 (Melt Curve) 分析结果显示,扩增产物的特异性良好,40 个扩增循环中没有引物二聚体的产生,溶解峰为 79.16 ℃ (图 6)。


图 6. 过表达质粒转染后 SH-SY5Y 细胞 Parkin-mRNA 的相对表达情况[1]。
A.RT-PCR 的扩增曲线 B. 溶解曲线 C. 采用 2 -Δ ΔCT 法分析各组 mRNA 的相对表达量,与正常对照组比较,*P<0.05;与阴性对照组比较,#P<0.05MCE 转染试剂推荐:













2
Western Blot
▐ Western Blot 检测 Parkin 蛋白的表达水平
有关 Western Blot 的实验操作,往期小 M 已为大家做过解读 (详见往期推文:Western Blot 实验步骤 + 不可忽视的小细节),大家可根据自己的目的蛋白进行实验参数的调整。
文献参考步骤[1]:(1) 蛋白提取、定量及变性:
BCA 蛋白定量试剂盒提取蛋白并检测蛋白浓度。提取的蛋白样品加入 5× loading buffer 和 RIPA 蛋白裂解液进行定量配平,并将配平的蛋白样品置于 100 ℃ 沸水浴中煮 5 min。(2)免疫印迹:
① 配胶、灌胶:配制 10 mL 10 % 的分离胶和 5 mL 5 % 的浓缩胶,先后灌入,先配分离胶,再配制浓缩胶,然后 插入 10 孔梳子,待浓缩胶凝固后,将梳子拔出,置于电泳槽中。(或自行购买预制胶板,进行后续操作)
② 上样:每孔 30 µg,20 µL,上样后 100 V 电压,电泳约 120 min。
③ 转膜:制作 " 三明治 " 夹板并将其放入电转 槽中并加满电转液;电转槽置于冰上开始电转,100 V 电压,电转 80 min。
④ 封闭:电转后将膜取出,室温下置于摇床上封闭 1 h。
⑤ 一抗孵育:用一抗稀释液将一抗稀释至适当浓度 (1:1000);室温下, 摇床上孵育 1 h 后,置于 4 ℃ 冰箱里孵育过夜。
⑥ 二抗孵育:摇床上用 TBST 将膜漂洗 15 min× 3 次。用 0.5 % 脱脂牛奶 -TBST 溶液稀释二抗至适当的浓度 (1:1000) 置于摇床上慢速摇动孵育 1 h。
⑦ 显影:将膜取出,置于摇床上用 TBST 漂洗 15 min × 3 次。显影,采用软件进行分析。
Western Blot 结果显示,正常对照组与阴性对照组的蛋白表达水平没有明显差异 (P>0.05);过表达组的 Parkin 蛋白水平较正常对照组和阴性对照组有显著提高 (P<0.01),提高了约 60 % (图 7)。



1
如何做好细菌培养?
-
建议统一使用 LB 培养基来培养细菌。开始细菌培养前,最好涂板挑菌培养,并稀释后做二次培养 (培养条件:37℃,300 rpm,培养 12-16 h)。甘油保存的菌可能会产量低或者质粒丢失。
- 注意不要做高密度培养,否则会超过纯化体系可以承受的范围,降低质粒产率。起始培养体积应基于培养细菌密度,用来提取质粒的细菌的 OD600 建议为 2-3。
2
低拷贝质粒如何增加产率?
-
在一个细菌细胞中只有 5 个以下的相同质粒时,该质粒是低拷贝质粒;当在一个细菌细胞中可以有几百个相同质粒时则该质粒是高拷贝质粒。若大提质粒或者小提质粒的实验效果不好时,则需要加大提取的菌体量,可进行质粒中提或者大提。另外,使用去内毒素的试剂盒抽提质粒时,也会降低最终得到质粒的浓度。
-
氯霉素能够抑制染色体的复制,而不抑制质粒复制。可以在低拷贝质粒 (如 pUC19) 的培养过程中添加氯霉素。
3
如何提高杂质去除率?
-
RNA:可以使用 RNase (100 μg/mL) 消化或者用含 25 μg RNase A/mL TE 溶解抽提好的质粒。但这些方法也不能彻底去除 RNA。
-
蛋白质:主要靠形成不溶的 K-SDS-蛋白质复合物、使蛋白质共沉淀。大量抽提时,可以将中和后的体系置于 4 ℃ 一段时间,以形成更多的该不溶复合物,从而使蛋白质残留更少。
4
如何提高获得的 DNA 浓度?
- 最后加入预热的洗脱液或 ddH2O 时,可先加 30 μL 溶解。离心 后不着急扔掉离心柱,可将离心下的质粒再返加入洗脱管洗脱。
5
琼脂糖电泳鉴定结果说明
-
多数情况下会出现 3 条带。这三条带以电泳速度的快慢而排序,分别是超螺旋、开环和复制中间体 (没有复制完全而连在一起的质粒)。
注:碱法抽提得到质粒样品中不含线性 DNA。
-
有的结果中会有第 4 条带。这条带泳动得较慢,远离这三条带,是 20-100 kb 的大肠杆菌基因组 DNA 的片断。这是因为在抽提环节中,加入溶液 II 后过度振荡所致。
-
少数情况下会出现 7-10 条带。可能因为一些 DNA 序列特殊,而出现不同程度超螺旋 (超螺旋的圈数不同,而泳动速度不同) 所致。

[1] Ma Hao jie, et al. Construction of Overexpression Plasmid and the Cell Model. Progress in Modern Biomedicine Vol.18 NO.3 FEB.2018.

