Celigo技术在基因治疗和病毒研究中的应用
2020-09-25 来源:Nexcelom 点击次数:4073虽然在这次COVID-19疫情期间Biogen公司以另一种方式被人们熟知,但依然不影响其作为神经科学的先驱者在基因治疗领域的重要地位。
本文重点介绍并全文翻译了Biogen公司的生物检测和基因治疗团队于2019年发表于Molecular Therapy: Methods & Clinical Development的研究论文。研究者们为了提高日常病毒滴度检测中蚀斑实验的速度、通量、灵敏度以及稳定性,将荧光检测方法与自动图像计数相结合,并予以优化。文章以通俗清晰的笔触描述了研究团队开发和评估这一革新方法的全过程,并借此向广大病毒学、基因治疗和疫苗开发领域的相关工作者推荐。
综合荧光检测和基于图像的自动计数方法提高蚀斑实验的速度,灵敏度和可靠性

Abstract
蚀斑实验(plaque assays)用于测定病毒样品的感染滴度。这些实验通常需要很多天来完成且通量较低。同时,肉眼识别和手工计数蚀斑非常耗时和费力,并且结果很可能还会受人为偏见和主观判断的影响导致分析人员之间的差异。同时,该实验必须为期数天,使蚀斑增长到足够大的尺寸以便适合于人工鉴定。这里,为了提高蚀斑实验的灵敏度和速度,我们整合了荧光检测和自动蚀斑计数的方法。首先,我们用荧光标记的抗体对蚀斑进行染色;其次,我们采用了一种基于多孔板的细胞图像分析仪,从而实现了无偏见、非主观的自动蚀斑计数。这两种技术的整合使得实验时长缩短了40% (从原来的5天减少到了3天),这是因为蚀斑的大小、信噪比和肉眼可见度已不再是制约因素。这种优化了的蚀斑测定方法更加灵敏,快速、稳定,同时也更加拓展了测定蚀斑形成的应用和通量。
关键词:蚀斑实验,自动计数,荧光检测,测定可靠性,基于图像的计数,基因治疗
Introduction
基因治疗是一个在研究和临床试验中提供治疗性基因的良好平台。腺相关病毒(AAV)基于其有效性和良好的安全性,是将这些治疗性基因导入至靶细胞的一种极有力的载体。AAV是一种非囊膜病毒,包括一条被蛋白质外壳包裹的基因组单链DNA(ssDNA)。AAV可以通过多种方法生产,包括瞬时转染人胚肾(HEK)细胞,使用哺乳动物工程细胞株、杆状病毒感染的昆虫SF9细胞,或诸如单纯疱疹病毒(HSV)等辅助病毒转染的稳定细胞株。因为重组AAV(rAAV)载体是有复制缺陷的,所以它们需要包含辅助功能的质粒或辅助病毒(例如腺病毒或HSV)进行复制。 在感染过程中,当AAV进入细胞核时,ssDNA变成双链(ds)的形式。该dsDNA是基因表达所必需的。如果没有辅助病毒,AAV会以潜伏形式保留在细胞中。但是,当存在辅助病毒时,带有目的基因的AAV就可被活化生产。由于最理想的rAAV的生产可以依赖于所用辅助病毒的浓度,因此辅助病毒的感染滴度是建立高效高产rAAV生产过程的关键因素之一。
腺病毒载体(adenovirus)不但是基因治疗有力的工具,更是抗病毒疫苗开发的重要手段之一。腺病毒是一个正20面体形状的病毒,将一段新冠病毒基因,如S抗原,传递进入该病毒后,20面体上会出现类似新冠病毒的刺突。腺病毒本身毒力很弱,因此可以利用它把新冠病毒的刺突抗原带入体内激发免疫应答。近日,军事医学研究院生物工程研究所与天津康希诺生物股份公司联合团队合作的重组新冠疫苗就是利用这一原理开发的,并于上周率先获批临床,在武汉市开展I期试验。合作双方作为Cellometer胞计数仪多年用户,Nexcelom公司深感使命光荣。小编获悉,研究团队已于武汉前方抗疫奋战近两个月,Cellometer胞计数仪也正用于疫苗临床评价中的细胞免疫检测环节。
有许多方法可以测定病毒基因组和感染颗粒的数量。病毒基因组滴度可通过RT-PCR,qPCR和Western blot等技术对DNA或蛋白质进行实验性测定而获得;也可以利用衣壳蛋白滴度ELISA,流式细胞仪或市售病毒计数器对完整的病毒颗粒进行定量。最后,如HSV病毒,可以使用功能实验方法对病毒进行定量,例如常规的蚀斑实验(plaque assay)或细胞病变效应(CPE)实验。尽管蛋白质和颗粒计数器的检测快速且定量,但它们无法提供有关病毒的传染性或功能性的信息。
病毒滴度检测是病毒学研究中最重要的步骤之一。病毒的滴度用来表示样本中病毒的含量。病毒滴度的高低与活跃病毒的感染力(infectivity)强弱相关,因此也被用作临床病毒感染中的治疗监测。实验中的病毒滴度通常测定病毒颗粒在特定细胞类型或动物中复制的能力。常用的检测方式有蚀斑实验(plaque assay)、灶斑形成实验(focus formation assay)和终点稀释实验(endpoint dilution assay)等。
细胞病变效应(cytopathic effect, CPE)常被应用于镜下可观察到的病毒介导的(单层)细胞恶性变化。这些细胞形态改变包括细胞膨胀或收缩,细胞变圆、分散、聚团、裂解等,以及合胞体(syncytia)或胞内内涵物(inclusions)的形成。病毒感染导致的单层贴壁细胞裂解消失是最常见的CPE类型。若局部细胞可裂解形成肉眼可见的不连续的“空洞”,即为蚀斑。根据病毒类型的不同形成人眼可见的蚀斑通常需要3-14天。同时,宿主细胞、培养基的类型和pH都会影响形成蚀斑的大小和数量。
蚀斑实验流程示例见下图:
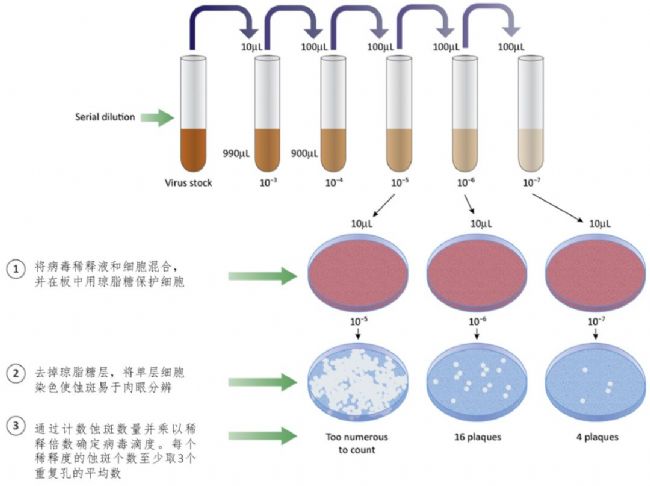
经典的病毒感染滴度就是通过蚀斑实验来测定的。通常,将细胞接种在多孔培养板中形成汇合的单细胞层。在第二天,将细胞用稀释的病毒样品接种一段特定的时间(时间取决于滴定的辅助病毒)。除去接种物并用新鲜培养基换液,再将细胞孵育若干天,直到形成大到足以通过肉眼观察和计数的蚀斑。传统的蚀斑测定需要花费数天的时间,劳动强度大,并且由于不同分析人员对蚀斑进行手工计数,因此结果会比较主观。
在这里,我们将Nexcelom公司的Celigo成像分析系统应用到传统蚀斑实验的工作流程中,从而自动成像、识别并计数蚀斑个数。自动化蚀斑计数不仅与手动蚀斑计数结果相一致,而且还通过消除人为偏见提高了测定的可靠性。同时,我们还整合了斑块的荧光检测,由于荧光可以更早地检测出通常肉眼看不到的微小斑块,因此不但提高了检测灵敏度还缩短了检测时长。应用该方法可以明显地增加实验和分析的通量,以加速关键的工艺开发流程。
Results-手动计数对比自动计数
蚀斑实验开发于上个世纪50年代,一直被认为是定量测定病毒滴度的金标准。可令人惊讶的是,通过分析人员可视化识别和手工计数蚀斑的方法至今仍然被广泛使用。 这种计数方法显然会受制于分析员之间的差异。
我们对Nexcelom的Celigo成像分析系统能否成像并准确地计数辅助病毒蚀斑的能力进行了评估,将传统的肉眼计数法与自动成像计数法进行了比较,总结如图1。Celigo通过已建好的参数设置自动检测并计数每个孔中的蚀斑,并高亮显示每一个斑块,以及每孔的总斑块数。 图2A展示了在Celigo上成像的24孔板,每个孔的蚀斑总数显示在每孔的底部。 此外,还能显示每个单孔的图像,蚀斑的位置被软件填充为绿色,以便于观察。
图2B中的结果表明,Celigo成像分析系统的计数结果与多个分析人员的传统计数结果相似。手动计数和自动计数之间的平均标准差(SD)为3,平均相对标准差(RSD)为4%。 两种蚀斑计数方法之间也存在很强的线性相关性,R2 = 0.9791。 不同日期测定的对照样品的数据平均差异为5.3%,表明了相同样品在不同实验日期和不同检测批次间的结果相一致。 这些结果表明,由Celigo成像分析系统进行的自动蚀斑计数与传统的计数方法具备可比性,同时也突显出消除分析员之间的偏见和主观性判断等弊端的潜力。通过对传统蚀斑实验的简化处理,大大地提高了实验的通量和可靠性。
Results-利用荧光检测的自动蚀斑计数
HSV病毒蚀斑实验一般需要耗时5天来测定。该实验的工作流程如图1所示。该实验的瓶颈就是蚀斑的手工计数步骤。这种计数方法要求蚀斑要形成足够大,以致到肉眼可见的程度。在该方法中,通过偶联辣根过氧化物酶(HRP)的病毒抗体,以及四氯化二氨基联苯胺(DAB)底物显色,使得蚀斑可视化,(以此作为参照)我们测试了使用荧光标记抗体的荧光成像是否可以作为该实验的另一种改进方法。如图3A所示,用荧光标记的抗体染色同样可以在感染3天后看到(与基于HRP抗体染色的方法)相似的蚀斑,并且同样可以通过Celigo分析仪成像并自动计数蚀斑。更重要的是,两种方法在感染后第3天都检测到相似的蚀斑数量(如图3B)。
使用荧光检测的益处是它能够消除蚀斑必须生长足够大到能用肉眼看清这一瓶颈。用传统的HRP标记方法染色的蚀斑也只能在感染后3天才能被肉眼识别。由于Celigo成像分析仪可以识别并计数难以用肉眼看到的蚀斑,因而可以将传统实验缩短到感染后2天就可以读数。尽管蚀斑的大小和形态在不同的天数时有所不同,但所有样本在感染后的不同时期内的蚀斑数量非常一致,如图3B所示。这些结果证明,荧光检测会形成与传统方法数量相近的蚀斑,且保持一致的准确度。将蚀斑的荧光检测与自动计数相结合,可以显著提高蚀斑实验的速度,时间上从5天缩短到3天完成,如图1所示。
Disucssion
这里所介绍的使用荧光检测的自动蚀斑计数方法有助于加快蚀斑检测的速度。但是,有几种类型的感染性病毒滴度实验不会形成蚀斑。半数组织培养感染剂量(TCID50)就是另一种常用的病毒滴定方法。TCID50是终点稀释测定法,用于确定感染50%接种细胞所需的病毒样品稀释度。由于蚀斑和TCID50分析都是要历时多天且通量较低,因此急需其他更快的方法。带有GFP标签的腺病毒载体,可以通过流式细胞术检测被感染的细胞,该方法通常需要大约一天的时间,样品用流式方法和蚀斑实验检测具有相近的病毒滴度结果,这也使其成为蚀斑实验颇具吸引力的替代方法。
已有报道称使用阴离子交换柱的高效液相色谱(HPLC)方法可以定量杆状病毒中的病毒颗粒。用SYBR绿色荧光染料标记病毒的DNA后,可在25分钟内从阴离子交换柱上洗脱到病毒粒子。尽管该方法可以定量一个样品中存在的病毒颗粒数量,但不一定检测的是感染性病毒的数量。 此外,微滴式数字PCR(ddPCR)技术还可以量化反应中目标DNA的绝对数量。
此处描述的自动蚀斑计数方法是传统蚀斑实验的一大进步,对于不形成蚀斑感染的类“蚀斑”形成实验也有所帮助。
例如,有种方法是用来确定腺病毒5(Ad5,一种辅助病毒)的感染性的,叫做灶斑形成实验(focus formation assay)。 与蚀斑测定相似,用连续稀释后的病毒样品感染细胞,然后将细胞固定,与抗病毒的HRP偶联抗体一起孵育,并用DAB底物显色。用Ad5感染的细胞形成可计数的灶斑(Foci),结果以每毫升感染单元(ifu/mL)的形式表示。通过参数优化,Celigo可用于识别和计数单个灶斑,从而有助于提高灶斑的读检速度。
已有研究报道,一个类似的的荧光灶形成实验(fluorescent focus formation assay)可取代鼠诺如病毒(MNV)的蚀斑实验。在该实验中,MNV抗原带有荧光标签,由于病毒抗原的表达早于蚀斑的形成,因此该方法可以比蚀斑实验更快速地定量感染滴度。Celigo在该实验中可用于自动计数灶斑形成单元(focus-forming units,FFU)。
最近也有不少研究,将将近红外荧光与LI-COR Biosciences的胞内Western blot系统相结合,也证明了相对于传统蚀斑实验,在检测灵敏度和速度方面也有一定程度的提高。不过,与LI-COR系统不同的是,我们采用的Celigo成像分析仪除了荧光检测外,还可以用于非荧光斑块的成像识别。
电阻抗技术也曾被用来评估细胞的病毒感染。研究表明,阻抗技术可用于实时监测病毒与细胞间的相互作用,并检测某些抗病毒药物的瞬时效用。但是,此技术的工作流程无法计算传统蚀斑实验中蚀斑形成单位(plaque-forming unit,PFU)的数值。
尽管有很多新方法用于感染性病毒滴度的定量测定,但蚀斑实验和TCID50检测仍是病毒滴定的金标准。这里描述的自动蚀斑计数方法是对传统方法的完善和改进。通过利用自动计数和计算机算法来计数蚀斑,消除了分析者的主观因素。使用Celigo成像分析仪还可以大大减少蚀斑计数的时间并提高数据一致性。当该技术应用于48孔或96孔板时,还可以显著地提高样品通量,从而助益于工艺优化环节中的大量样品的分析。此外,通过整合蚀斑的荧光检测,检测时长可以减少40%,同时保持与传统蚀斑实验相同的计数性能。
使用基于计算机的成像系统的另一个优点是提高了数据的获取、结果记录以及可追溯性。同时,存储和回顾图像的功能使得设置实验验收标准更加清晰,并在培训新的分析人员时提供指导和示范。在质量控制或良好生产规范(GMP)环境中,每项实验运行的过程都同时需要分析和审核人员。通过应用具有自动蚀斑计数的板式成像分析仪,每一次分析结果和数据回顾的过程都能够被完整地记录,并且保存的原始细胞图像以供监管机构进行备案或审计。
我们的目的是评估可以轻松应用到当前蚀斑实验工作流程中的新技术,自动生成PFU值,并提高实验的可靠性,灵敏度和速度。这项研究强调了通过自动成像技术等简单的解决方案对经典检测方法的改进。
Nexcelom Bioscience时刻为广大新冠病毒的研究和疫苗开发提供无偿服务与帮助,共同面对全球疫情的挑战。欢迎致电021-5886 0038。
祝新冠肺炎患者早日康复,愿全世界疫情快点结束!Better tool for better biology for better life!

