高通量蛋白质组学通过大规模样本集推进临床研究
2022-10-31 来源:本站 点击次数:1780随着蛋白质组学技术应用的快速发展,离子淌度这一概念的引入,蛋白质组学已步入4D新时代,引领临床蛋白质组学在鉴定准度、鉴定深度、定量准确性、检测周期等性能上全面提升,并在基础研究、转化医学、临床蛋白质组学等各个方面展现出了广阔的发展前景和强大的生命力。值得一提的是,在新冠病毒疫情全球大流行之际,4D蛋白质组学下的大队列新冠患者样本临床蛋白质组学研究也为抗击病毒做出了贡献。
4D蛋白质组学究竟是如何轻松解决大队列、复杂体系以及微量样本检测的?而高通量蛋白质组学又是如何通过大规模样本集推进临床研究的?带着这些疑问,一起来看看临床蛋白质组学专家是如何利用4D蛋白质组学推进临床研究的。
“我们的研究所与医院紧密相连,有许多合作,其中蛋白质组学已成为主要研究战略的一部分。这意味着临床研究人员对其样本进行蛋白质组学分析的需求越来越大。与此同时,每次临床研究的平均样本数也大幅上升。而这正是高通量蛋白质组学大显身手的地方。”
--牛津大学标靶研究所临床蛋白质组学Roman Fischer教授
1
临床蛋白质组学面临的挑战
过去,蛋白质组学并不是临床研究的驱动力,因为样本集通常非常小。此外,由于当时质谱仪的速度、灵敏度和分辨率有限,很难实现完整蛋白质组的覆盖。临床样本通常具有挑战性,蛋白质含量极高,动态范围高[1]。这给质谱分析带来了复杂性,因为质谱仪的动态范围通常比临床样本中蛋白质的动态范围小得多[2]。
而基于Bruker timsTOF Pro的4D蛋白质组学的出现,改变了这种情况,提高了分析时间和稳健性,使高通量蛋白质组学成为可能。

基于timsTOF Pro的4D蛋白质组学使研究人员能够重复测量所有检测到的离子的碰撞截面(CCS)值,这些值可用于进一步提高系统的选择性,从而从复杂样本和短梯度分析中获得越来越可靠的相对定量信息[3]。
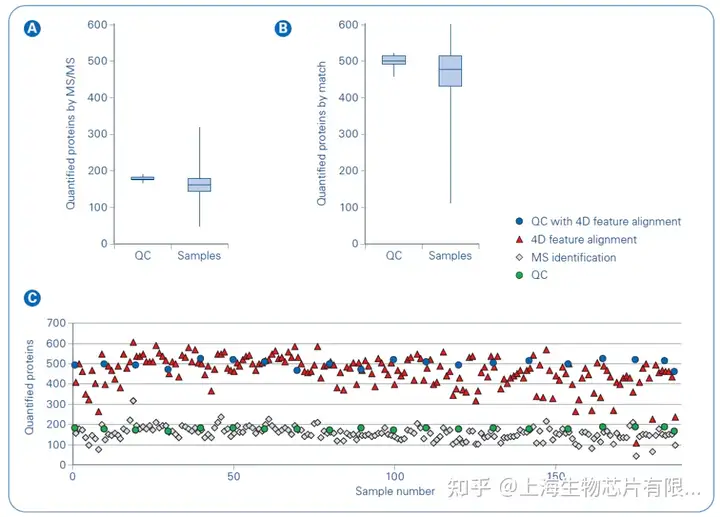
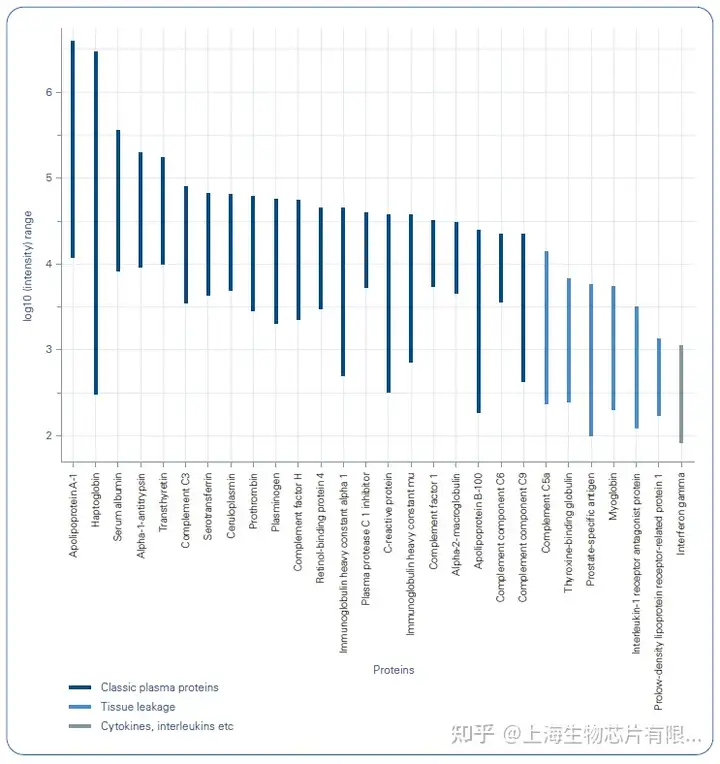
有研究团队发现,基于timsTOF Pro的4D蛋白质组学除了能够进行离子迁移信息的常规测量,还在保留时间、质荷比(m/z)、离子迁移率 (1/K0) 和MS1强度方面实现高质量的4D特征校准(图1)。校准提高了定量血浆蛋白的数量,在一次11.5分钟的LC-MS/MS运行中超过500个蛋白质,如果将所有运行结合起来,共定量772个蛋白质(图2)[4]。达到这种深度提供了全新的可能性,分析大样本队列的数百至数千个样本,以发现血浆中的生物标志物。
PASEF技术可以在不损失灵敏度或分辨率的情况下实现>100 Hz的序列速度。这是通过使四极隔离质量窗口与TIMS通道中特定肽包的洗脱时间同步来实现的。通过多次选择,可以提高低丰度肽的MS/MS光谱质量。从少于200 ng的样品负载中可以获得更好的结果,因此减少了样品制备成本和MS维护频率。使用90分钟的梯度长度,可以从典型的人类细胞系裂解液中识别出5400多个蛋白质组。
稳健性是基于timsTOF Pro的4D蛋白质组学研究的另一个主要优势。关于这种能力对蛋白质组学研究的影响,Fischer教授是这样说的:“通常情况下,一个仪器需要在200个血样后进行清洁。在高通量环境下,这意味着高频率的仪器清洁,严重影响研究进度。而我们在timsTOF Pro仪器上运行的最大样本批次是4500次非衰竭血液注射,这是极具挑战性的样本之一。
基于timsTOF Pro的4D蛋白质组学还可以从少量高度复杂的混合物中提供可重复的定量信息。Fischer教授解释道:“达到100+Hz,这意味着它有可能每秒识别100个或更多的肽。与其他仪器相比,我们可以真正缩短梯度时间,即使是对于总细胞裂解物之类的样本,也不会影响我们获得的数据深度。此外,该仪器也非常敏感。可以说,是在不会影响灵敏度的前提下提高了速度和稳健性。”
2
对高通量蛋白质组学的需求不断增长
自从越来越多的人将蛋白质组学应用到课题研究中以来,需求大幅上升,这是对其他组学的补充。
Fischer教授和他的团队使用蛋白质组学来确定肿瘤在空间环境中的功能。他说道:“因为现在我们可以将蛋白质组学与其他技术相结合,如激光捕获显微切割(LMD),这是一种非常有趣的方法,因为它允许我们维持蛋白质组的空间背景。目前,我们仍在努力了解大型结构(如肿瘤或器官)中的空间分辨分子相互作用。我们在肿瘤血管周围看到炎症标记物,但在其他地方看不到,因此我们试图了解这些肿瘤在分子水平上发生了什么。这将影响靶向蛋白质以及如何将药物输送到最有效的位置。通过结合MS和LMD,我们可以重新定义表型。基本上,蛋白质组成为细胞表型的一部分,因为它现在可以通过空间分辨率观察到。我喜欢称之为‘表型蛋白质组’。显然,这种方法也可以以空间对应的方式与基因组或其他组学分析相结合。”
3
新冠肺炎患者的分类
当前,基于timsTOF Pro的4D蛋白质组学最值得一提的应用,就是实现新冠肺炎感染中宿主免疫反应的深层表型[5]。
这项研究涉及200-300名患者,其中一些患者在多个时间点采集样本,并在Bruker-timsTOF Pro上使用高通量蛋白质组学进行分析。该研究采用了一种新的方法,使用这些样本的亚组与其他组学技术进行分析,例如某些血细胞的位点分析。血浆蛋白质组能够将亚表型分型到患者群中,这可以预测严重程度和结果(图3和4)[5]。在对同一组样本进行的这项大型研究中使用的8种组学中,蛋白质组学最适合将新冠肺炎患者分为不同的疾病严重程度组,而其他技术则提供了数据来帮助理解潜在的生物学意义。
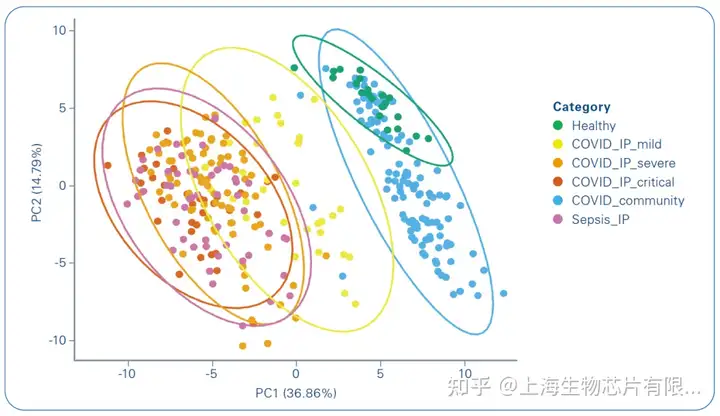

该蛋白质组分析确定了特定的血浆急性期蛋白水平作为严重疾病的指标,并有证据表明急性期炎症、补体激活/攻击、纤维蛋白凝块、蛋白酶、血清淀粉样蛋白、组织坏死、受体介导的内吞作用和胆固醇转运。发现了血浆蛋白特征,可用于将急性住院新冠肺炎病例分层为疾病亚表型,聚类成员可为反应状态提供信息,并与差异28天死亡率相关。
这一多组学血液图谱等研究将为新冠肺炎未来的药物开发、临床试验设计和个性化药物治疗方法提供必要的见解。
参考文献:
[1]Cox J and Mann M (2011), Quantitative, High-Resolution Proteomics for Data-Driven Systems Biology, Annu. Rev. Biochem. 80: 273-299.
[2]Keshishian H, Burgess MW, Specht H, Wallace L, Clauser KR, Gillette MA, & Carr SA. (2017), Quantitative, multiplexed workflow for deep analysis of human blood plasma and biomarker discovery by mass spectrometry. Nature protocols, 12(8), 1683-1701.
[3]Meier F, Brunner AD, Koch S, Koch H, Lubeck M, Krause M, Goedecke N, Decker J, Kosinski T, Park M, Bache N, Hoerning O, Cox J, Räther O, Mann M. (2018), Online parallel accumulation – serial fragmentation (PASEF) with a novel trapped ion mobility mass spectrometer, Mol. Cell. Proteomics, https://doi.org/10.1074/mcp. TIR118.000900.
[4]Kosinski T, Heilig R, Bensaddek D, Bache N, Bjeld Hørning O, Fischer R, Koch H., Plasma proteomics goes high throughput – timsTOF Pro with PASEF and 4D feature alignment to quantify 500 plasma proteins in 11.5 min. Bruker Daltonics 03-2019, LCMS-151, 1867805.
[5]Covid-19 Multi-omics Blood ATlas (COMBAT) Consortium (2022), Cell 185, 916–938, 2022. Published by Elsevier Inc. https://doi.org/10.1016/j.cell.2022.01.012 ll

