FRAP显微镜在化学和材料科学中的应用
2023-05-24 来源:本站 点击次数:2129
南京中医药大学/南京大学
荧光漂白后恢复技术(Fluorescence recovery after photobleaching,简称FRAP),是一种获取微米尺度上分子扩散动力学信息的荧光成像技术。1生物分子功能的实现与其迁移行为密切相关,FRAP技术的出现为研究高度动态的生命体系中分子的扩散、互作等提供了方便。2这一技术是由上个世纪70年代被Axelrod和Peter等人提出,目前已成为定量获取细胞膜或者亚细胞器上的生物分子时空信息的重要工具。
荧光漂白是典型的光化学过程,然而FRAP技术在化学和材料科学领域应用目前相对较少。事实上,荧光漂白,往往被化学工作者视为一种不太好的现象。笔者希望通过一些应用实例展示这一技术在化学和材料科学领域的价值,也让生命科学领域的研究人员一瞥化学FRAP过程的特点。
什么是FRAP?
FRAP的基本原理如图1所示。对于一荧光分子均匀标记的薄膜(图1a,e),某一时刻用一束高功率密度的激光漂白掉某一个微区的荧光分子(t=0, 图1b,f)。由于分子的扩散,微区外未被漂白的荧光分子将和微区内的荧光分子发生交换,于是漂白区域的荧光强度将会逐渐恢复(图1c,g和d,h)。
如果漂白区域内的分子都是流动的,那么其荧光强度将恢复到初始水平(前提是漂白区域远小于整个荧光薄膜)。如果不能完全恢复,则预示着漂白区域内有不能自由移动的分子。选取适合的分子扩散模型,对荧光恢复曲线(图1i)进行拟合,就可以获得目标蛋白的扩散系数或者扩散速率。
FRAP技术发展概览
FRAP技术兴起于上个世纪70年代,学术界一般认为Axelrod和Peter是这一技术的发明人。1事实上,在Axelrod和Peter之前,Liebman和Mu-Ming Poo等人,已经发展出基于光吸收的漂白恢复技术,或许可以叫做“吸收漂白后恢复(Absorbance recovery after photobleaching)”,用以研究视紫红质蛋白在视杆细胞的外节膜中的定向迁移。在Axelrod和Peter的研究中3-4,他们使用一束高功率密度的激光漂白掉细胞膜上某一个微区内的荧光分子,然后将同一束激光用减光片减弱后激发荧光,并用光电倍增管记录该区域的荧光强度,从而获得生物分子扩散的信息。5-7这些实验并未使用扫描式的激光照明,因此获得的主要是时间维度的分子扩散信息。80年代开始,相机的使用使得不仅可以观测到时间维度的荧光恢复过程,还可以在空间上观测到FRAP过程中的分子扩散信息。
90年代激光扫描共聚焦显微镜(Laser scanning confocal microscopy,简称LSCM)的迅猛发展促进了FRAP技术的快速发展。在此之前,进行FRAP实验需要自行搭建仪器装置,LSCM的出现让FRAP技术得到了迅速普及。8早期的共聚焦FRAP实验,先用激光漂白掉某一区域的荧光,然后同样使用减光片,通过移动激光或者样品,获得FRAP过程中的分子扩散的时空信息。但直到声光调制器(Acousto-optical modulator,简称AOM)和声光可调谐滤波器(Acousto-optical tunable filter,简称AOTF)的使用,结合LSCM显微镜激光逐个像素进行扫描(每个像素停留的时间通常是微秒)的优势,才使得共聚焦FRAP漂白任意形状区域的荧光成为了可能,比如研究高尔基体上相关的蛋白的迁移。1相比于单光子激发,双光子激发激发体积更小,因此双光子FRAP技术也被发展出来,该技术在样本的体相漂白中优势明显。9
共聚焦技术的快速商业化,使得在共聚焦显微镜上实现FRAP功能成为首选,8但价格相对便宜的宽场FRAP技术也被广泛使用。宽场FRAP技术的优点在于易于实现漂白过程中整个样本的快速荧光成像,这对于共聚焦系统来说是较难实现的。宽场FRAP技术在实现方式上与共聚焦FRAP略有不同:光漂白是借助扫描振镜快速移动高度汇聚的激光束(焦点处光斑尺寸~1微米)来实现的,宽场成像则可以使用常规的汞灯照明或者全内反射激发实现(Total internal reflection microscopy,简称TIRF)。这意味着普通的倒置荧光显微镜,只需购置FRAP模块,即可实现宽场FRAP功能,降低了成本。
另外,TIRF显微镜高的z轴分辨率(~200 nm),搭配FRAP模块,特别适合研究细胞膜表面蛋白分子的扩散行为。比如商业化TIRF-cellFRAP系统(图2),结合实时控制器(Real time controller,简称RTC)和计算器控制软件Cellsens,可以根据用户需实时动态漂白任意形状的区域,获得细胞膜表面的分子扩散信息。

图2 奥林巴斯宽场TIRF-cellFRAP系统
FRAP技术目前已经衍生出多种实验方案。- 如果重复漂白某微小的区域,那么与该区域相连的区域荧光强度将会逐渐降低,非连通区域将会凸显出来(荧光强度更亮),这一技术称为FLIP(即fluorescence loss in photobleaching)。
- 而若将微区以外的区域的荧光全部漂白掉,而观测微区以内荧光逐渐变暗的过程,称为iFRAP(即inverted FRAP)。
- 光激活显微成像技术(Photoactivation),也被称为FLAP(即fluorescence loss in after photoactivation)。
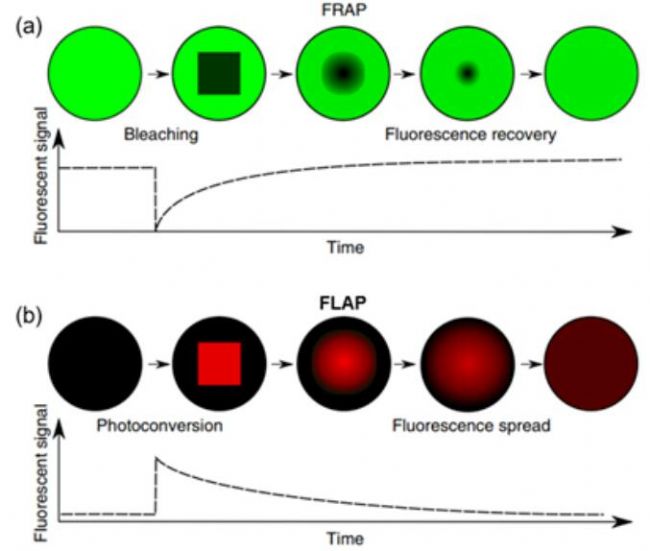
图3 FRAP过程(a)和FLAP过程(b)对比
FRAP技术在化学和材料科学领域的最新的应用实例
用FRAP显微镜研究一些人工分子膜体系,其方法与研究细胞膜表面膜蛋白的迁移类似,在此不再赘述。
下面重点介绍几个比较新的实例——利用FRAP显微镜研究复杂的光化学和光物理过程。这些体系尽管同样表现出FRAP行为,但却不是分子物种的扩散引起,其本质是化学反应或者光物理过程。这些应用充分展现了FRAP技术在化学和材料科学研究中的价值。
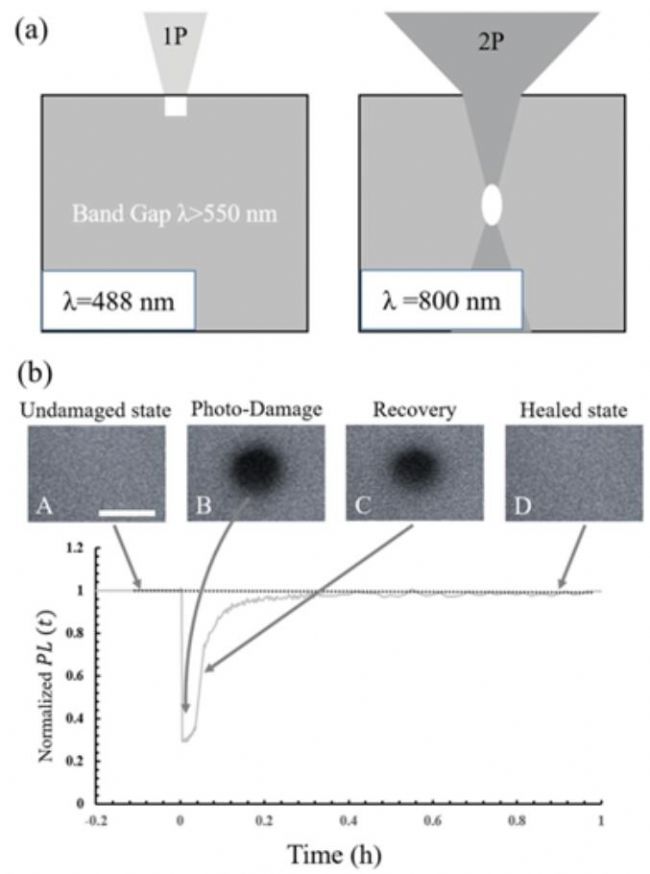
- 双光子FRAP显微镜研究钙钛矿材料的自修复行为9
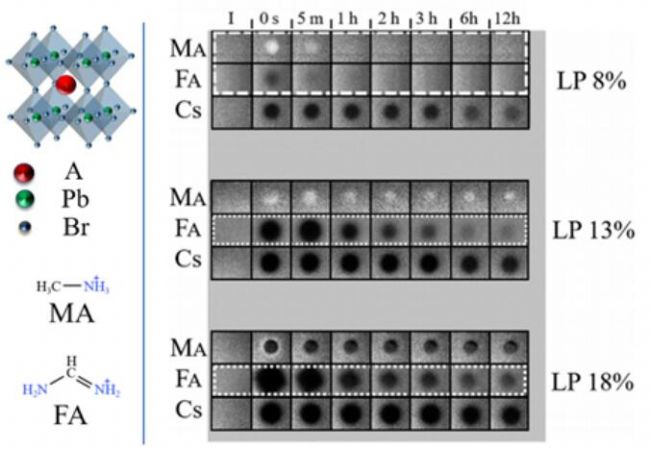
2018年,以色列魏茨曼科学研究所Ceratti等人,使用共聚焦显微镜上搭配的双光子FRAP装置回答了这一问题,发现这是APbBr3(X=MA(甲胺),FA(甲脒),Cs+)钙钛矿的本征属性,且自修复的速度与A位阳离子的种类密切相关。在研究中,他们利用双光子激发照明体积小的优点,用波长为800 nm的激光照射了距离钙钛矿单晶表面110 mm处的体相区域(光刺激破坏材料结构,令APbBr3分解成ABr,Pb(0),Br2,ABr3等),发现APbBr3表现出FRAP行为,证明了钙钛矿自修复是其本征属性(如图4所示),而与表界面或者水、空气等无关。有趣的是,与生物膜相关的FRAP实验相比,钙钛矿自修复过程表现出更长的荧光恢复时间(几十分钟)。
研究进一步发现,A位阳离子显著影响钙钛矿单晶的自修复行为:FAPbBr3的自修复速率最快,MAPbBr3次之,而CsPbBr3自修复速率最慢(图5)。这一结果与钙钛矿领域的共识相悖——全无机CsPbBr3钙钛矿比有机-无机杂化钙钛矿具有更高的化学稳定性。作者提出,不同阳离子的钙钛矿分解,尽管产生相似的中间体,但中间体的物理化学性质不同,MAPbBr3和FAPbBr3分解产生的ABr3物种是气体,易于与分解产生的Pb(0)物种重新结合形成APbBr3结构,而CsBr3是固体,因而自修复速度最慢。作者进一步研究了漂白功率对钙钛矿材料的自修复行为的影响,发现总体上还是FAPbBr3自修复速率最快,而且漂白功率越大材料自修复的时间越长(可达数小时),但是漂白功率过大材料将无法修复(图5)。更为有趣的是,MAPbBr3在低的漂白功率下会表现出光致亮化现象(LP8%,图5),作者推断可能是低功率激光照射产生了一些有利于发光的浅缺陷或者提高了材料的结晶度所致。
- 利用FRAP技术研究单个有机分子晶体当中的化学反应动力学12
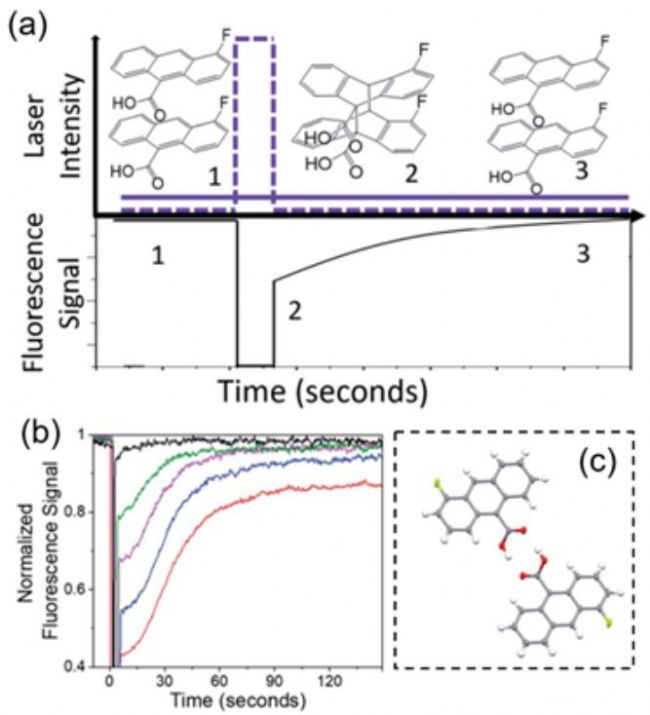
2020年,加州大学河滨分校Christopher J. Bardeen课题组,使用FRAP显微镜测量单个有机分子晶体——4-甲基-9羧基蒽(4-fluoro-9-anthracenecarboxylic acid,4F-9AC)的光化学二聚产物在室温下的固相热分解动力学。由于4F-9AC呈现出激基缔合物荧光(excimer,Ex=405 nm, Em=510 nm),而4F-9AC二聚物不具有excimer荧光,Christopher J. Bardeen使用自行搭建的FRAP显微镜研究了4F-9AC二聚物分子的固相热分解过程(刺激激光和探测激光均为405 nm,但后者的功率密度是前者的1%)。他们利用刺激激光去诱导4F-9AC二聚物分子的形成,而用探测激光观测其热分解动力学,发现该过程表现出FRAP行为(图6a)。有趣的是,该FRAP过程在高的刺激功率下呈现出S型动力学,而非通常的FRAP实验中指数或者近指数的荧光恢复过程,显著偏离了一级反应动力学(图6b)。这暗示高浓度的4F-9AC二聚物分子时该热分解过程被抑制,也就是说4F-9AC二聚物彼此之间存在相互作用。作者认为,这是由于高浓度4F-9AC二聚物分子时彼此间的氢键作用阻碍二聚物的解聚所致,而低浓度时二聚物与4F-9AC之间的氢键在热力学反而有利于热分解过程(图6c)。
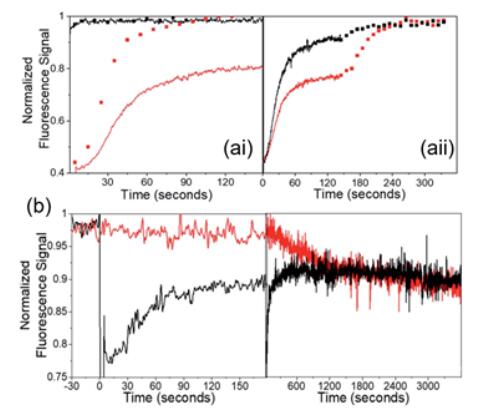
更有趣的是,研究发现该FRAP动力学不仅与刺激光的功率密度有关,还与探测光的照射方式有关(功率不变,连续或者间歇照射):在低的刺激功率下,探测光连续或者间歇照射,其FRAP动力学是一致的;但是高的刺激功率下,探测光如果连续照射,4F-9AC二聚物分子仅部分分解,而间断性照射则完全分解(图7ai)。同次实验中,探测光先连续照射再间歇式照射,也可以观测到这种差别(图7aii)。为什么探测光照明方式不同会造成这种差异呢?仔细研究发现,低功率探测光持续照射下,未经刺激光照射的样本,1h后会最终达到和刺激光照射的样品一样的荧光强度(图7b)。考虑到样品未被光损伤,且刺激光照射后黑暗条件下4F-9AC二聚物分子会热分解完全。这意味着弱功率密度的探测光照射,会形成4F-9AC二聚物分子(尽管动力学较慢),最终达到稳态,而强刺激光照射之后再弱探测照射,会让有机分子晶体更快的到达稳态。也就是说,借助两束激光,可以方便的调控不稳定物种——4F-9AC二聚物分子的浓度。
- 研究二维过渡金属硫族化合物的光物理机制13
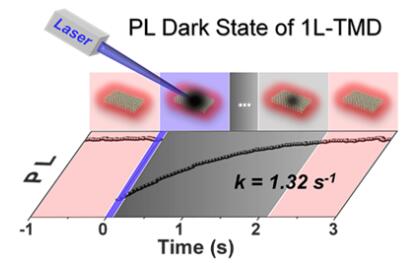
图8 借助FRAP显微镜时空操控二维单层半导体的荧光暗态的示意图
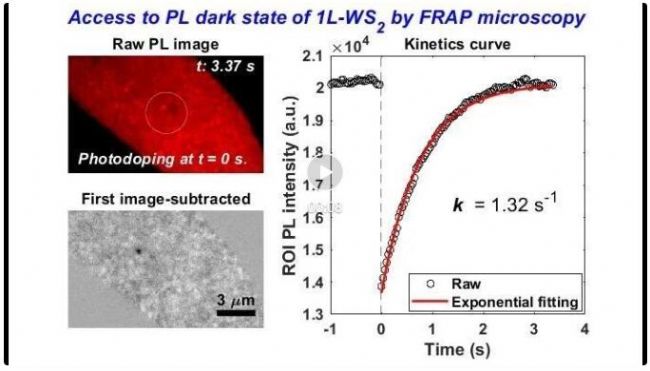
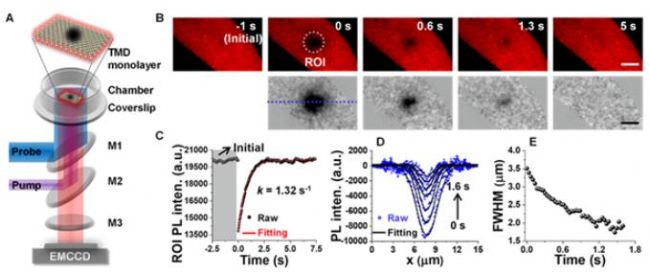
二维过渡金属硫族化合物单层(1L-TMDs,如MX2, M=W, Mo, X=S, Se),因其高的荧光量子产率、易通过光/电调控的载流子浓度、高激子结合能(几十meV到数百meV)、显著的激子–激子湮灭效应(EEA)等特点,近年来备受关注。另一方面,3个原子层的厚度的1L-TMDs表面具有大量的表面缺陷(主要是硫族元素缺陷),对其发光性能影响显著。为此,作者以1L-TMDs为模型半导体,使用商用奥林巴斯FRAP显微镜研究了其光生载流子间的相互作用(图9A所示),意外发现1L-TMDs表现出类似生物膜系统的FRAP行为,如图9B和C所示。众所周知,生物膜系统中的FRAP现象是由于生物膜的流动性(膜分子扩散)决定的。研究发现,1L-WS2荧光恢复过程中半峰宽(FWHM)逐渐减小,明显不同于生物膜FRAP过程中的FWHM逐渐增大的过程(图9D和E)。作者提出1L-WS2的这一过程为光物理过程,即1L-TMDs的FRAP行为源于光生载流子之间以及载流子与缺陷之间的相互作用(而非表面原子的扩散)。作者对光生载流子浓度进行了计算(以一个光子产生一个载流子估计),探测激光和泵浦激光功率分别为5 kW cm-2和40.8 kW cm-2时,对应产生的载流子浓度分别为~4.88×108 cm-2和~8.34×1012 cm-2(相邻激子之间的距离分别为~452.5 nm和~3.5 nm)。因此,光斑尺寸为~0.7 mm泵浦激光刺激,将会引发强烈的激子间相互作用(譬如EEA效应),而探测激光不会显著引起这一效应。进一步研究发现这一FRAP现象具有普遍性:1L-WSe2也表现出该FRAP行为,但是荧光恢复动力学较1L-WS2更快。
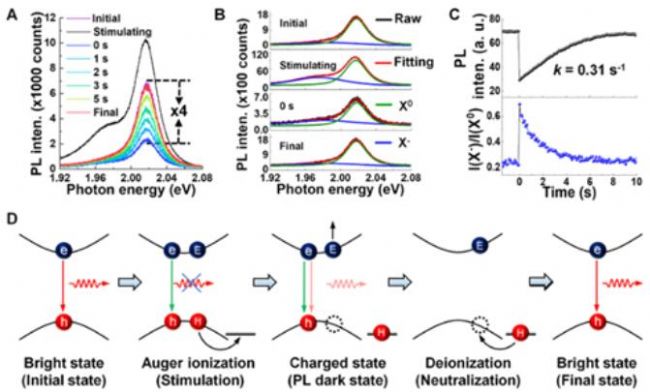
为了深入理解这一FRAP现象的本质,作者原位测量了1L-WS2在这一过程中的拉曼光谱,发现该过程中1L-WS2结构并未发生改变(譬如缺陷形成或者产生相变),排除了材料结构变化导致的FRAP行为。原位荧光光谱测试表明,泵浦激光刺激之后,出现了明显的带电激子(X-)发射峰(位于1.97 eV,中性激子X0位于2.02 eV),且荧光恢复过程中X-相对于X0的比例逐渐减小(图10A–C)。这一结果确认了X-的形成是泵浦激光照射导致的,并在荧光恢复过程中逐步转变为X。由于X-的形成需要自由载流子,这暗示着高功率的泵浦激光照射导致了自由载流子的形成(即光掺杂效应)。如何理解这一现象呢?在本工作中,泵浦激光照射产生的载流子浓度范围为3.27×1011–2.9×1013cm-2,如此高的载流子浓度下,电子–空穴之间的库仑相互作用被削弱,激子–激子碰撞的几率大大增加,激子容易解离成自由载流子(俄歇电离)。荧光寿命测试进一步发现,泵浦激光刺激后,荧光寿命从刺激前的~440 ps缩短到了~350 ps,随后又逐渐恢复到~440 ps,与原位荧光光谱测量时X-的演化相一致。这些结果确证,1L-WS2荧光暗态是带电激子的俄歇非辐射过程导致的。基于这些实验事实,作者提出了1L-WS2的FRAP过程的光物理机制(图10D)。
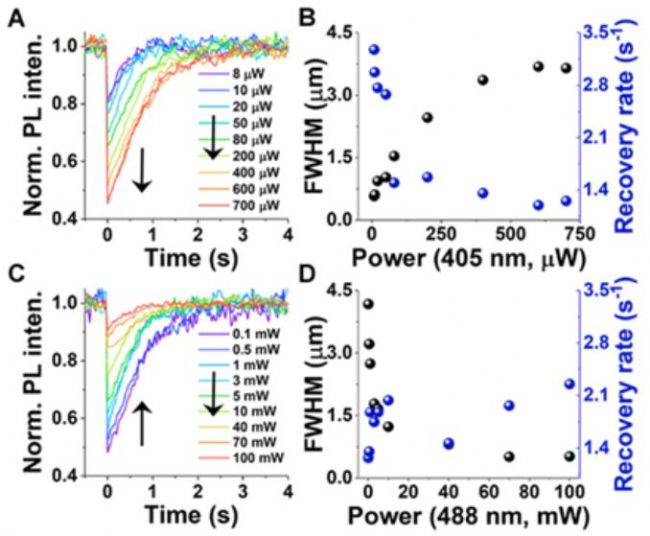
相对于零维的量子点,2D 1L-TMDs大平面的特性为位置可控的操控载流子提供了方便。为此,作者选择了尺寸为~10mm的1L-WS2,交替改变泵浦光和探测光功率,探究其对FRAP动力学的影响。研究发现,固定探测激光的功率,随着泵浦激光功率的增加(1.6–142.8 kW cm-2),1L-WS2荧光暗斑的FWHM逐渐增大(最大FWHM约为~4mm),FRAP过程的动力学逐渐变慢(图11A, B)。有趣的是,固定泵浦激光的功率,随着探测激光功率的增加(0.17–166.7 W cm-2),FRAP过程的动力学逐渐加快,1L-WS2荧光暗斑的FWHM逐渐减小(FWHM = ~0.5–5 mm,图11C, D),这说明激发光能够促进被捕获空穴从缺陷处释放出来(即光致去掺杂)。需要指出的是,尽管光掺杂效应在2D 1L-TMDs发光材料领域已经被广泛报道,但这一光致去掺杂效应尚未见诸报道。这意味着,尽管大量存在的硫族元素缺陷在工作状态下可能捕获光生载流子降低2D 1L-TMDs发光效率,光照也能够将这些被捕获的载流子释放出来,确保2D 1L-TMDs处于电荷平衡态。这一发现或许能够解释2D 1L-TMDs荧光闪烁不显著的现象(在W cm-2这个激发条件下)。
展望
FRAP显微镜自上个世纪70年代被发展出来,目前主要被生物学家用作研究生物体系中生物分子的扩散和迁移,它在揭示生物分子功能和研究分子互作方面发挥了重要作用。然而,除了一些类生物膜分子的扩散研究,FRAP显微镜尚未被广大化学工作者所熟知和采用。总体而言,生物体系中的FRAP实验聚焦在观察生物分子的迁移。本文所列举的几个用FRAP显微镜研究光化学和光物理的例子表明,FRAP过程在化学领域也广泛存在。与生物体系中的FRAP所不同的是,这些化学领域的FRAP过程与分子的扩散往往没有显著的关联,而是与物质结构的改变有关,即分子层次可逆的化学反应或者电子位态的可逆改变。总结起来,化学领域的FRAP过程,大致有以下几个特点:
1)时间维度的FRAP过程,往往是局部区域可逆的物质结构改变所致。化学领域的FRAP过程可呈现毫秒到小时的时间跨度。
2)与生物体系中因物种扩散而产生的FRAP现象相比,化学FRAP过程往往表现出FWHM逐渐减小的特点,这一现象很可能与刺激激光束的光强呈高斯分布有关。
3)除了刺激光强度影响FRAP动力学,探测光也会显著影响FRAP动力学,根据化学体系的不同,可以呈现抑制恢复或者促进恢复的效果。
4)化学领域所观测到的FRAP现象,须结合多种原位结构表征手段探究变化本质,不能简单归因于原子、分子或者电子扩散,更不能生搬硬套生物膜FRAP的数学模型。
总之,化学乃变化之学。这些FRAP案例,生动的展示了FRAP在操控化学反应动力学和物质状态上的重要价值。笔者坚信,未来将会涌现更多有趣的例子,充分发挥 FRAP这一研究工具在化学和材料科学领域的价值。
参考文献
(1) Lorén, N.; Hagman, J.; Jonasson, J. K.; Deschout, H.; Bernin, D.; Cella-Zanacchi, F.; Diaspro, A.; McNally, J. G.; Ameloot, M.; Smisdom, N.; Nydén, M.; Hermansson, A.-M.; Rudemo, M.; Braeckmans, K. Fluorescence recovery after photobleaching in material and life sciences: Putting theory into practice. Quarterly Reviews of Biophysics 2015, 48 (3), 323-387.
(2) Bläßle, A.; Soh, G.; Braun, T.; Mörsdorf, D.; Preiß, H.; Jordan, B. M.; Müller, P. Quantitative diffusion measurements using the open-source software pyfrap. Nature Communications 2018, 9 (1), 1582.
(3) Poo, M.-M.; Cone, R. A. Lateral diffusion of rhodopsin in necturus rods. Experimental Eye Research 1973, 17 (6), 503-507.
(4) Liebman, P. A.; Entine, G. Lateral diffusion of visual pigment in photoreceptor disk membranes. Science 1974, 185 (4149), 457-459.
(5) Peters, R.; Peters, J.; Tews, K. H.; Bähr, W. A microfluorimetric study of translational diffusion in erythrocyte membranes. Biochimica et Biophysica Acta (BBA) -Biomembranes 1974, 367 (3), 282-294.
(6) Axelrod, D.; Koppel, D. E.; Schlessinger, J.; Elson, E.; Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophysical journal 1976, 16 (9), 1055-1069.
(7) Axelrod, D.; Ravdin, P.; Koppel, D. E.; Schlessinger, J.; Webb, W. W.; Elson, E. L.; Podleski, T. R. Lateral motion of fluorescently labeled acetylcholine receptors in membranes of developing muscle fibers. Proceedings of the National Academy of Sciences 1976, 73 (12), 4594-4598.
(8) Fritzsche, M.; Charras, G. Dissecting protein reaction dynamics in living cells by fluorescence recovery after photobleaching. Nature Protocols 2015, 10 (5), 660-680.
(9) Ceratti, D. R.; Rakita, Y.; Cremonesi, L.; Tenne, R.; Kalchenko, V.; Elbaum, M.; Oron, D.; Potenza, M. A. C.; Hodes, G.; Cahen, D. Self-healing inside apbbr3 halide perovskite crystals. Advanced Materials 2018, 30 (10), 1706273.
(10) Lippincott-Schwartz, J.; Altan-Bonnet, N.; Patterson, G. H. Photobleaching and photoactivation: Following protein dynamics in living cells. Nature cell biology 2003, S7-14.
(11) Hailey, D. W.; Rambold, A. S.; Satpute-Krishnan, P.; Mitra, K.; Sougrat, R.; Kim, P. K.; Lippincott-Schwartz, J. Mitochondria supply membranes for autophagosome biogenesis during starvation. Cell 2010, 141 (4), 656-667.
(12) Easley, C. J.; Tong, F.; Dong, X.; Al-Kaysi, R. O.; Bardeen, C. J. Using light intensity to control reaction kinetics and reversibility in photomechanical crystals. Chemical Science 2020, 11 (36), 9852-9862.
(13) Su, H.; Nie, Y.; Sun, Q.; Yin, L.; Li, J.; Xia, X.-H.; Xu, W.; Wang, W. Spatiotemporally controlled access to photoluminescence dark state of 2D monolayer semiconductor by FRAP microscopy. Advanced Functional Materials 2022, 32 (9), 2107551.