支原体检测|背景知识与法规要求
2023-10-20 来源:本站 点击次数:520近年来,在细胞治疗、生物药物研发和生产过程中,支原体检测是确保产品质量的重要环节。支原体是一种微生物,它可能对生物医药产品的质量和安全性产生负面影响。因此,对支原体进行检测和控制是为了减少对细胞的危害、防止支原体从各种途径污染生物制品、减少支原体污染对生物医药产品质量、患者与经济带来的损失。支原体污染检测作为生物药产品开发的重要质控指标,必须在各个过程中进行,包括原材料、细胞库、病毒种子库、未加工的收获液材料和最终产品。
什么是支原体
支原体(mycoplasma)是一种无细胞壁的已知体积最小的原核微生物,可用人工培养基培养增殖,其大小介于细菌和病毒之间(直径约0.1-0.8 µm),因此一般细菌过滤器(0.22 µm)无法有效去除。支原体污染在细胞培养领域普遍存在。包括以细胞为基质生产的生物制品,如病毒性疫苗、重组生物技术产品等。
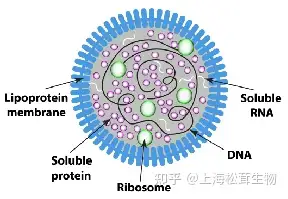
注:大部分支原体种类粘附在细胞表面,少量可在内部
支原体研究简史

重要发现:
- 1956:Johns Hopkins科学家报道HeLa细胞的支原体污染
- 1990:FDA检测了2万个细胞培养物,发现15%有支原体污染
- 1991:阿根廷科学家发现,来自200份样本中的70%是有污染
- 2002:DSMZ发现440株细胞系中的28%是有污染
- 2015年一份《Nucleic Acid Research》的研究支出,9395个样本RNA数据中,884个(11%)有支原体特异性序列
法规指南/风险评估
- 中国药典2015版三部:生物制品生产检定用动物细胞基质制备及质量控制
- 中国药典2020版四部:3301 支原体检查法
- 欧洲药典 2.6.7:Mycoplasmas
- 美国药典 <63>:Mycoplasma Tests
- 人用药品技术要求国际协调理事会,ICH Q5D:用于生物技术产品及生物制品生产的细胞基质的来源和鉴定
- FDA: 用于生产生物制品的细胞系检定的考虑要点(1993)
- FDA: 在生产和检测人用单克隆抗体产品时的考虑要点(1997)
- FDA: 用于生产传染病适应症病毒疫苗的细胞基质和其他生物材料的检定和验证(2010 )
- 国家药监局药审中心关于发布《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》的通告(2022年第30号)
支原体检测是生物制品质量控制的重要环节,在生物制品过程中,为确保生物制品的安全性和有效性,涉及到的细胞与生物源性材料,均需要进行支原体检测。对于细胞治疗产品而言,在生产过程不同阶段涉及到的所有生物源性材料、病毒载体生产细胞、病毒载体、CAR-T细胞产品,均需要进行支原体检测。
翼和支原体检测试剂盒
支原体检测试剂盒(快检法):
货号: BPM50规格:50 Reactions/盒
范围:可覆盖 100 种支原体
可靠:含内参基因,避免假阴性
稳定: 全程闭管操作,无交叉污染
方便:操作简单,无需 DNA 提取步骤
高灵敏度支原体检测试剂盒:
货号:BPMPro100规格:100 Reactions/盒
范围:可覆盖 100 种支原体
可靠:内参质控全程,避免假阴性/假阳性
灵敏:优化反应体系,灵敏度低至 10CFU/ML
方便:流程规范,检测过程最快达 1 小时
相关文章
更多 >

