Kirkstall 3D活细胞自动灌流培养系统最新应用分享
2025-04-08 来源:本站 点击次数:1004近日,伦敦帝国理工学院抗菌药物优化中心,伦敦卫生和热带医学学院传染病和热带病学院Alaa Riezk et al.研究团队,利用英国Kirkstall 3D 活细胞自动灌流培养系统模拟生理流体流动,对比了静态和动态培养条件下巨噬细胞的反应及抗利什曼原虫纳米药物的疗效,强调了流体流动动力学在体外研究中的重要性,为皮肤利什曼病治疗策略的优化提供了参考。
一. 研究背景:
利什曼病是由利什曼原虫引起的寄生虫病,包括内脏利什曼病和皮肤利什曼病等,现有治疗手段存在局限且新药研发不足。传统静态细胞培养系统无法模拟体内动态环境,而动态培养系统能更好地模拟细胞在体内的生理条件,有助于更准确地研究细胞行为和病原体相互作用。本研究旨在探究Kirkstall 3D 活细胞自动灌流培养系统 模拟的动态流体灌注,对巨噬细胞功能及基于壳聚糖的抗利什曼原虫制剂疗效的影响。
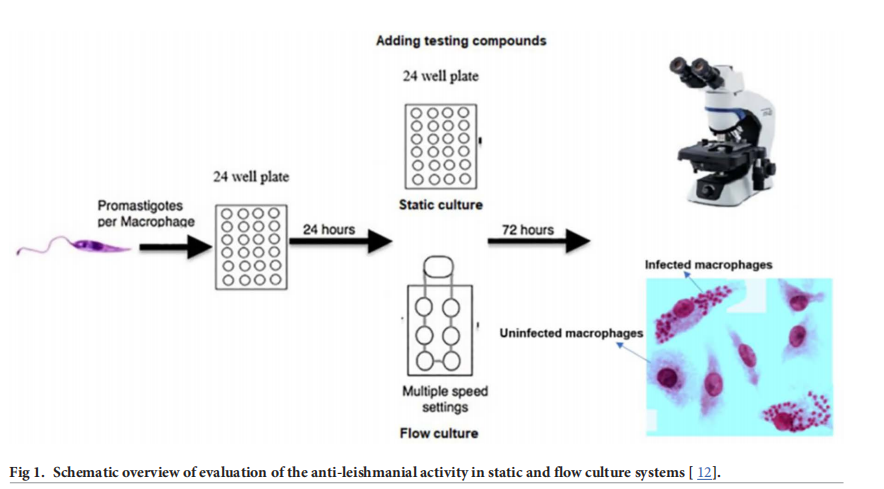
二. 主要实验仪器/关键实验步骤描述:
1. 实验准备阶段
1.1 选择实验系统:选用英国Kirkstall QV介质灌注系统,其六腔光学托盘可实现细胞在不同介质灌注速率下的培养,且能直接观察感染细胞并持续监测感染情况。为模拟人体间质液条件,通过数学和计算模型确定插入块高度,以确保细胞表面流速符合皮肤间质液流速范围。实验设置了静态(0 m/s)、慢速(\(1.45×10^{-9}m/s\) ,细胞位于腔室底部)和快速(\(1.23×10^{-7}m/s\) ,细胞位于插入块上)三种流动条件
1.2细胞与寄生虫培养:利什曼原虫(L. major,MHOM/SA/85/JISH118)的无鞭毛体从感染小鼠皮肤损伤处分离并转化为前鞭毛体,在添加10%热灭活胎牛血清(HiFCS)的Schneider昆虫培养基中于26°C培养,定期通过BALB/c小鼠传代,实验使用低代数(<3代)前鞭毛体。从6 - 8周龄雌性BALB/c小鼠获取骨髓来源的巨噬细胞(BMMs) ,从8 - 10周龄雌性CD1小鼠获取腹腔巨噬细胞(PEMs) 。THP - 1细胞在添加L - 谷氨酰胺和10% HiFCS的RPMI - 1640培养基中,于37°C、5% \(CO_2\) 培养箱培养,每周按1/10比例传代,用20 ng/mL佛波酯12 - 肉豆蔻酸13 - 乙酸酯(PMA)处理24小时诱导分化为巨噬细胞。
2. 感染巨噬细胞:将巨噬细胞(PEMs、BMMs、THP - 1细胞)以每孔\(4×10^5\) 个细胞的密度接种在24孔板的12mm圆形玻璃盖玻片上,在RPMI - 1640培养基(含10% HiFCS)中于37°C、5% \(CO_2\) 孵育24小时。之后,加入不同浓度的L. major前鞭毛体(使寄生虫与巨噬细胞比例在0.5:1至15:1之间),在34°C、5% \(CO_2\) 环境下继续孵育24小时。随后,将三分之二的玻璃盖玻片转移至QV900系统进行动态培养,其余作为静态对照,在相同温度和\(CO_2\) 浓度下继续培养72小时。培养结束后,用甲醇固定细胞,并用吉姆萨染色 。
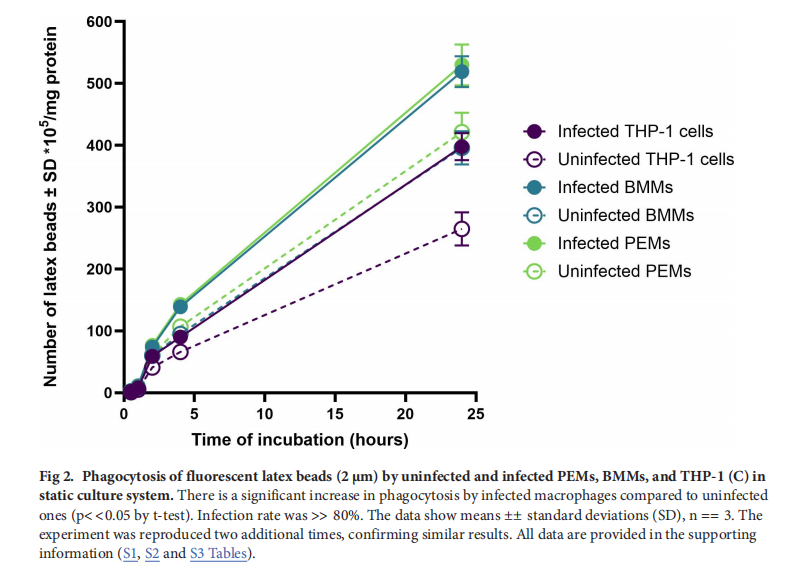
3. 测量巨噬细胞功能
3.1吞噬作用:利用2μm直径的荧光红色标记乳胶珠评估巨噬细胞的吞噬作用。巨噬细胞感染L. major前鞭毛体并在不同流动条件下孵育0.5 - 24小时后,用冰冷PBS洗涤去除未内化的珠子,再用0.5% Triton X - 100和0.2 M NaOH裂解细胞。通过荧光酶标仪(激发波长575nm,发射波长610nm)分析细胞裂解物,以确定吞噬的乳胶珠数量,并根据细胞蛋白含量(使用Micro BCA蛋白试剂盒测定)进行标准化。实验设置了细胞松弛素D(1μg/ml)抑制吞噬作用的对照组 。
3.2巨胞饮作用:采用pHrodo Red葡聚糖(在酸性环境中发荧光)测量巨噬细胞的巨胞饮作用。巨噬细胞感染寄生虫后在不同流动条件下培养,用Live Cell Imaging Solution洗涤三次,然后在含10% HiFCS和40μg/mL pHrodo Red葡聚糖的RPMI - 1640培养基中于34°C、5% \(CO_2\) 孵育0.5 - 24小时。孵育结束后再次洗涤细胞,用荧光酶标仪(激发波长560nm,发射波长585nm)检测巨胞饮活性。实验使用10μg/ml丙嗪(已知的巨胞饮抑制剂)孵育巨噬细胞2小时,以抑制巨胞饮作用,作为对照组 。
4. 药物和纳米颗粒的制备与表征
4.1药物和纳米颗粒制备:两性霉素B(AmB,纯度≥95%)用DMSO溶解配制成10mM储存液,再稀释于含10%HiFCS的RPMI - 1640培养基中备用。取1g高分子量壳聚糖(MW = 310 - 375kDa)溶解于100mL 1%溶液,室温搅拌24小时至澄清,用2M氢调节pH至6.5。制备纳米颗粒时,在搅拌条件下,向10mL壳聚糖溶液中逐滴加入10mL TPP水溶液(制备空白纳米颗粒不加AmB,制备载药纳米颗粒则加入0.5mL AmB),搅拌5分钟后超声15分钟以减小粒径,再通过0.2µm注射器过滤器过滤去除聚集体和较大颗粒,然后用30kDa离心过滤器(Spin - X UF concentrators)离心纯化和浓缩,去除未包裹的AmB,最后加入5%蔗糖作为冷冻保护剂进行冻干,48小时后收集冻干的纳米颗粒并储存于4°C 。
4.2药物和纳米颗粒表征:通过高效液相色谱(HPLC)分析AmB,计算包封率(EE)和药物负载量。公式分别为:EE(%) = 100×(总AmB重量 - 游离AmB重量)/总AmB重量;药物负载量(%) = 100×(总AmB重量 - 游离AmB重量)/(壳聚糖重量 + TPP重量) 。使用ZetaSizer测量纳米颗粒的平均直径、zeta电位和多分散指数,用Malvern ZetaSizer软件v7.11进行数据分析。
5. 评估介质流动对药物和纳米颗粒疗效的影响:将PEMs接种在玻璃盖玻片上,在静态条件下感染前鞭毛体24小时。之后,将三分之二含有感染巨噬细胞的盖玻片转移至QV900系统,在34°C、5% \(CO_2\) 培养箱中以360μL/min的流速进行动态培养,分别设置细胞位于腔室底部(慢速流动,\(1.45×10^{-9}m/s\) )和位于插入块上(快速流动,\(1.23×10^{-7}m/s\) )两种情况,其余盖玻片作为静态对照。在静态感染24小时后,用于药物活性研究的培养基中添加不同浓度的药物(壳聚糖溶液、空白壳聚糖 - TPP纳米颗粒、载药AmB的壳聚糖 - TPP纳米颗粒、纯AmB)。72小时后,取出所有盖玻片,用甲醇固定、吉姆萨染色,在显微镜下计数感染巨噬细胞数量,评估药物对寄生虫感染的抑制效果,使用Prism软件(GraphPad)进行非线性S型曲线拟合(可变斜率)分析数据 。
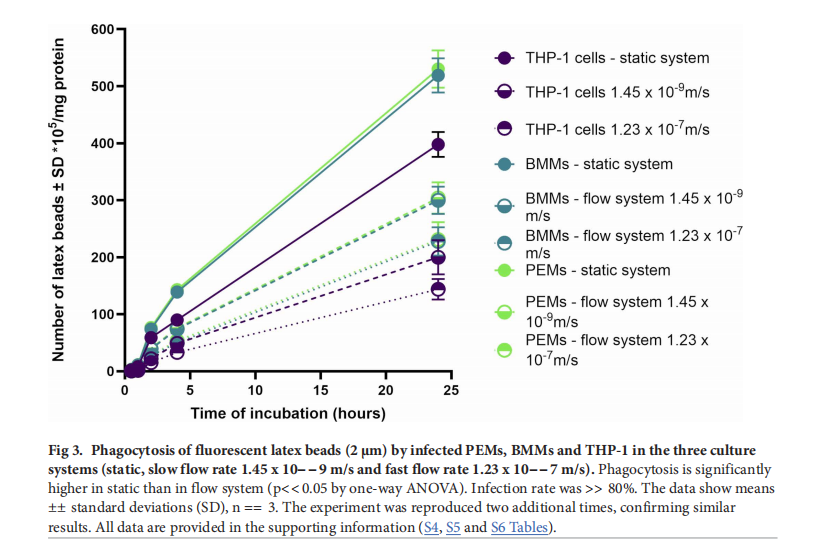
三. 研究结果
- 巨噬细胞功能:感染L. major的巨噬细胞(PEMs、BMMs和THP - 1)的吞噬和巨胞饮作用比未感染细胞显著增强,且PEMs和BMMs的这两种功能高于THP - 1细胞。动态流动条件下,巨噬细胞的吞噬和巨胞饮作用显著降低,且流速越快,降低越明显。
- 抗利什曼原虫活性:所有制剂在静态培养中的抗利什曼原虫活性均高于动态培养。随着流速增加,壳聚糖溶液、空白壳聚糖 - TPP纳米颗粒、载药AmB的壳聚糖 - TPP纳米颗粒以及纯AmB的抗利什曼原虫活性均显著下降 。流体流动动力学对评估巨噬细胞功能和抗利什曼原虫活性至关重要。流体流动会降低巨噬细胞的吞噬和巨胞饮功能,减少药物积累,进而降低抗利什曼原虫药物的疗效。未来研究应进一步探索流体流动对巨噬细胞行为的影响,以完善疾病机制研究和治疗策略的开发。
参考文献:Comparative assessment of macrophage responses and antileishmanial efficacy in dynamic vs. Static culture systems utilizing chitosan-based formulations,Published: March 11, 2025
北京基尔比生物科技有限公司主营:3D-clinostat 三维旋转仪,Kilby微/超重力三维细胞培养系统,3D回转重力环境模拟系统,随机定位仪,Kilby类器官芯片摇摆灌注仪,英国Kirkstall 类器官串联芯片灌流仿生构建系统
品牌制造商简介
Kirkstall Ltd.成立于2006年,是Braveheart Investment Group plc 的子公司,总部位于英国。Kirkstall开发了一种创新的微生理系统的器官芯片模型Quasi Vivo®。作为器官芯片技术,Kirkstall已经建立了牛津大学生物医学工程研究所等著名的大学实验室的庞大用户群,产品在全球范围内享有盛誉。
北京基尔比生物科技有限公司是Kirkstall ltd.授权在中国的总代理商,全面负责Kirkstall公司旗下所有产品在中国的销售,市场推广和技术支持等事宜

