AVATAR系统应用:低氧条件下胶质母细胞瘤代谢表型研究
2025-07-22 来源:本站 点击次数:1045
《Nature Metabolism》近期发布的一项研究通过多模态技术整合,首次证实胶质母细胞瘤(Glioblastoma, GB)代谢异质性主要由细胞内在因素驱动,挑战了微环境主导的传统认知。研究团队通过整合¹³C标记葡萄糖输注患者的质谱成像、空间转录组数据,并结合体外低氧培养及异种移植模型,系统分析了糖酵解型(高糖酵解低TCA循环活性)、氧化型(低糖酵解高TCA循环活性)及混合型(双低活性)三种代谢表型的决定因素。研究创新性地采用美国XCellbio公司开发的AVATAR低氧培养系统,对GB患者来源的神经球进行为期160小时的0.5% O₂浓度培养,以评估低氧微环境对代谢表型的影响。

实验结果显示,在AVATAR系统模拟的0.5% O₂低氧条件下,即使经过160小时培养,GB细胞的转录组和代谢特征仍保持稳定,未检测到适应性代谢重编程。这一关键发现证实了GB代谢亚型(如糖酵解型、氧化型)主要由细胞内在因素决定,并具有稳定的生物学特性。该研究不仅阐明了GB代谢异质性的细胞自主性调控机制,凸显了AVATAR系统在精确模拟肿瘤微环境和解析细胞固有代谢特征中的重要价值,为胶质母细胞瘤的代谢研究提供了新的理论依据和技术支撑。

实验方法
研究团队对三名胶质母细胞瘤患者在手术前静脉输注[U-¹³C]葡萄糖,随后通过快速冷冻保存肿瘤组织样本。质谱成像(DESI-MSI和MALDI-MSI)用于分析肿瘤代谢活性,同时结合空间转录组学(10X Genomics Visium平台)和成像质谱流式技术(IMC)对肿瘤微环境进行表征。患者来源的神经球在体外培养,并使用Matrigel基质胶包埋形成球体,部分神经球在低氧条件(0.5% O₂)下培养,实验中使用AVATAR(XCellbio)系统精确控制低氧环境。数据分析采用SCILS Lab、R和GraphPad Prism等软件,并通过严格的统计方法确保结果的可信度。
实验结果
1. 正常脑皮质与胶质母细胞瘤(GB)的代谢特征
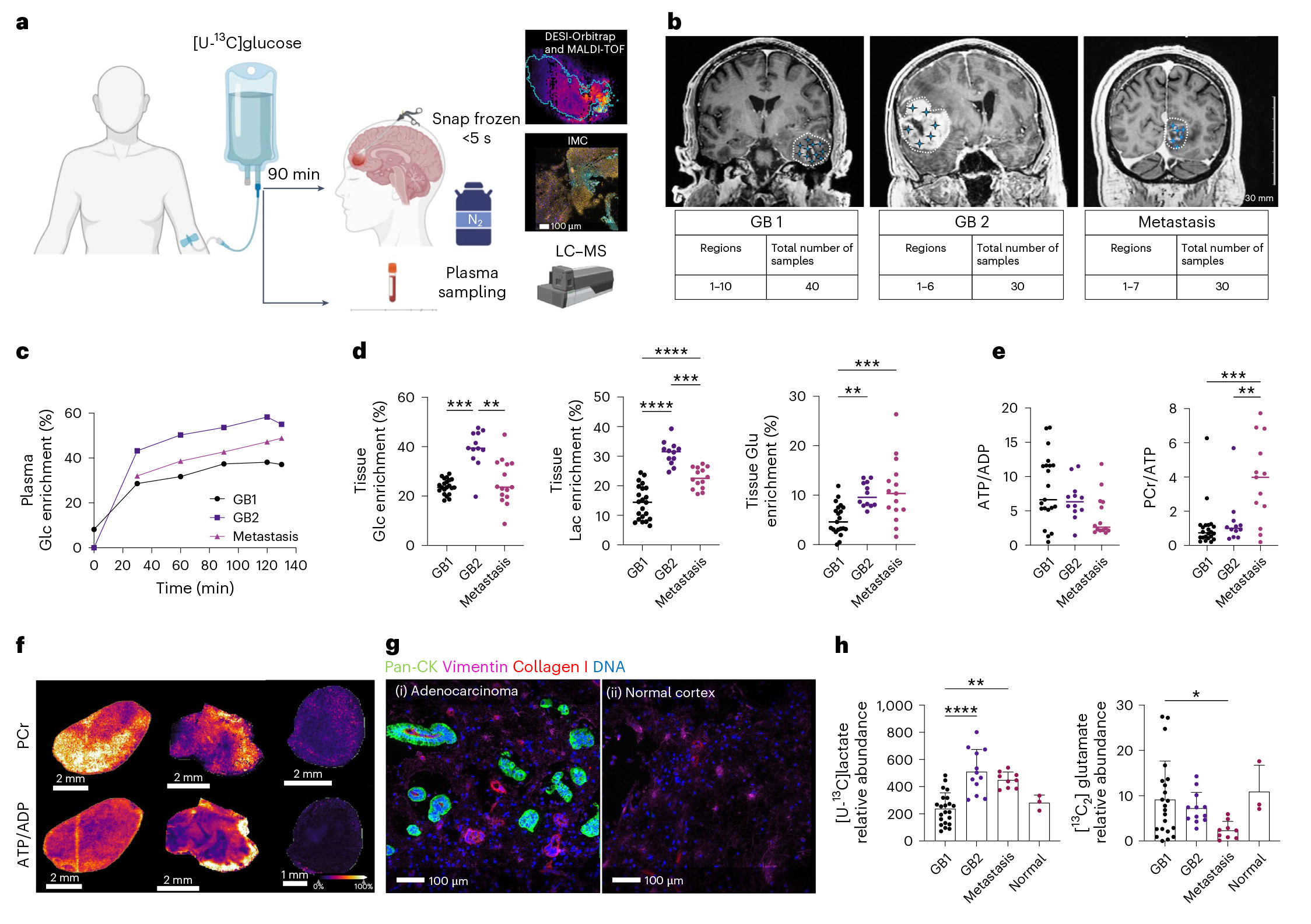
通过质谱成像(MSI)分析,胶质母细胞瘤(GB)与正常脑组织在代谢特征上存在显著差异。如图1h所示,GB1中[U-¹³C]乳酸信号显著低于GB2(P<0.0001),而[¹³C2]谷氨酸信号高于转移瘤(P=0.0394),反映了转移瘤中更高的糖酵解和更低的TCA循环活性。GB肿瘤中的谷氨酸标记与正常大脑中的标记相当。这些结果揭示了GB肿瘤代谢的异质性。
2. 代谢物13C标记揭示胶质母细胞瘤代谢表型
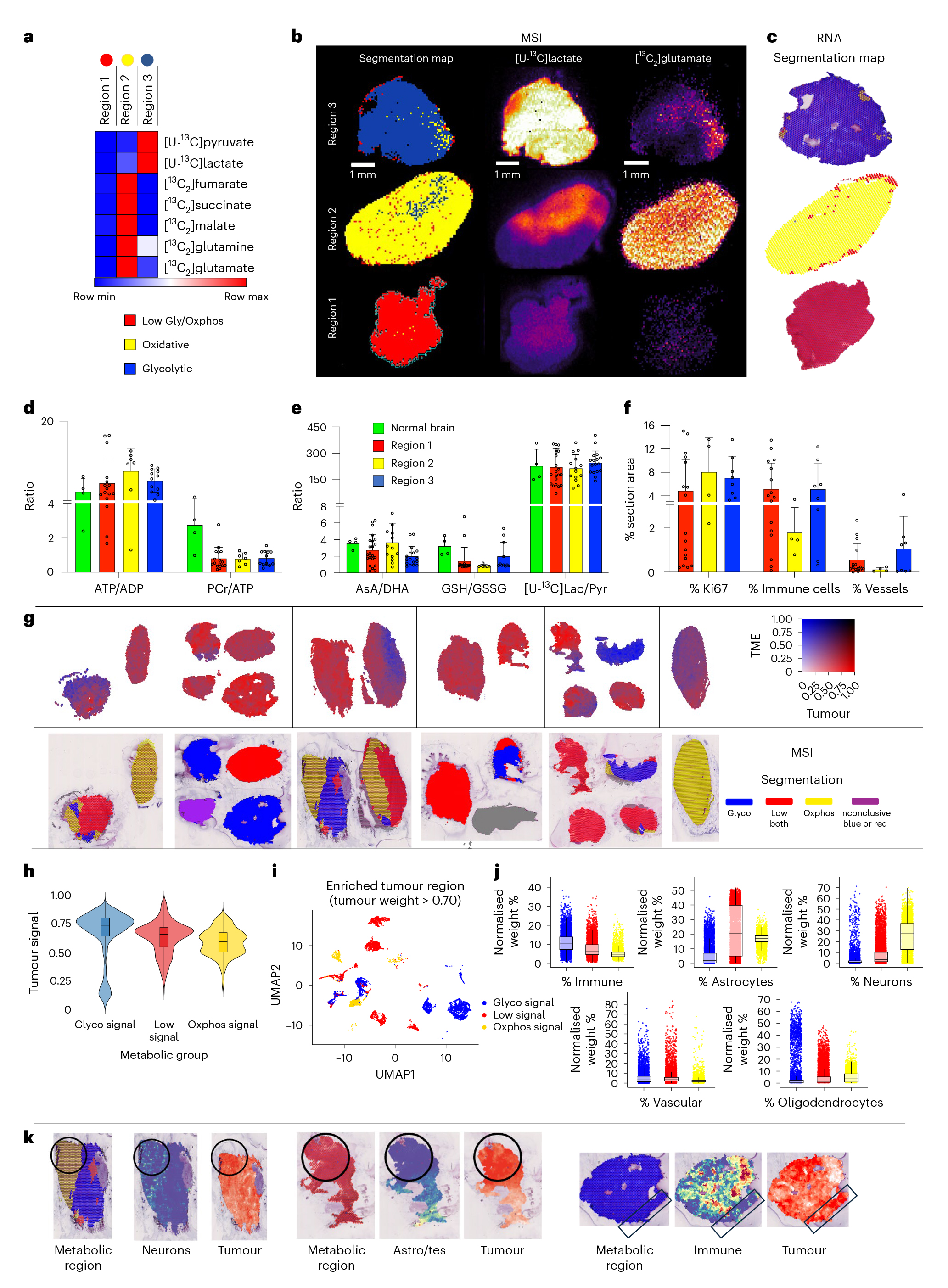
研究团队通过基于7种¹³C标记代谢物(糖酵解途径和TCA循环)的k-means聚类分析,在胶质母细胞瘤(GB)中鉴定出三种由肿瘤细胞自身决定的固有代谢表型:糖酵解型(状态3:高糖酵解低TCA循环活性)、氧化型(状态2:低糖酵解高TCA循环活性)以及混合型(状态1:两种途径活性均低)。值得注意的是,虽然GB1以氧化表型(状态2)为主,GB2以糖酵解表型(状态3)为主,但两种肿瘤内部均同时存在这三种代谢区域(图2b)。空间转录组分析进一步验证了这些代谢表型,与MSI数据显示出65%的一致性(图2c)。这些结果表明GB肿瘤具有显著的代谢异质性,且不同代谢表型在空间上形成明确分界的大区域,这种分布模式可能为临床代谢成像提供可行性基础。
3. 代谢表型与微环境无显著相关性
实验结果表明,胶质母细胞瘤(GB)的代谢表型(糖酵解型、氧化型和混合型)与肿瘤微环境(TME)的特征无显著相关性。通过质谱成像(MSI)和空间转录组分析发现,不同代谢表型区域的能量状态(ATP/ADP、PCr/ATP比值)、氧化还原水平(AsA/DHA、GSH/GSSG、乳酸/丙酮酸比值)以及微环境特征(免疫细胞浸润、增殖标志物Ki67表达、血管密度)均无显著差异(图2d、2e)。此外,坏死区域或与血管的距离也未影响代谢表型的分布。空间转录组数据进一步证明,恶性细胞主导区域可同时存在三种代谢状态,而免疫细胞富集区多呈糖酵解表型,神经元区域则以氧化型为主(图2g-i)。关键的是,低氧标志物CAIX表达及各类微环境细胞群在不同代谢区间无差异。这些证据共同表明,GB的代谢异质性主要源于肿瘤细胞自身固有的代谢重编程,而非微环境因素驱动。
4. 代谢表型与血管分布无显著关联
通过筛选大血管(胶原蛋白I+与αSMA+标记),并将其与连续质谱成像切片进行共定位,以65微米为间隔从血管腔向外测量¹³C标记的糖酵解和三羧酸循环代谢物。结果显示:无论距离血管远近,乳酸和谷氨酸标记水平、Ki67+染色所示的增殖细胞数量、NADPH/NADP+比值(AsA:DHA比值)或NADH/NAD+比值([U-¹³C]乳酸/[U-¹³C]丙酮酸比值)均无差异。然而,随着与血管壁距离的增加,免疫细胞数量呈下降趋势。这些数据表明,GB肿瘤细胞的代谢特征不受局部血管供应的显著影响,进一步支持了代谢表型的细胞固有性,而非由血管微环境驱动的结论。
5. 原代神经球保留肿瘤代谢表型特征
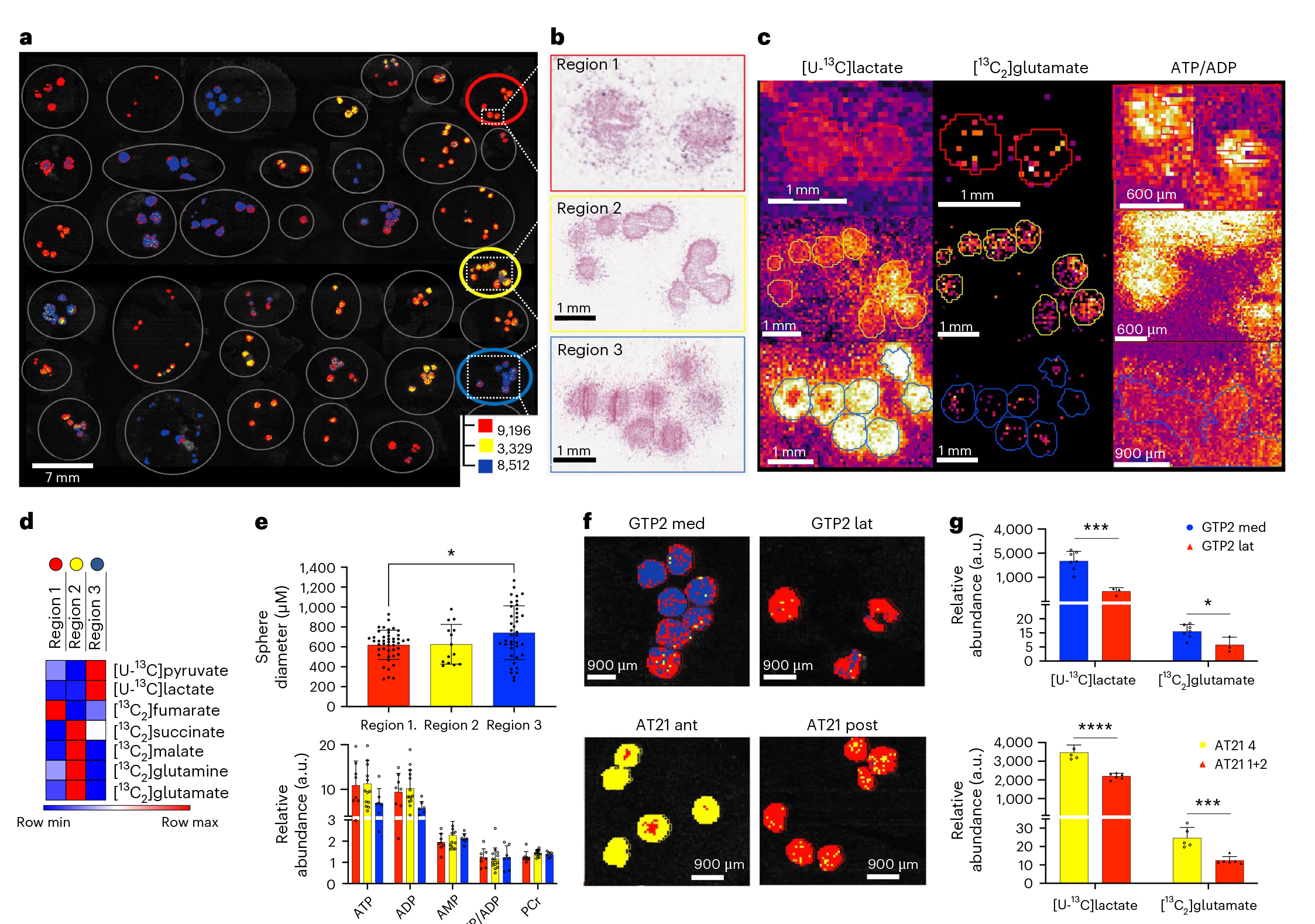
实验结果表明,胶质母细胞瘤(GB)患者来源的原代神经球在体外培养条件下仍能保留其体内观察到的三种代谢表型(糖酵解型、氧化型和混合型)。通过质谱成像(MSI)分析显示,神经球的代谢特征与原始肿瘤组织高度一致,且不同代谢表型的神经球在直径大小、能量状态(ATP/ADP比值)等方面无显著差异(图3a-e)。值得注意的是,来自同一肿瘤不同区域的神经球(如GTP2 Med和GTP2 Lat)展现出与原始区域相匹配的代谢异质性(图3f,g)。此外,这些代谢表型在长期低氧(0.5% O₂)培养条件下仍保持稳定,转录组分析未发现显著变化。这些发现证实了GB代谢表型的细胞固有性和可塑性,表明其独立于肿瘤微环境的影响,为后续体外研究和药物筛选提供了可靠模型。
6. 神经球代谢表型在大鼠脑中得以重现
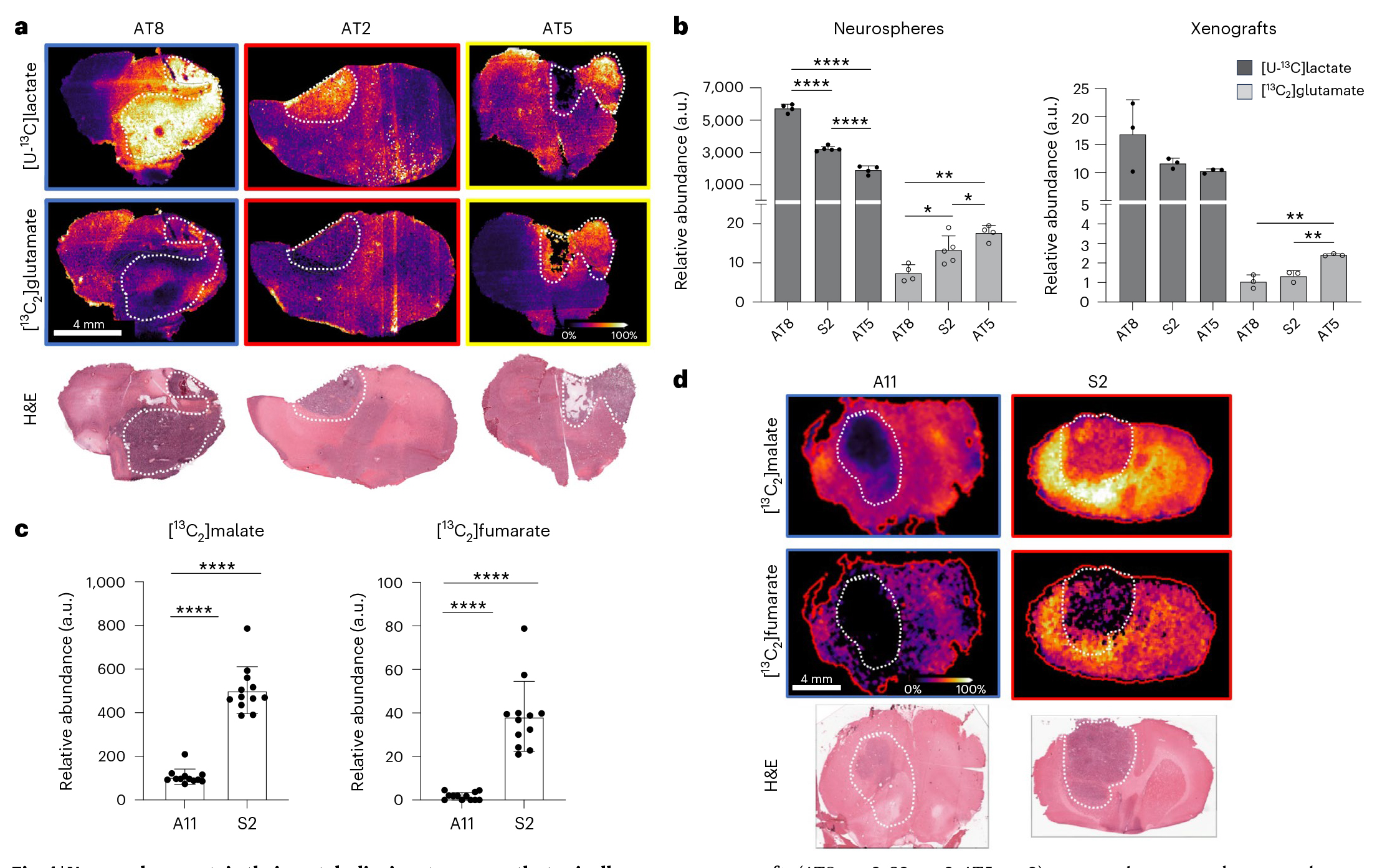
实验结果表明,体外培养的胶质母细胞瘤(GB)神经球代谢表型在异种移植到大鼠脑内后仍能稳定维持。通过质谱成像(MSI)分析显示,AT8和S2细胞形成的移植瘤表现出高糖酵解活性([U-¹³C]乳酸标记水平升高),而AT5移植瘤则呈现高氧化代谢特征([¹³C2]谷氨酸标记水平升高)(图4a,b)。这些代谢特征与原始神经球表型完全一致,且不受移植瘤中细胞增殖(Ki67)、凋亡(CC3)或血管化(CD31)程度的影响。值得注意的是,先前研究显示对放疗更敏感的S2细胞在移植后表现出比A11细胞更强的TCA循环活性(图4c,d),进一步验证了代谢表型与治疗响应的相关性。这些结果证实了GB代谢表型的细胞固有性在体内外环境中的稳定性,为基于代谢分型的个性化治疗研究提供了重要依据。
7. 代谢表型在其他通路中呈现特征性差异
患者肿瘤组织切片中,氧化性区域的未标记丝氨酸、苏氨酸、谷氨酰胺及谷氨酸浓度显著升高(ANOVA,Tukey检验P<0.05);神经球模型中,未标记亮氨酸/异亮氨酸、谷氨酰胺、谷氨酸、组氨酸和苯丙氨酸浓度亦显著增高(ANOVA,Tukey检验P<0.005)。这与既往研究中氧化型GB细胞依赖脂肪酸氧化的特征相符。这些发现揭示了代谢表型与多种代谢通路之间的广泛关联,为理解GB的代谢异质性及其潜在治疗靶点提供了新的分子层面的证据。
实验结论
本研究通过高分辨率质谱成像技术,在人体胶质母细胞瘤(GB)中实现了细胞代谢物同位素标记的原位可视化分析,结合患者来源神经球培养和原位移植瘤模型,系统证实了GB中存在三种由肿瘤细胞自身决定的固有代谢表型(糖酵解型、氧化型及混合型),这些表型基本独立于肿瘤微环境(TME)的影响。
研究创新性地采用AVATAR低氧培养系统(0.5% O₂)对患者来源神经球进行长达160小时的持续低氧培养,发现其转录组特征和代谢表型保持高度稳定,这一关键实验证据直接证实了GB代谢表型的细胞自主性及其对低氧微环境的抵抗能力。值得注意的是,与肺癌等肿瘤不同,GB细胞的TCA循环活性与正常脑组织相当,且其代谢特征不受组织灌注差异的影响,其中氧化表型细胞对线粒体抑制剂和放疗表现出显著敏感性。基于超极化¹³C-MRI等先进代谢成像技术的临床转化潜力,本研究不仅为GB的分子分型提供了新的代谢标志物,更开创了个体化治疗的新范式:如针对氧化型肿瘤采用放疗联合线粒体抑制剂。AVATAR系统的成功应用,为在可控低氧条件下研究肿瘤细胞的固有代谢特性建立了标准化技术平台,对深入理解肿瘤代谢异质性具有重要方法论意义。

AVATAR个体化细胞控制系统
实验结果显示,在AVATAR系统模拟的0.5% O₂低氧条件下,即使经过160小时培养,GB细胞的转录组和代谢特征仍保持稳定,未检测到适应性代谢重编程。这一关键发现证实了GB代谢亚型(如糖酵解型、氧化型)主要由细胞内在因素决定,并具有稳定的生物学特性。该研究不仅阐明了GB代谢异质性的细胞自主性调控机制,凸显了AVATAR系统在精确模拟肿瘤微环境和解析细胞固有代谢特征中的重要价值,为胶质母细胞瘤的代谢研究提供了新的理论依据和技术支撑。

实验方法
研究团队对三名胶质母细胞瘤患者在手术前静脉输注[U-¹³C]葡萄糖,随后通过快速冷冻保存肿瘤组织样本。质谱成像(DESI-MSI和MALDI-MSI)用于分析肿瘤代谢活性,同时结合空间转录组学(10X Genomics Visium平台)和成像质谱流式技术(IMC)对肿瘤微环境进行表征。患者来源的神经球在体外培养,并使用Matrigel基质胶包埋形成球体,部分神经球在低氧条件(0.5% O₂)下培养,实验中使用AVATAR(XCellbio)系统精确控制低氧环境。数据分析采用SCILS Lab、R和GraphPad Prism等软件,并通过严格的统计方法确保结果的可信度。
实验结果
1. 正常脑皮质与胶质母细胞瘤(GB)的代谢特征
通过质谱成像(MSI)分析,胶质母细胞瘤(GB)与正常脑组织在代谢特征上存在显著差异。如图1h所示,GB1中[U-¹³C]乳酸信号显著低于GB2(P<0.0001),而[¹³C2]谷氨酸信号高于转移瘤(P=0.0394),反映了转移瘤中更高的糖酵解和更低的TCA循环活性。GB肿瘤中的谷氨酸标记与正常大脑中的标记相当。这些结果揭示了GB肿瘤代谢的异质性。

图1.术中冷冻可迅速阻滞组织代谢并实现代谢活动的可视化
2. 代谢物13C标记揭示胶质母细胞瘤代谢表型
研究团队通过基于7种¹³C标记代谢物(糖酵解途径和TCA循环)的k-means聚类分析,在胶质母细胞瘤(GB)中鉴定出三种由肿瘤细胞自身决定的固有代谢表型:糖酵解型(状态3:高糖酵解低TCA循环活性)、氧化型(状态2:低糖酵解高TCA循环活性)以及混合型(状态1:两种途径活性均低)。值得注意的是,虽然GB1以氧化表型(状态2)为主,GB2以糖酵解表型(状态3)为主,但两种肿瘤内部均同时存在这三种代谢区域(图2b)。空间转录组分析进一步验证了这些代谢表型,与MSI数据显示出65%的一致性(图2c)。这些结果表明GB肿瘤具有显著的代谢异质性,且不同代谢表型在空间上形成明确分界的大区域,这种分布模式可能为临床代谢成像提供可行性基础。

图2.胶质母细胞瘤(GB)组织切片中代谢表型的鉴定
3. 代谢表型与微环境无显著相关性
实验结果表明,胶质母细胞瘤(GB)的代谢表型(糖酵解型、氧化型和混合型)与肿瘤微环境(TME)的特征无显著相关性。通过质谱成像(MSI)和空间转录组分析发现,不同代谢表型区域的能量状态(ATP/ADP、PCr/ATP比值)、氧化还原水平(AsA/DHA、GSH/GSSG、乳酸/丙酮酸比值)以及微环境特征(免疫细胞浸润、增殖标志物Ki67表达、血管密度)均无显著差异(图2d、2e)。此外,坏死区域或与血管的距离也未影响代谢表型的分布。空间转录组数据进一步证明,恶性细胞主导区域可同时存在三种代谢状态,而免疫细胞富集区多呈糖酵解表型,神经元区域则以氧化型为主(图2g-i)。关键的是,低氧标志物CAIX表达及各类微环境细胞群在不同代谢区间无差异。这些证据共同表明,GB的代谢异质性主要源于肿瘤细胞自身固有的代谢重编程,而非微环境因素驱动。
4. 代谢表型与血管分布无显著关联
通过筛选大血管(胶原蛋白I+与αSMA+标记),并将其与连续质谱成像切片进行共定位,以65微米为间隔从血管腔向外测量¹³C标记的糖酵解和三羧酸循环代谢物。结果显示:无论距离血管远近,乳酸和谷氨酸标记水平、Ki67+染色所示的增殖细胞数量、NADPH/NADP+比值(AsA:DHA比值)或NADH/NAD+比值([U-¹³C]乳酸/[U-¹³C]丙酮酸比值)均无差异。然而,随着与血管壁距离的增加,免疫细胞数量呈下降趋势。这些数据表明,GB肿瘤细胞的代谢特征不受局部血管供应的显著影响,进一步支持了代谢表型的细胞固有性,而非由血管微环境驱动的结论。
5. 原代神经球保留肿瘤代谢表型特征
实验结果表明,胶质母细胞瘤(GB)患者来源的原代神经球在体外培养条件下仍能保留其体内观察到的三种代谢表型(糖酵解型、氧化型和混合型)。通过质谱成像(MSI)分析显示,神经球的代谢特征与原始肿瘤组织高度一致,且不同代谢表型的神经球在直径大小、能量状态(ATP/ADP比值)等方面无显著差异(图3a-e)。值得注意的是,来自同一肿瘤不同区域的神经球(如GTP2 Med和GTP2 Lat)展现出与原始区域相匹配的代谢异质性(图3f,g)。此外,这些代谢表型在长期低氧(0.5% O₂)培养条件下仍保持稳定,转录组分析未发现显著变化。这些发现证实了GB代谢表型的细胞固有性和可塑性,表明其独立于肿瘤微环境的影响,为后续体外研究和药物筛选提供了可靠模型。

图3 .原代神经球模型重现GB患者的代谢表型特征
6. 神经球代谢表型在大鼠脑中得以重现
实验结果表明,体外培养的胶质母细胞瘤(GB)神经球代谢表型在异种移植到大鼠脑内后仍能稳定维持。通过质谱成像(MSI)分析显示,AT8和S2细胞形成的移植瘤表现出高糖酵解活性([U-¹³C]乳酸标记水平升高),而AT5移植瘤则呈现高氧化代谢特征([¹³C2]谷氨酸标记水平升高)(图4a,b)。这些代谢特征与原始神经球表型完全一致,且不受移植瘤中细胞增殖(Ki67)、凋亡(CC3)或血管化(CD31)程度的影响。值得注意的是,先前研究显示对放疗更敏感的S2细胞在移植后表现出比A11细胞更强的TCA循环活性(图4c,d),进一步验证了代谢表型与治疗响应的相关性。这些结果证实了GB代谢表型的细胞固有性在体内外环境中的稳定性,为基于代谢分型的个性化治疗研究提供了重要依据。

图4 . 原位移植的神经球保持其代谢特征,且这些特征与药物反应相关
7. 代谢表型在其他通路中呈现特征性差异
患者肿瘤组织切片中,氧化性区域的未标记丝氨酸、苏氨酸、谷氨酰胺及谷氨酸浓度显著升高(ANOVA,Tukey检验P<0.05);神经球模型中,未标记亮氨酸/异亮氨酸、谷氨酰胺、谷氨酸、组氨酸和苯丙氨酸浓度亦显著增高(ANOVA,Tukey检验P<0.005)。这与既往研究中氧化型GB细胞依赖脂肪酸氧化的特征相符。这些发现揭示了代谢表型与多种代谢通路之间的广泛关联,为理解GB的代谢异质性及其潜在治疗靶点提供了新的分子层面的证据。
实验结论
本研究通过高分辨率质谱成像技术,在人体胶质母细胞瘤(GB)中实现了细胞代谢物同位素标记的原位可视化分析,结合患者来源神经球培养和原位移植瘤模型,系统证实了GB中存在三种由肿瘤细胞自身决定的固有代谢表型(糖酵解型、氧化型及混合型),这些表型基本独立于肿瘤微环境(TME)的影响。
研究创新性地采用AVATAR低氧培养系统(0.5% O₂)对患者来源神经球进行长达160小时的持续低氧培养,发现其转录组特征和代谢表型保持高度稳定,这一关键实验证据直接证实了GB代谢表型的细胞自主性及其对低氧微环境的抵抗能力。值得注意的是,与肺癌等肿瘤不同,GB细胞的TCA循环活性与正常脑组织相当,且其代谢特征不受组织灌注差异的影响,其中氧化表型细胞对线粒体抑制剂和放疗表现出显著敏感性。基于超极化¹³C-MRI等先进代谢成像技术的临床转化潜力,本研究不仅为GB的分子分型提供了新的代谢标志物,更开创了个体化治疗的新范式:如针对氧化型肿瘤采用放疗联合线粒体抑制剂。AVATAR系统的成功应用,为在可控低氧条件下研究肿瘤细胞的固有代谢特性建立了标准化技术平台,对深入理解肿瘤代谢异质性具有重要方法论意义。
相关文章
更多 >

