AVATAR低氧高压培养:双重提升CAR-T细胞增殖与功能,且保持表型稳定
2025-06-16 来源:本站 点击次数:1510
目前,关于大气压力升高对细胞培养动态影响的研究较为有限。部分研究表明,在环境压力增至2.3 PSI时,牛内皮细胞数量及CHO细胞的蛋白产量有所提升,但这些效应存在细胞类型依赖性,可能促进或抑制细胞增殖。本研究创新性地采用AVATAR Foundry和AVATAR Odyssey培养系统(可精确调控氧气、二氧化碳及高压水平),系统探究了5 PSI高压与低氧条件联合对人原代T细胞培养的影响。
实验结果表明,在该培养条件下,T细胞在多种培养容器中的增殖效率显著提升,同时细胞表型始终保持稳定。尤为值得注意的是,在CD19 CAR-T与NALM6细胞共培养的杀伤实验中,特定低氧培养条件下的CD19 CAR-T细胞展现出持续的肿瘤杀伤能力,且在反复攻击肿瘤细胞时未出现耗竭现象。此外,低氧条件下培养的CAR-T细胞的GLUT1表达量显著上升,这一分子已被证实与增强抗肿瘤效力、减轻细胞耗竭以及延长存活期密切相关。
这一发现为细胞治疗产品的规模化生产提供了创新解决方案,不仅能够同时提升细胞产量和功能活性,还能确保细胞特性的稳定性,直接响应了细胞基因治疗领域对高效能、规模化生产的迫切需求。本研究不仅证实了低氧高压培养的协同增效作用,也为优化细胞治疗生产工艺提供了重要的理论与实践依据。
材料与方法
本研究采用健康供体来源的冻存原始CD3+ T细胞进行实验。复苏后的细胞使用含10%热灭活胎牛血清(HI-FBS)的RPMI培养基,并添加人源T细胞激活剂CD3/28 Dynabeads及重组人IL-2(rhIL-2)进行培养。培养条件设置为三种:常规CO2培养箱(NI)、AVATAR培养系统(AVT)15% O2+5 PSI和AVATAR培养系统(AVT)10% O2+5 PSI。
次日,使用第三代CD19-CAR慢病毒或STEAP1-CAR慢病毒对细胞进行转导,并将细胞返回各自的培养环境中继续扩增,最后进行冻存。每2-3天使用细胞计数仪进行细胞扩增与活力检测,同时利用流式细胞术分析CAR表达及细胞表型。采用两种针对NALM6-mCHERRY-Luc-Puro靶细胞的杀伤实验进行功能活性评估:
• 持续杀伤实验:将CAR阳性效应细胞与靶细胞按不同比例长期共培养。使用流式细胞术或Axion OMNI活细胞成像系统测定CAR特异性杀伤活性,参照组为未转导(UTD)对照组、单纯的NALM6靶细胞组及荧光计数微球。此实验在常规培养箱中进行。
• 反复杀伤实验:按上述方法建立共培养体系,每48-72小时取样进行流式检测并补充新鲜的NALM6靶细胞。每次补充靶细胞视为新一轮“激发”,该过程持续进行,直至效应细胞功能衰竭。数据通过NALM6细胞在时间推移中的动态变化进行呈现。
AVATAR 培养系统
临床前及 GMP 级细胞治疗生产平台
AVATAR Odyssey系统通过精确调控氧气水平和压力,能够筛选理想的环境条件,从而增强细胞治疗的效力和产量。此外,该系统还可以模拟肿瘤微环境(TME)等生理条件,为研究提供高度仿真的测试环境。在确认了理想的环境条件后,将这些条件应用于全封闭的AVATAR Foundry系统,该系统符合GMP标准,专用于细胞治疗产品的生产。这一无缝衔接确保了从研究到生产的有效性和可靠性,推动了细胞治疗领域的进步。

实验结果
1. 高压条件下扩增的CD19 CAR-T细胞显著提高细胞产量
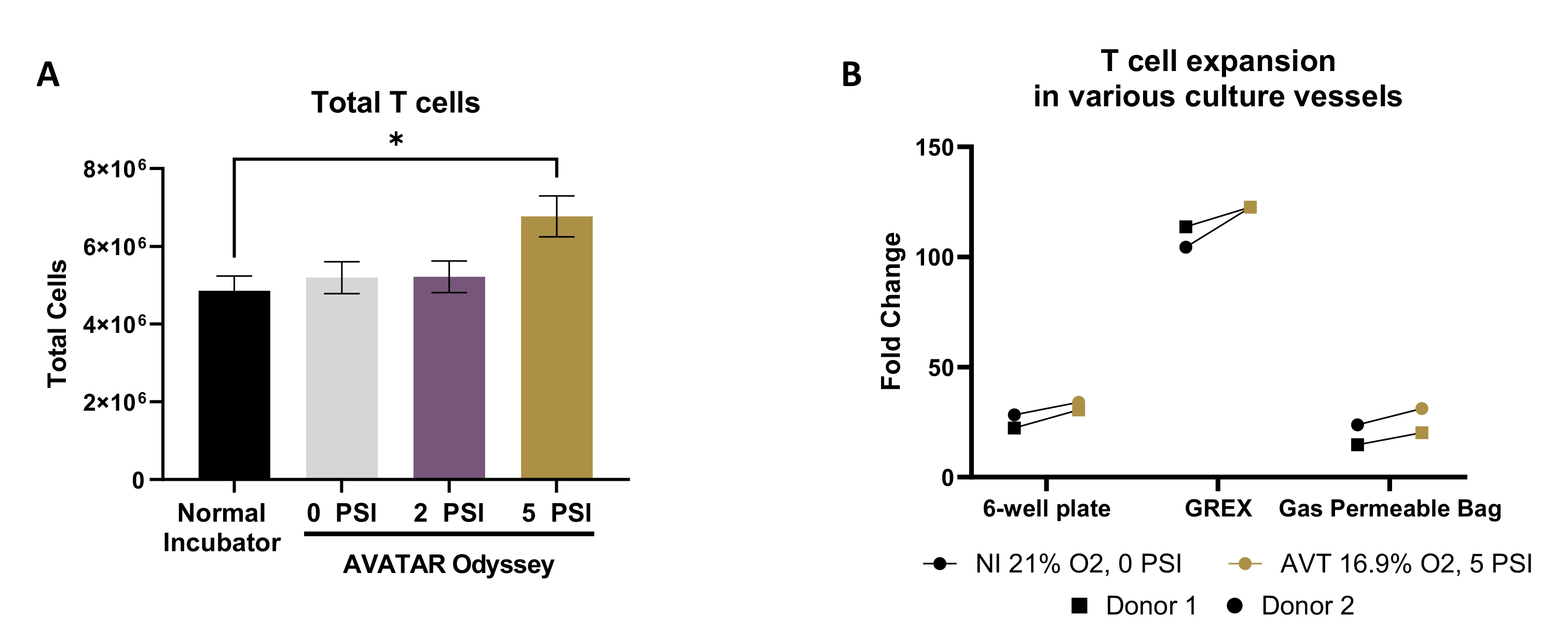
本研究对比了健康供体T细胞在常规培养箱(NI)和AVATAR Odyssey(AVT)系统中的生长情况:
A. 健康供体T细胞分别在常规培养箱(NI)和不同高压条件下的AVATAR Odyssey系统中进行扩增(12名健康供体的平均值±标准误差)。B. T细胞在不同培养容器中分别于常规培养箱或5 PSI高压条件下培养7天。
结果表明,AVT条件下的T细胞产量显著高于常规培养箱。这一发现为提高CAR-T细胞的生产效率提供了新的思路,有望在临床应用中提升治疗效果。
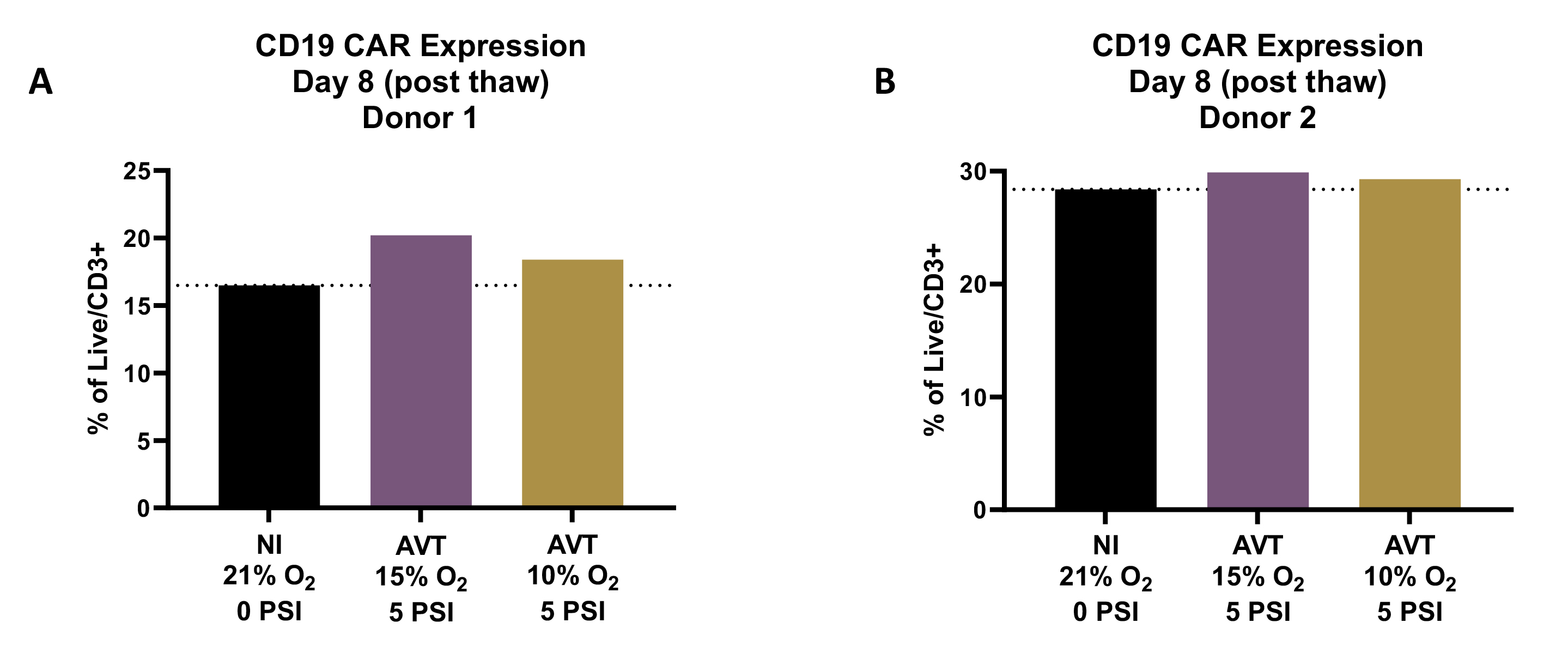
2. 低氧和高压条件下培养的T细胞转导效率较常规培养箱增强或相当
健康供体T细胞的CD19 CAR转导效率分析:细胞在激活后第1天使用MOI为3的CD19-CAR慢病毒进行转导,转导后细胞分别在常规培养箱(NI)或AVATAR Odyssey(AVT)系统的透气袋中培养8天,通过流式细胞术检测CAR表达水平。A.供体1数据,B.供体2数据。
数据显示,在AVT培养条件下,T细胞的平均转导效率与常规培养条件相比相当或有所提高。这一发现提示低氧和高压环境在T细胞转导中的潜在优势,为今后T细胞治疗的研究提供了新的思路。
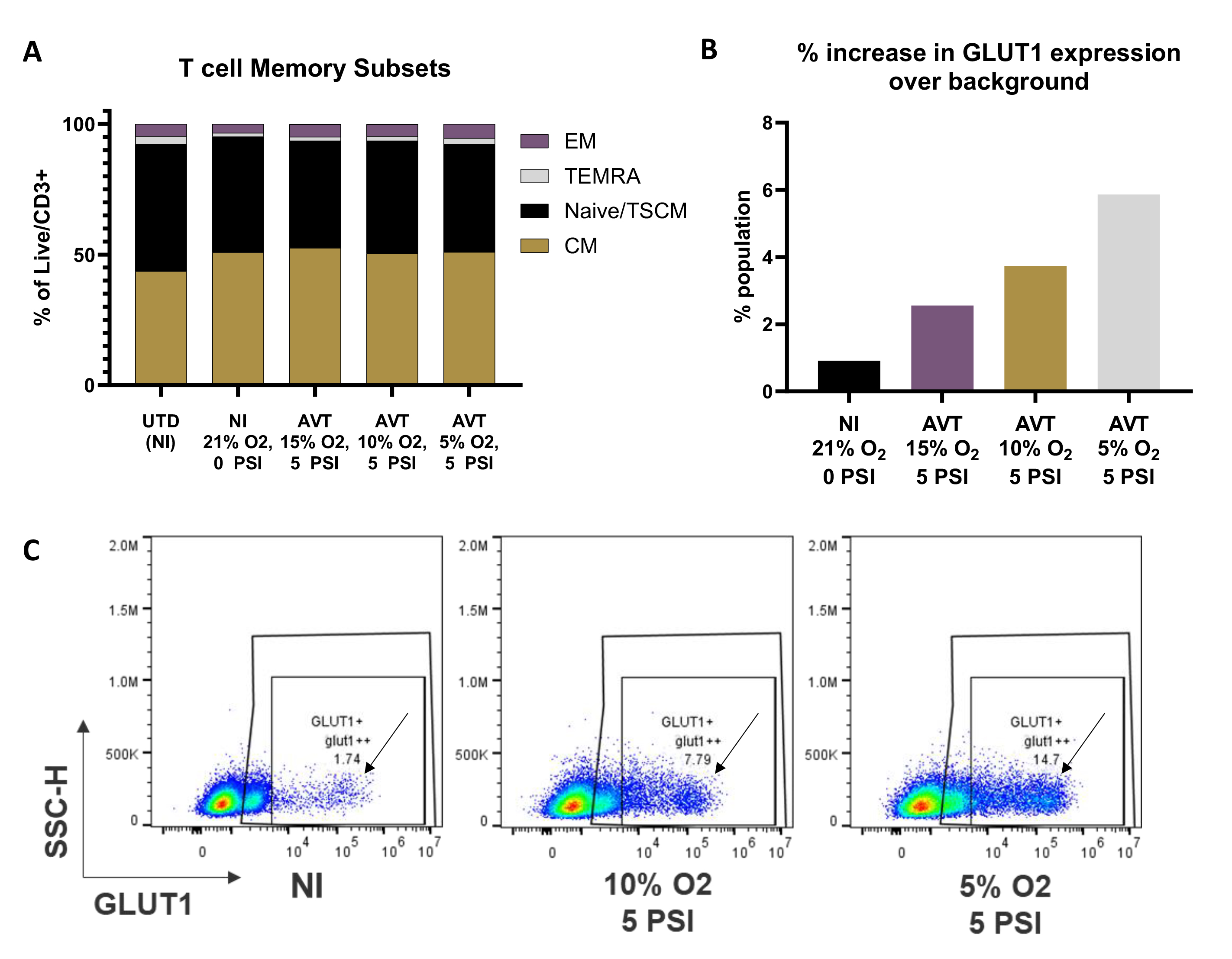
3. 低氧高压环境下培养的T细胞GLUT1表达增加而表型保持稳定
随着压力的增加,细胞表型变化不显著,而降低氧浓度则会显著影响GLUT1的表达。
A. 供体样本分析显示,CCR7+CD45RA-中央记忆T细胞和CCR7+CD45RA+初始/干细胞样记忆T细胞的比例较高,但在不同培养条件下未观察到显著差异。
B. 经STEAP1 CAR慢病毒转导的T细胞在不同低氧条件下培养8天后,可观察到随着氧浓度降低,GLUT1高表达细胞亚群的出现。
C. 另一供体样本(STEAP1 CAR-T细胞,培养袋扩增8天)结果显示,随着氧浓度的降低,高表达GLUT1细胞亚群的比例显著增加(高表达GLUT1细胞被标记为"glut1++")。图中展示了不同GLUT1表达水平细胞的代表性点阵图。
数据显示,低氧条件显著增强T细胞的GLUT1表达,而表型亚群的稳定性在不同压力条件下保持相对不变,这为研究T细胞在微环境中的适应性提供了重要依据。
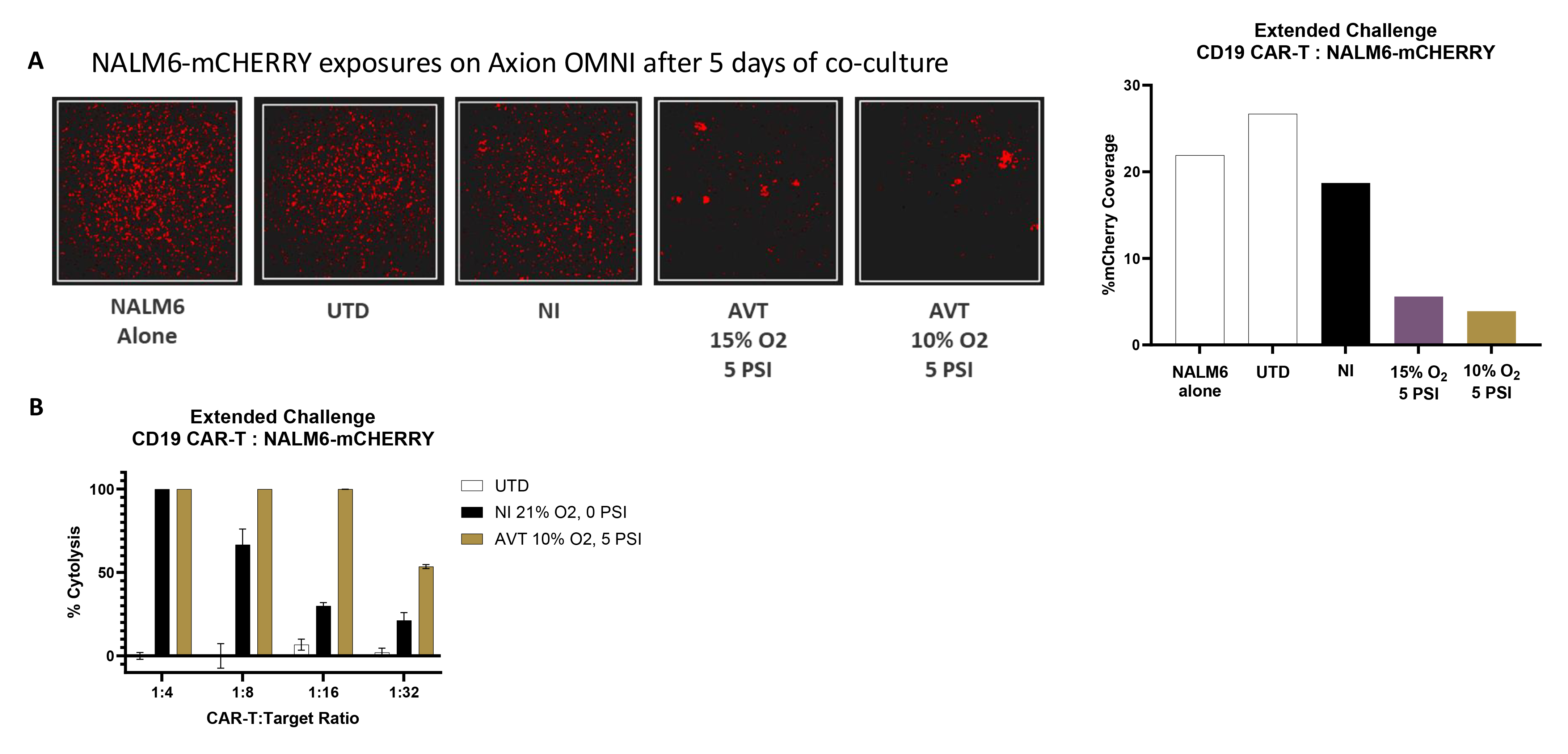
4. 低氧高压环境扩增的CD19 CAR-T细胞在持续杀伤实验中展现出更优效力
与常规培养箱中培养的细胞相比,在低氧高压条件下培养的细胞具有更高疗效:
A. 在不同条件下扩增的CD19 CAR-T细胞与表达mCHERRY荧光蛋白的NALM6肿瘤细胞置于常规培养箱的96孔板中共培养,5天后通过Axion OMNI系统成像(左图显示荧光图像,右图通过AxisVue软件定量mCHERRY覆盖率),CAR-T:NALM6=1:16。
B. CD19 CAR-T细胞与NALM6-mCHERRY细胞按不同效靶比共培养7天,使用流式细胞仪检测时加入荧光计数微球,根据存活NALM6细胞群计算杀伤率。
这些研究结果表明,在低氧高压环境中扩增的CD19 CAR-T细胞可能在持续杀伤实验中展现出更优效力,具有广阔的临床应用前景。
5. 低氧高压环境扩增的CD19 CAR-T细胞在反复杀伤实验中展现出持久杀伤活性
低氧高压培养条件下获得的CAR-T细胞在反复杀伤实验时表现出更强的持久性。供体1和2经可溶性CD3/CD28激活剂预处理1天后,用CD19-CAR慢病毒转导,随后进行7天扩增并冷冻保存。将CAR-T效应细胞与NALM6-mCHERRY靶细胞按1:2比例于48孔板中置于常规培养箱共培养。48小时后取样,在荧光计数微球存在下通过流式细胞仪检测培养体系中存活NALM6细胞浓度。补充新鲜NALM6细胞及培养基后继续共培养72小时再次取样,该流程循环进行。效应细胞共经历6轮连续攻击。
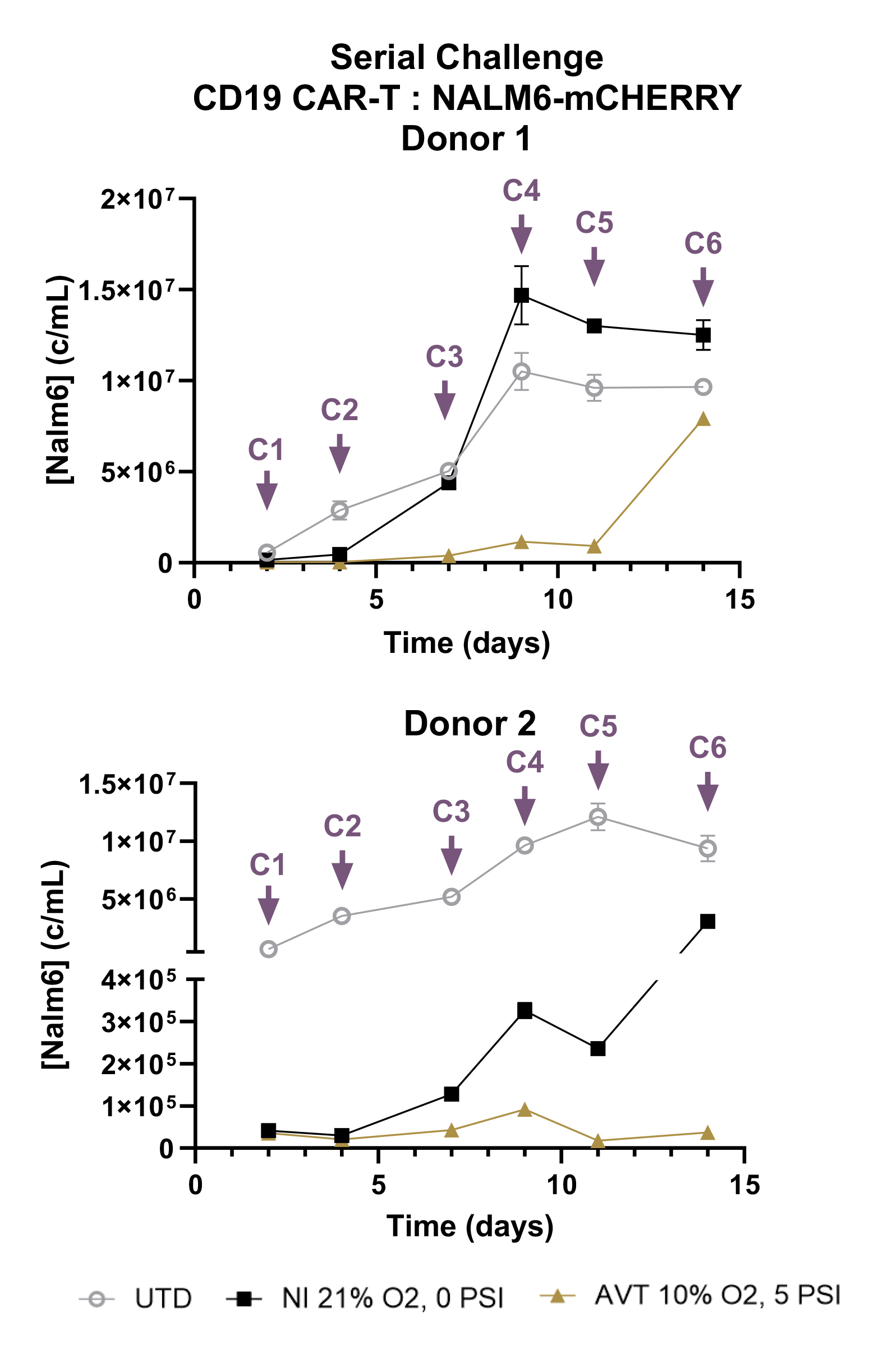
结果显示,与常规培养条件相比,低氧高压扩增组在经历多次攻击后,仍能有效维持NALM6细胞浓度的显著降低。每个数据点代表一次独立攻击实验,结果为双重复实验的平均值±标准差,C1-C6分别代表第1至第6次攻击。
未来计划
本研究的下一步计划包括体内与实体瘤建模、优化培养条件、细胞因子分析及RNA测序等多个环节。
研究表明,使用AVATAR Odyssey和AVATAR Foundry系统能够有效促进T细胞在模拟实体瘤内部环境条件下的适应性培养。这种方法通过在更接近生理环境的条件下培养肿瘤细胞,并对T细胞产品进行功能分析,预示着在动物模型及临床应用中有可能获得更具预测性的结果。这些经过适应性培养的T细胞能经历代谢转变,从而增强它们在低氧环境(氧气浓度较低)中的生存能力。
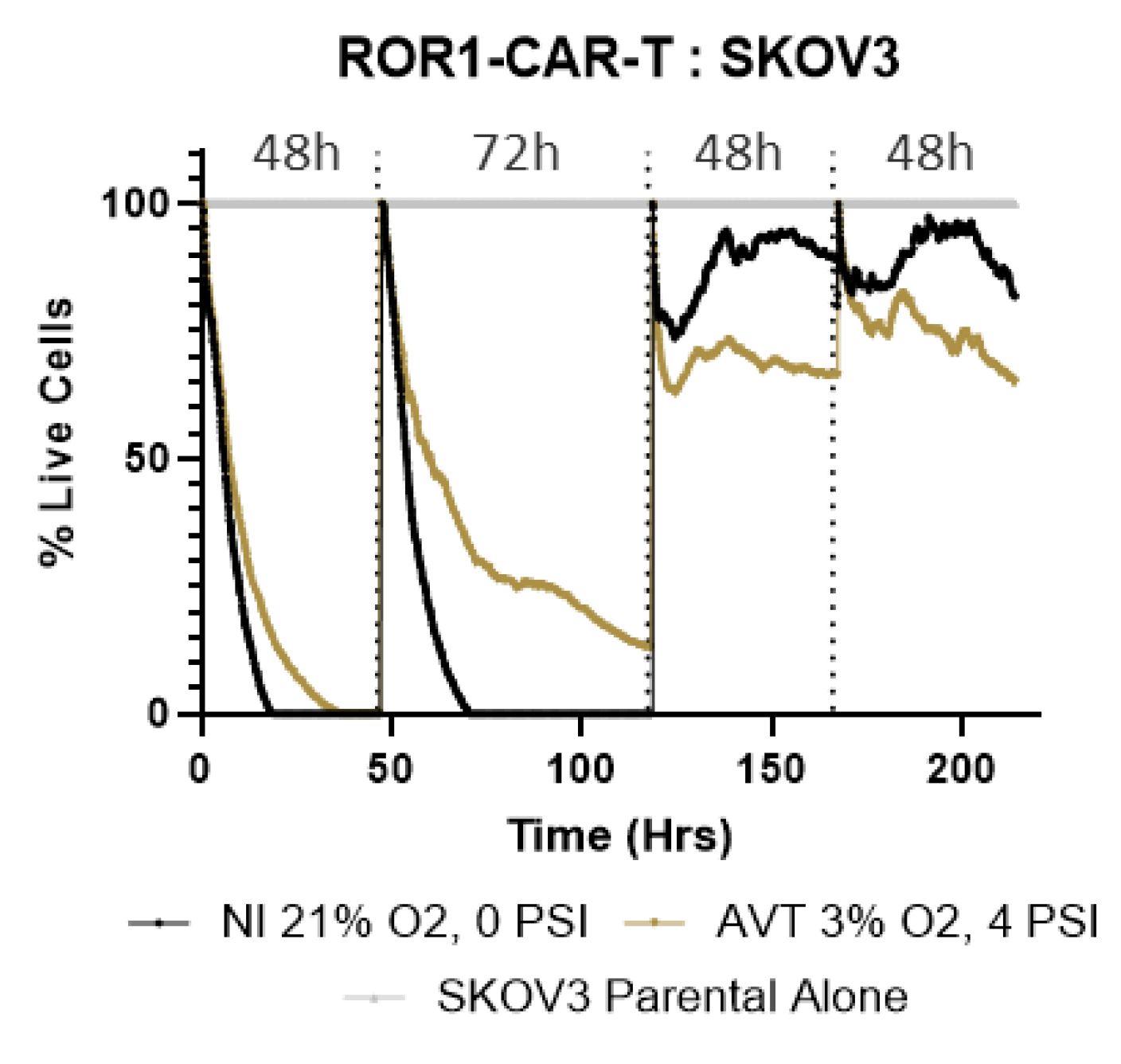
在本实验中,T细胞通过转导靶向卵巢癌标志物(ROR1)的嵌合抗原受体(CAR)进行改造,并在3% O2和4 PSI压力条件下扩增。与此同时,前列腺癌细胞系则在1% O2和2 PSI压力的肿瘤微环境中进行适应性培养。细胞毒性试验中,CAR-T细胞需在模拟肿瘤微环境下对抗肿瘤细胞,并每48-72小时接受新一轮的肿瘤细胞攻击。实验结果显示,在低氧环境中培养的T细胞在随后的攻击中展现出更强的肿瘤生长抑制能力。这一发现表明,低氧暴露或许能使T细胞更好地适应实体瘤的恶劣微环境,从而提升其治疗效果。
总结与讨论
本研究通过对AVATAR系统中低氧与高压条件下T细胞的培养,得出以下重要结论:
1. 在低氧与高压环境下,T细胞的增殖能力得到了适度提升,且随着压力的增加,细胞扩增的促进作用更为显著。这表明,培养环境的调整能够有效影响T细胞的增殖特性。
2. 受低氧高压培养条件的影响,T细胞转导效率表现出个体差异性。部分供体细胞的转导效率得到了提升,而另一些则未见显著变化,提示需进一步探讨供体细胞特性的影响因素。
3. 常见的T细胞亚群表面标志物,这说明低氧高压条件对细胞的基本表型并无明显干扰。
4. 在低氧条件下培养的CAR-T细胞中,观察到GLUT1高表达的细胞亚群,其表达水平显著高于常规活化扩增的典型值。根据文献(Shi 2024)的报道,GLUT1的过表达与增强的抗肿瘤效能及代谢适应性相关,提示该现象可能与细胞改善的功能状态密切关联。
5. 在生理相关条件下培养的CAR-T细胞,在延长观察周期及持续攻击实验中,展现出了更强的杀伤效力及持续的细胞毒性。这为CAR-T细胞治疗的临床应用提供了有利依据,强调培养条件优化的重要性。
综上所述,通过对培养条件的调整,T细胞的增殖能力与功能特性均得到了显著改善,提供了进一步优化细胞治疗策略的潜力。
实验结果表明,在该培养条件下,T细胞在多种培养容器中的增殖效率显著提升,同时细胞表型始终保持稳定。尤为值得注意的是,在CD19 CAR-T与NALM6细胞共培养的杀伤实验中,特定低氧培养条件下的CD19 CAR-T细胞展现出持续的肿瘤杀伤能力,且在反复攻击肿瘤细胞时未出现耗竭现象。此外,低氧条件下培养的CAR-T细胞的GLUT1表达量显著上升,这一分子已被证实与增强抗肿瘤效力、减轻细胞耗竭以及延长存活期密切相关。
这一发现为细胞治疗产品的规模化生产提供了创新解决方案,不仅能够同时提升细胞产量和功能活性,还能确保细胞特性的稳定性,直接响应了细胞基因治疗领域对高效能、规模化生产的迫切需求。本研究不仅证实了低氧高压培养的协同增效作用,也为优化细胞治疗生产工艺提供了重要的理论与实践依据。
材料与方法
本研究采用健康供体来源的冻存原始CD3+ T细胞进行实验。复苏后的细胞使用含10%热灭活胎牛血清(HI-FBS)的RPMI培养基,并添加人源T细胞激活剂CD3/28 Dynabeads及重组人IL-2(rhIL-2)进行培养。培养条件设置为三种:常规CO2培养箱(NI)、AVATAR培养系统(AVT)15% O2+5 PSI和AVATAR培养系统(AVT)10% O2+5 PSI。
次日,使用第三代CD19-CAR慢病毒或STEAP1-CAR慢病毒对细胞进行转导,并将细胞返回各自的培养环境中继续扩增,最后进行冻存。每2-3天使用细胞计数仪进行细胞扩增与活力检测,同时利用流式细胞术分析CAR表达及细胞表型。采用两种针对NALM6-mCHERRY-Luc-Puro靶细胞的杀伤实验进行功能活性评估:
• 持续杀伤实验:将CAR阳性效应细胞与靶细胞按不同比例长期共培养。使用流式细胞术或Axion OMNI活细胞成像系统测定CAR特异性杀伤活性,参照组为未转导(UTD)对照组、单纯的NALM6靶细胞组及荧光计数微球。此实验在常规培养箱中进行。
• 反复杀伤实验:按上述方法建立共培养体系,每48-72小时取样进行流式检测并补充新鲜的NALM6靶细胞。每次补充靶细胞视为新一轮“激发”,该过程持续进行,直至效应细胞功能衰竭。数据通过NALM6细胞在时间推移中的动态变化进行呈现。
AVATAR 培养系统
临床前及 GMP 级细胞治疗生产平台
AVATAR Odyssey系统通过精确调控氧气水平和压力,能够筛选理想的环境条件,从而增强细胞治疗的效力和产量。此外,该系统还可以模拟肿瘤微环境(TME)等生理条件,为研究提供高度仿真的测试环境。在确认了理想的环境条件后,将这些条件应用于全封闭的AVATAR Foundry系统,该系统符合GMP标准,专用于细胞治疗产品的生产。这一无缝衔接确保了从研究到生产的有效性和可靠性,推动了细胞治疗领域的进步。

实验结果
1. 高压条件下扩增的CD19 CAR-T细胞显著提高细胞产量
本研究对比了健康供体T细胞在常规培养箱(NI)和AVATAR Odyssey(AVT)系统中的生长情况:
A. 健康供体T细胞分别在常规培养箱(NI)和不同高压条件下的AVATAR Odyssey系统中进行扩增(12名健康供体的平均值±标准误差)。B. T细胞在不同培养容器中分别于常规培养箱或5 PSI高压条件下培养7天。
结果表明,AVT条件下的T细胞产量显著高于常规培养箱。这一发现为提高CAR-T细胞的生产效率提供了新的思路,有望在临床应用中提升治疗效果。

2. 低氧和高压条件下培养的T细胞转导效率较常规培养箱增强或相当
健康供体T细胞的CD19 CAR转导效率分析:细胞在激活后第1天使用MOI为3的CD19-CAR慢病毒进行转导,转导后细胞分别在常规培养箱(NI)或AVATAR Odyssey(AVT)系统的透气袋中培养8天,通过流式细胞术检测CAR表达水平。A.供体1数据,B.供体2数据。
数据显示,在AVT培养条件下,T细胞的平均转导效率与常规培养条件相比相当或有所提高。这一发现提示低氧和高压环境在T细胞转导中的潜在优势,为今后T细胞治疗的研究提供了新的思路。

3. 低氧高压环境下培养的T细胞GLUT1表达增加而表型保持稳定
随着压力的增加,细胞表型变化不显著,而降低氧浓度则会显著影响GLUT1的表达。
A. 供体样本分析显示,CCR7+CD45RA-中央记忆T细胞和CCR7+CD45RA+初始/干细胞样记忆T细胞的比例较高,但在不同培养条件下未观察到显著差异。
B. 经STEAP1 CAR慢病毒转导的T细胞在不同低氧条件下培养8天后,可观察到随着氧浓度降低,GLUT1高表达细胞亚群的出现。
C. 另一供体样本(STEAP1 CAR-T细胞,培养袋扩增8天)结果显示,随着氧浓度的降低,高表达GLUT1细胞亚群的比例显著增加(高表达GLUT1细胞被标记为"glut1++")。图中展示了不同GLUT1表达水平细胞的代表性点阵图。
数据显示,低氧条件显著增强T细胞的GLUT1表达,而表型亚群的稳定性在不同压力条件下保持相对不变,这为研究T细胞在微环境中的适应性提供了重要依据。

4. 低氧高压环境扩增的CD19 CAR-T细胞在持续杀伤实验中展现出更优效力
与常规培养箱中培养的细胞相比,在低氧高压条件下培养的细胞具有更高疗效:
A. 在不同条件下扩增的CD19 CAR-T细胞与表达mCHERRY荧光蛋白的NALM6肿瘤细胞置于常规培养箱的96孔板中共培养,5天后通过Axion OMNI系统成像(左图显示荧光图像,右图通过AxisVue软件定量mCHERRY覆盖率),CAR-T:NALM6=1:16。
B. CD19 CAR-T细胞与NALM6-mCHERRY细胞按不同效靶比共培养7天,使用流式细胞仪检测时加入荧光计数微球,根据存活NALM6细胞群计算杀伤率。
这些研究结果表明,在低氧高压环境中扩增的CD19 CAR-T细胞可能在持续杀伤实验中展现出更优效力,具有广阔的临床应用前景。

5. 低氧高压环境扩增的CD19 CAR-T细胞在反复杀伤实验中展现出持久杀伤活性
低氧高压培养条件下获得的CAR-T细胞在反复杀伤实验时表现出更强的持久性。供体1和2经可溶性CD3/CD28激活剂预处理1天后,用CD19-CAR慢病毒转导,随后进行7天扩增并冷冻保存。将CAR-T效应细胞与NALM6-mCHERRY靶细胞按1:2比例于48孔板中置于常规培养箱共培养。48小时后取样,在荧光计数微球存在下通过流式细胞仪检测培养体系中存活NALM6细胞浓度。补充新鲜NALM6细胞及培养基后继续共培养72小时再次取样,该流程循环进行。效应细胞共经历6轮连续攻击。

结果显示,与常规培养条件相比,低氧高压扩增组在经历多次攻击后,仍能有效维持NALM6细胞浓度的显著降低。每个数据点代表一次独立攻击实验,结果为双重复实验的平均值±标准差,C1-C6分别代表第1至第6次攻击。
未来计划
本研究的下一步计划包括体内与实体瘤建模、优化培养条件、细胞因子分析及RNA测序等多个环节。
研究表明,使用AVATAR Odyssey和AVATAR Foundry系统能够有效促进T细胞在模拟实体瘤内部环境条件下的适应性培养。这种方法通过在更接近生理环境的条件下培养肿瘤细胞,并对T细胞产品进行功能分析,预示着在动物模型及临床应用中有可能获得更具预测性的结果。这些经过适应性培养的T细胞能经历代谢转变,从而增强它们在低氧环境(氧气浓度较低)中的生存能力。

在本实验中,T细胞通过转导靶向卵巢癌标志物(ROR1)的嵌合抗原受体(CAR)进行改造,并在3% O2和4 PSI压力条件下扩增。与此同时,前列腺癌细胞系则在1% O2和2 PSI压力的肿瘤微环境中进行适应性培养。细胞毒性试验中,CAR-T细胞需在模拟肿瘤微环境下对抗肿瘤细胞,并每48-72小时接受新一轮的肿瘤细胞攻击。实验结果显示,在低氧环境中培养的T细胞在随后的攻击中展现出更强的肿瘤生长抑制能力。这一发现表明,低氧暴露或许能使T细胞更好地适应实体瘤的恶劣微环境,从而提升其治疗效果。
总结与讨论
本研究通过对AVATAR系统中低氧与高压条件下T细胞的培养,得出以下重要结论:
1. 在低氧与高压环境下,T细胞的增殖能力得到了适度提升,且随着压力的增加,细胞扩增的促进作用更为显著。这表明,培养环境的调整能够有效影响T细胞的增殖特性。
2. 受低氧高压培养条件的影响,T细胞转导效率表现出个体差异性。部分供体细胞的转导效率得到了提升,而另一些则未见显著变化,提示需进一步探讨供体细胞特性的影响因素。
3. 常见的T细胞亚群表面标志物,这说明低氧高压条件对细胞的基本表型并无明显干扰。
4. 在低氧条件下培养的CAR-T细胞中,观察到GLUT1高表达的细胞亚群,其表达水平显著高于常规活化扩增的典型值。根据文献(Shi 2024)的报道,GLUT1的过表达与增强的抗肿瘤效能及代谢适应性相关,提示该现象可能与细胞改善的功能状态密切关联。
5. 在生理相关条件下培养的CAR-T细胞,在延长观察周期及持续攻击实验中,展现出了更强的杀伤效力及持续的细胞毒性。这为CAR-T细胞治疗的临床应用提供了有利依据,强调培养条件优化的重要性。
综上所述,通过对培养条件的调整,T细胞的增殖能力与功能特性均得到了显著改善,提供了进一步优化细胞治疗策略的潜力。
相关文章
更多 >

