胰腺癌与正常组织非经典共享新抗原表位的对比研究
2025-04-10 来源:本站 点击次数:317胰腺导管腺癌(PDAC)是美国癌症死亡的第三大原因,为PDAC患者寻求新颖有效的治疗方法是一个首要问题。由于PDAC肿瘤微环境中缺乏效应T细胞,PDAC的免疫疗法受到阻碍。鉴定免疫原性肿瘤相关抗原(TAA)和肿瘤特异性抗原(TSA)能够克服PDAC对免疫疗法耐药性,从而开发个性化的癌症疫苗和T细胞疗法。与TAA相比,TSA新抗原因其在肿瘤组织特异性表达、在正常组织中的缺失以及在建立中心耐受的髓质胸腺上皮细胞(mTEC)中缺乏表达而提高的免疫原性,具有更好的治疗前景。在新抗原表位预测的方法选择中,质谱法(MS)相比于外显子测序(WES),能够检测到基因突变外的多种新抗原,如翻译后修饰、有缺陷的核糖体产物(DRiP)、蛋白酶体剪接和其他非基因组改变。

2025年,来自约翰斯·霍普金斯大学医学院的团队在CLINICAL CANCER RESEARCH发表了题为“Comparison of Shared Class I HLA-Bound Noncanonical Neoepitopes between Normal and Neoplastic Tissues of Pancreatic Adenocarcinoma”的文章。在本研究中,作者采用MS分析方法来比较同一患者的PDAC组织及其相应正常组织的免疫肽组,鉴定了来源于典型蛋白的单氨基酸替代的HLA I型肽段,这些肽段氨基酸改变不是由基因组突变引起的,最有可能是由涉及tRNA氨基酸误酰化的翻译错误引起的,并且肽段在多个患者间共享,可能成为非典型的共享新抗原。研究结果为开发更安全、更有效的PDAC新抗原治疗方法铺平了道路。
实验结果:1、PDAC肿瘤组织中HLA-I型突变肽段鉴定
为了了解天然HLA I类限制性T细胞表位是否可以携带氨基酸突变,使用之前开发的基于质谱的技术从四个人类PDAC组织样本中建立了新的HLA I类免疫肽组。将肽长度缩小到8到11个氨基酸,我们分别从PDAC#1、2、3和4中鉴定出2358、1015、1040和1067条独特的肽(图1A)。其中,分别有631条(25.68%)、283条(27.88%)、311条(29.90%)和278条(25.65%)肽携带单个氨基酸突变(图1A)。根据WES,通过将这些肽序列突变与体细胞错义突变进行比较,发现没有一种突变是由体细胞突变引起的,这表明产生这些肽段的氨基酸突变涉及其他机制。经过亲和力预测、人类蛋白图谱分析、T2结合实验,筛选得到3条突变肽段:PTPRZ1S1102K、CHD9A2174R、PSMB5K66V。通过荧光标记实验进一步预测免疫原性,其中PTPRZ1S1102K能够引发强烈的免疫原性应答。
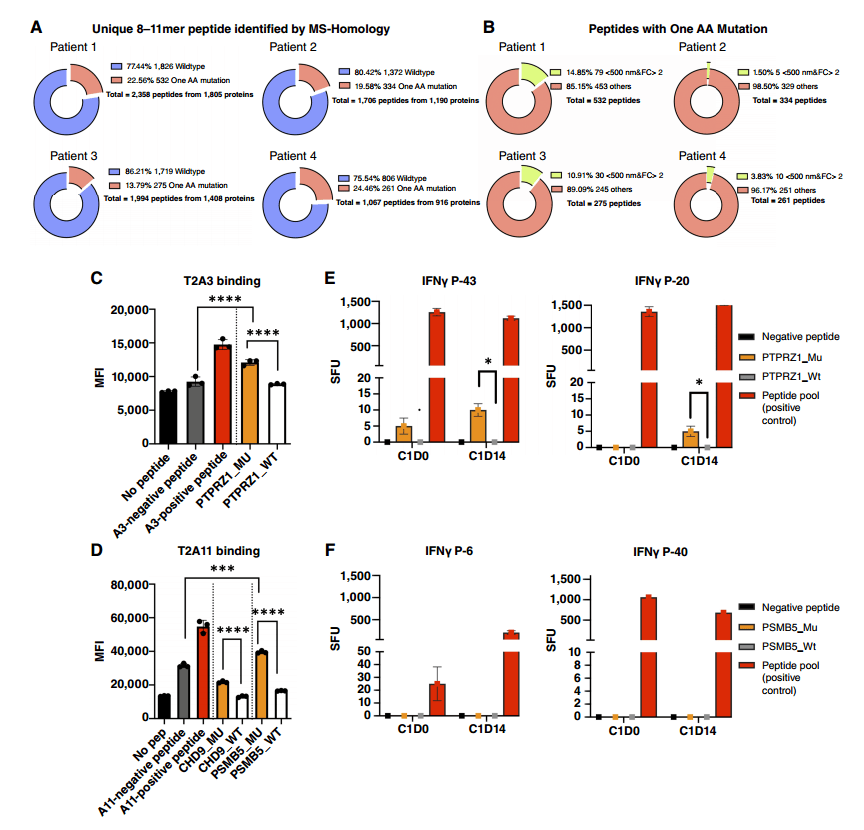 图1.从患者PDAC肿瘤样本中鉴定具有单氨基酸突变的免疫原性HLA I型肽段
图1.从患者PDAC肿瘤样本中鉴定具有单氨基酸突变的免疫原性HLA I型肽段
2、同一患者PDAC肿瘤和正常组织中HLA I型突变肽段鉴定
作者提取并比较了15名患者的16对PDAC肿瘤和正常组织的免疫肽组,其中9例为原发性肿瘤,与正常胰腺配对;七对是转移性肿瘤(两对来自肺部,五对来自肝脏)。从正常组织中的7885个独特源蛋白中鉴定出10822条8-11mer肽,从肿瘤组织中的5930个独特源蛋白中鉴定出8094条8-11mer肽(图2C)。从正常组织中的3881个独特源蛋白中鉴定出4151条8-11mer突变肽,从肿瘤组织中的3473个独特源蛋白质中鉴定出3669条8-11mer突变肽(图2D)。
 图2.从患者PDAC肿瘤和正常组织中鉴定HLA I型肽段
图2.从患者PDAC肿瘤和正常组织中鉴定HLA I型肽段
3、PDAC肿瘤特异性突变肽在多个患者中共享
作者比较了16对样本肿瘤和正常组织的免疫肽组,发现65.3%的野生型肽段和92.5%的突变肽段是肿瘤组织特有的,并且分析表明野生型和突变型肽段在肿瘤组织中更为丰富。
随后,作者比较了原发性PDAC或转移性PDAC中的肿瘤特异性免疫肽组,以鉴定肿瘤共享抗原。在原发性PDAC标本中,3个或多个PDAC之间共享了6条突变肽。9名患者共享1条突变肽(ETALVELVK;白蛋白E550Q)。然而,由于该蛋白质普遍表达,治疗靶点价值有限,未进一步研究。在转移性PDAC标本中,2条突变肽段在3个或多个PDAC之间共享。
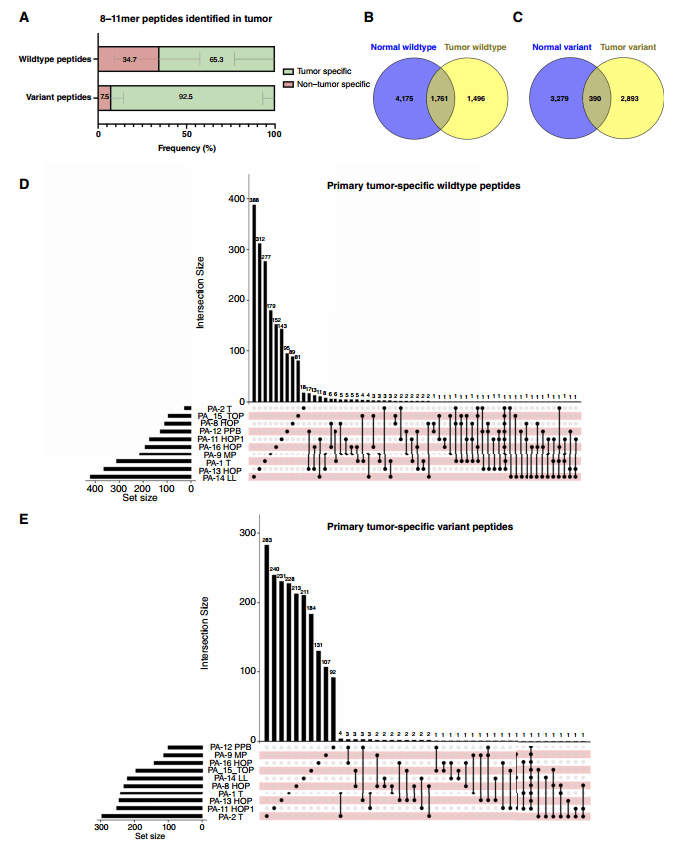 图3. 肿瘤特异性HLA I型野生肽段和突变肽段
图3. 肿瘤特异性HLA I型野生肽段和突变肽段
4、HLA I型突变肽段中的氨基酸替代模式
作者总结了正常或肿瘤组织特异性突变肽段常见氨基酸替代的前10名,其中,Q-E(正常组织20.44%;肿瘤组织24.59%)、N-D(正常组织23.56%;肿瘤组织19.89%)和V-L(正常组织11.33%;肿瘤组织16.85%)是肿瘤和正常组织特异性突变肽段最常见的三种氨基酸替代(图4A和B)。尽管肿瘤和正常组织特异性突变肽段的前3名AA替代是相同的,但是有几种氨基酸替代形式是仅在肿瘤组织中出现的(A-P、R-K、L-A、P-K)(图4B)。
那么肿瘤特异性AA替代是否会影响突变肽的免疫原性。实验结果表明41个正常组织特异性AA突变和45个肿瘤特异性AA突变能增加与HLA的亲和力,肿瘤组织中这些肽段可能有更高的免疫原性,应作为免疫治疗靶点进行进一步研究。有趣的是,一些AA替代显著降低了肽段和HLA的结合亲和力,这些低亲和力的肽段可能会导致免疫逃逸。
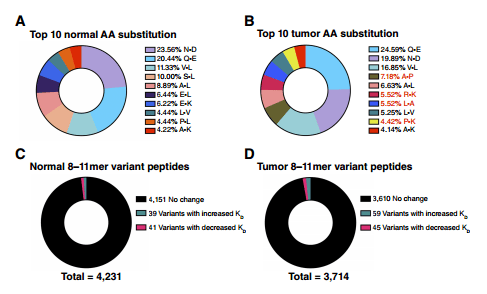 图4.正常和肿瘤特异性肽段氨基酸替代模式
图4.正常和肿瘤特异性肽段氨基酸替代模式
5、突变肽段与HLA结合亲和力改变的结构基础
为了了解突变肽段与HLA的结合亲和力为何增加,作者对与相应HLA I类分子HLA-a*33:01复合的正常和新表位肌动蛋白肽进行了分子建模,使用AlphaFold来预测结构。野生型肌动蛋白肽的预测结合亲和力为2.8μmol/L,其突变肽段的预测结合亲和性要高得多,为0.5μmol/L。在突变肽段中,Q1的侧链酰胺氮与G2羰基的羰基形成氢键。这种新的氢键在正常肽段中是不存在的,可能是突变肽段结合亲和力增加的原因。
结论:这是第一项比较同一患者肿瘤和正常组织免疫肽的研究。鉴定的单个氨基酸突变的HLA I型免疫肽不是由基因组突变引起的,最有可能是由涉及tRNA氨基酸误酰化的翻译错误引起的。由于这些突变肽在个体患者中具有很高的肿瘤特异性,并在多个患者中共享,因此是疫苗和T细胞治疗开发的新抗原候选者。

