层析技术的四大经典方式及其分离原理、优势、适用场景和选择要点
2025-04-25 来源:博格隆微信公众号 点击次数:745在生物制药研发与生产中,层析技术作为实现高纯度分离的重要手段,被广泛应用于疫苗、抗体、重组蛋白等各类生物大分子的纯化流程。层析的核心,是“填料”——这个看似不起眼的小球体,正是构筑高效纯化工艺的关键所在。
本期推文将带你走近层析技术的四大经典方式,了解其分离原理、优势、适用场景以及选择要点,为你的工艺开发和技术理解打下基础。
凝胶过滤是一种根据生物分子的大小及形状来分离物质的层析方法。凝胶过滤介质为多孔的网状结构,生物分子越小,在介质中走过的路径越长,出峰越靠后。选择凝胶过滤介质关键在于选择合适的分离范围,其次要考虑介质的机械性能和可放大性。
凝胶过滤层析术语
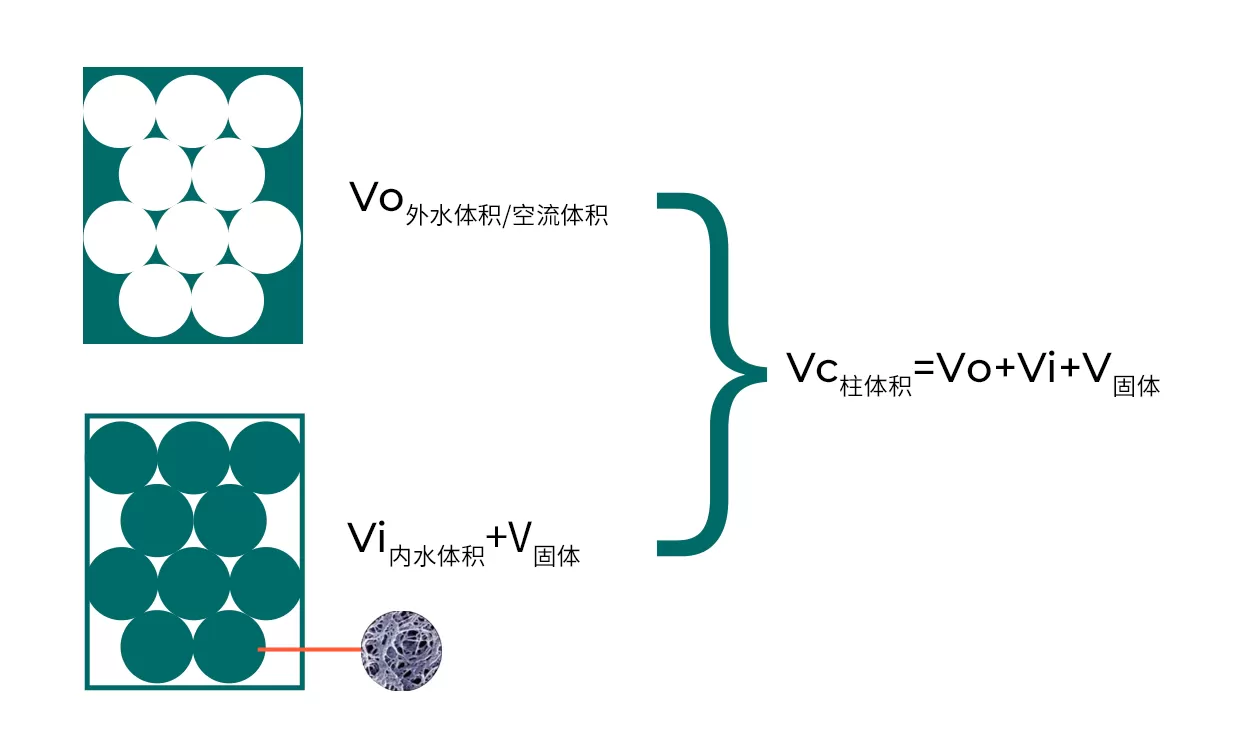
Fig.1 凝胶层析术语
大分子首先离开柱子,紧接着是中分子,最后是小分子。全部分离过程需要一个全柱体积的缓冲液通过凝胶过滤柱料。
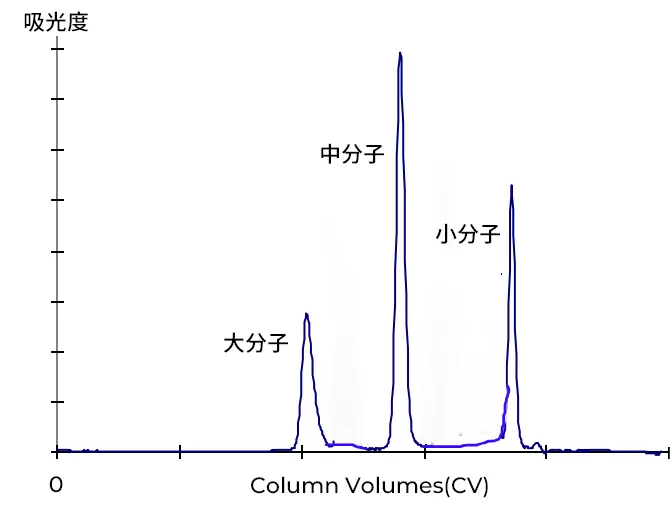
Fig.2 凝胶层析过程层析图谱
缓冲液:Tris-HCl(pH7~8)、磷酸盐缓冲液(pH6~7.5),低浓度NaCl(如150mM减少吸附)。
不同材质基架特点
• Bestdex:交联的葡聚糖,常用于分子量差异极大的组群物质快速分离,如脱盐、缓冲液置换。
• Bestarose:交联的琼脂糖,中等压力下的高流速可提供良好的分辨率和速度,适用于工业规模的大分子纯化。
• Chromdex:高度交联的琼脂糖和葡聚糖,分辨率高、硬度大,是精细纯化阶段的良好选择。
填料选择要点
每种介质的孔径都有一定的范围,选择凝胶过滤介质的关键在于选择合适的分离范围,其次要考虑介质的机械性能和可放大性。
• 组群分离(缓冲液置换):可以从一组较大的分子中去除小分子,或者快速、简单地进行缓冲液置换,上样体积一般小于30%CV(Column Volume,柱体积 );
• 精细分离:去除其他层析方法没有去除的杂质、多聚体等,上样体积一般为0.5%~5%CV;
• 定性分析:分子量大小及分布的测定等。
离子交换层析是根据不同生物分子所带表面电荷性质和数量的差异来分离的一种层析技术。由于生物分子大都带有酸性基团和碱性基团,并且可以通过调节缓冲液的pH改变其带电性质和数量,生物分子与带相反电荷的阴离子交换填料或者阳离子交换填料相结合后,采用改变流动相中的离子强度或pH,让结合弱的先洗脱下来,结合强的后洗脱下来,从而达到分离纯化的目的。
蛋白质滴定曲线
每种蛋白质都有其独特的净电荷与pH的关系,可以将其显示为滴定曲线。
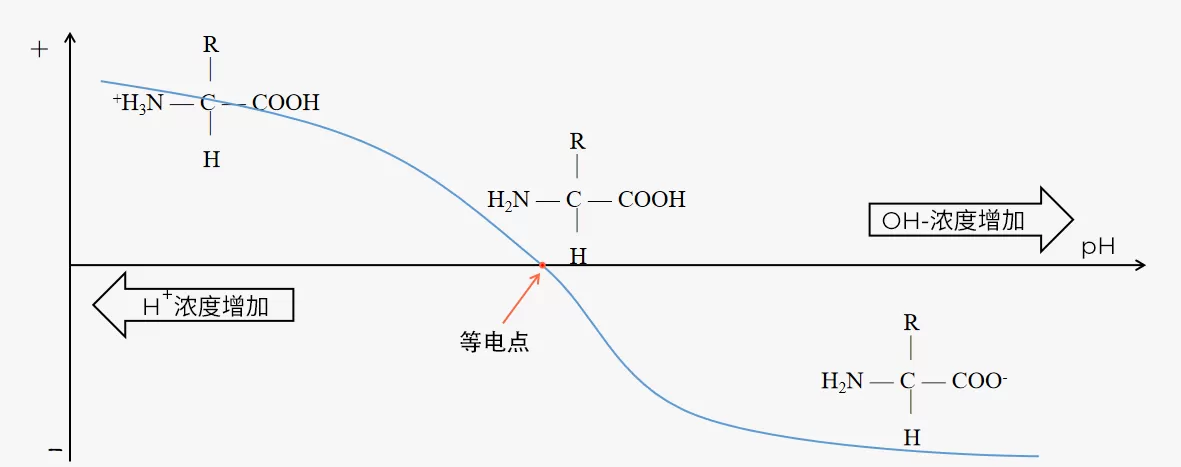
注:当分子所在溶液pH小于分子的pI(等电点)时,分子表面净电荷为正(+);当分子所在溶液pH大于分子的pI时,分子表面净电荷为负(-)。
Fig.3 蛋白滴定曲线
Table 1.离子交换层析功能基团

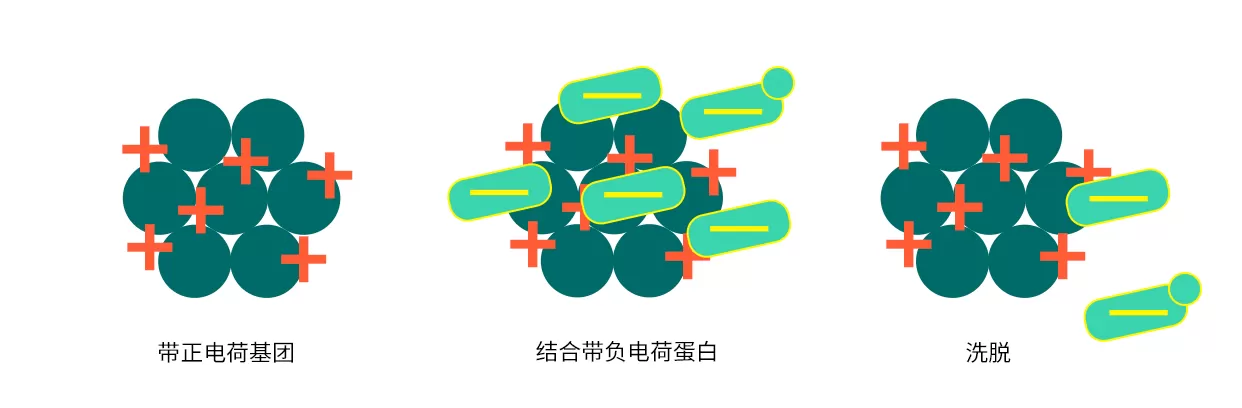
Fig.4 阴离子交换层析过程
• 载量高,适合工业放大
• 分离效率高,应用最广(约75%的纯化流程使用)
缺点
• 需优化pH和盐浓度
• 需高盐洗脱,不适用于高盐条件下不稳定的样品
典型应用
• 抗体纯化中的杂质去除(如HCP、DNA)
• 疫苗抗原的精细纯化
• 重组蛋白捕获和精细纯化等
疏水作用层析是根据蛋白表面疏水性的不同,利用蛋白和疏水层析介质疏水表面可逆的相互作用来分离蛋白。选择疏水作用层析填料的关键在于选择合适疏水强弱的配基,若蛋白质的疏水性较强就需要选择较弱的疏水填料,反之亦然。
Table 2.疏水层析功能基团

疏水作用介质疏水性强弱表

Fig.5 疏水作用介质疏水性强弱表
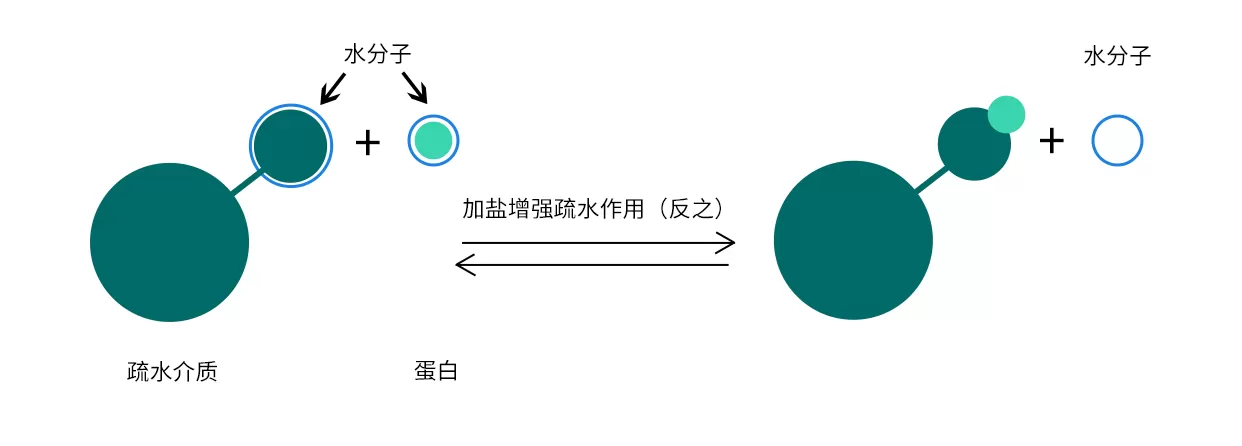
Fig.6 疏水层析过程
• 分辨率高
• “高盐吸附,低盐洗脱”的特点使其能直接与其他层析分离技术如盐析、离子交换等工艺联合使用
缺点
• 高盐易引发沉淀,需要合理控制盐浓度
• 对温度较敏感:层析开始前建议确认样品、缓冲液、柱子、层析设备都在相同的温度
• 洗脱容易拖尾
典型应用
• 适用于根据蛋白疏水性差异分离的捕获、中度纯化和精细纯化
• 抗体聚体及片段去除
• ADC纯化中的杂质去除
亲和层析:识别“特异性结合”
原理
亲和层析是一种根据生物分子之间的特异相互作用来分离物质的层析方法,如酶和底物的结合、受体和配体的结合、抗体和抗原的结合等。这类结合既是特异的,又是可逆的。通过这种可逆的结合和分离来达到蛋白纯化的目的。亲和层析具有高选择性的特点,可快速从复杂体系中捕获目的蛋白,通常一步纯化就能达到90%以上的纯度。
Table 3.亲和层析常见配基与底物


Fig.7 亲和填料结构
• 基架:多孔球形,使配基附着在基质上,具有理化惰性;
• 间隔臂:克服可能存在的空间位阻效应,改善配基与目标分子的结合;
• 亲和配基:可逆地结合特定目标分子或目标基团的分子。
优点vs缺点
• 特异性强,一步纯化后纯度可达90%以上
• 操作简便,适合作为第一步捕获工艺
缺点
• 填料单价相对其他层析填料较高
• 配基脱落风险需控制
典型应用
• 单抗/双抗生产的初步捕获
• 标签蛋白纯化
总结
层析纯化技术构建了现代生物制药工艺的“中流砥柱”,而层析填料就是这个工艺阶段的关键构件。理解层析原理,是掌握纯化技术的第一步。未来,我们还将深入解析不同类型填料的选择技巧、工艺优化思路以及真实案例分享,敬请期待!

