靶向软骨下骨骨细胞中的H19用于减轻骨关节炎软骨降解
2025-05-06 来源:本站 点击次数:126Targeting Long Noncoding RNA H19 in Subchondral Bone Osteocytes and the Alleviation of Cartilage Degradation in Osteoarthritis
KWS:LncRNA H19;Subchondral Bone Osteocytes;Cartilage Degradation;Osteoarthritis
骨关节炎(OA)是一种常见的关节疾病,其特征是关节软骨退化、滑膜炎症和骨重塑。作为关键因素之一,据报道机械负荷对软骨产生抗分解代谢和合成代谢作用,导致软骨下骨重塑异常。骨细胞(Osteocytes)占骨细胞总数的 90% 至 95%,由于它们在整个骨基质中广泛分布,并且具有复杂互连的腔隙小管网络,因此在感应和传递机械刺激方面发挥着重要作用。因此,骨细胞可以响应机械信号并分泌可溶性因子来调节破骨细胞和成骨细胞活性。
已发现几种长链非编码RNA (lncRNAs)与 OA 严重程度相关,并在体外影响 OA 关节组织来源的细胞功能。最近的证据主要表明,lncRNA H19(H19)与 OA 中的软骨和滑膜变化之间存在关联,但尚未明确关系。此外,H19 通过调节成骨细胞分化、骨再生和骨代谢参与维持骨质量。值得注意的是,H19 已被证明会影响拉伸刺激下骨髓来源的间充质基质细胞的成骨分化能力。因此,有理由假设 H19 可能能够影响 OA 的软骨下骨重塑,特别是响应于机械变化,从而可能导致软骨侵蚀和其他病理变化的进展。
基于此,香港中文大学医学院骨伤学系及香港城市大学生物医学工程系团队的一项研究为了探索靶向 H19 治疗 OA 的转化价值,开发了一种特定的基因递送系统,将 Fe3O4纳米颗粒和金属有机框架(MOF)结合形成磁性 MOFs(MMOFs),并在外部磁场存在下将抗-H19 反义寡核苷酸(ASO)转运到软骨下骨骨细胞中进行体内功能评估。研究成果发表于 Arthritis & Rheumatology期刊题为“Targeting Long Noncoding RNA H19 in Subchondral Bone Osteocytes and the Alleviation of Cartilage Degradation in Osteoarthritis”。 从接受全膝关节置换手术的 OA 患者中收集软骨下骨组织,将软骨侵蚀严重的内侧髁软骨标记为损伤,软骨相对完整的外侧髁软骨标记为未损伤以进行内部对照比较。H19 的 FISH 染色显示,损伤组软骨下骨中 H19 阳性骨细胞的比例显著高于未损伤组,损伤组软骨下骨中H19的高表达进一步证实了这一点。在 OA 小鼠模型中,与人类 OA 样本类似,发现 H19、COX-2、OPG 和 DMP1 的表达显著上调,特别是在软骨下骨区域的骨细胞中。这些结果表明,骨细胞 H19 表达上调,并与 OA 软骨下骨响应机械应力的异常结构变化有关。
从接受全膝关节置换手术的 OA 患者中收集软骨下骨组织,将软骨侵蚀严重的内侧髁软骨标记为损伤,软骨相对完整的外侧髁软骨标记为未损伤以进行内部对照比较。H19 的 FISH 染色显示,损伤组软骨下骨中 H19 阳性骨细胞的比例显著高于未损伤组,损伤组软骨下骨中H19的高表达进一步证实了这一点。在 OA 小鼠模型中,与人类 OA 样本类似,发现 H19、COX-2、OPG 和 DMP1 的表达显著上调,特别是在软骨下骨区域的骨细胞中。这些结果表明,骨细胞 H19 表达上调,并与 OA 软骨下骨响应机械应力的异常结构变化有关。
为了研究骨细胞 H19 对 OA 的影响,生成骨细胞 H19 cKO 小鼠(图1 A),其在富含骨细胞的骨组织中显著降低(图1 B)。对照H19fl/fl(Flox)小鼠在 DMM 手术后表现出退行性软骨损伤和软骨下骨硬化,而 H19 cKO 小鼠几乎不受 DMM 诱导的变化(图1 C-E)。正如预期,H19 cKO 小鼠软骨下骨骨细胞中 H19 上调的程度降低(图1 C、F),与软骨下骨细胞中 COX-2、OPG 和 DMP1 的蛋白表达显著降低有关(图1 G、H)。这些结果为骨细胞中 H19 的上调可以促进 OA 的发展和软骨下骨改变提供了支持证据。
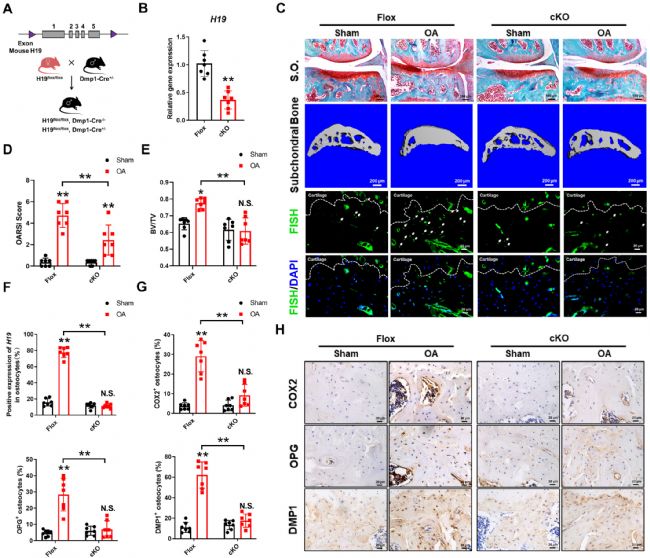 图1 H19 缺失小鼠对 OA 进展和软骨下骨重塑具有抵抗力。
图1 H19 缺失小鼠对 OA 进展和软骨下骨重塑具有抵抗力。
接下来,为了探索 OA 中 H19 介导的骨细胞机械转导的分子机制,对 MLO-Y4 细胞采用流体剪切力(FSS,2 Pa)刺激来模拟骨细胞在体内经历的机械刺激(图2 A)。FSS 的应用导致 Ptgs2、Tnfrsf11b、Opg/Rankl 比值和 Dmp1 的上调(图2 B)。值得注意的是,先前的 H19 过表达增强了 MLO-Y4 细胞对 FSS 诱导的这些机械反应基因上调的反应(图2 B)。相比之下,ASO 敲低 H19 降低了 MLO-Y4 细胞对 FSS 介导的 Ptgs2、Tnfrsf11b、Opg/Rankl 比值和 Dmp1 上调的机械反应(图2 C)。
然后进行RNA 测序分析,比较 ASO 处理和对照 MLO-Y4 细胞在 FSS 刺激下的变化,以确定潜在的潜在机制。简而言之,发现 451 个差异表达基因在 FSS 刺激后在 ASO 处理的细胞中的表达水平变化超过 1.5 倍。根据KEGG通路分类,26% 的基因与环境信息处理相关(图2 E)。值得注意的是,信号转导是最富集的一种(53.8%),基因集富集分析发现,大多数上调的基因与磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号有关(图2 D、F)。与之前的结果和 RNA 测序数据一致,PI3K/AKT 信号激活参与骨细胞介导的细胞内机械转导,AKT 和糖原合成酶激酶3(GSK3)的磷酸化在同时进行 FSS 刺激和 H19 过表达后显著增加(图2 G)。随着 H19 敲低,FSS 刺激未能激活 MLO-Y4 细胞中的 AKT/GSK3 信号通路(图2 H)。LY290042(一种 PI3K 抑制剂)的预处理阻止了 H19 对 AKT/GSK3 通路激活和机械转导靶向表达的上调(图2 I)。这些数据表明,H19 作为 PI3K/AKT/GSK3 信号通路的增强子参与骨细胞的机械反应。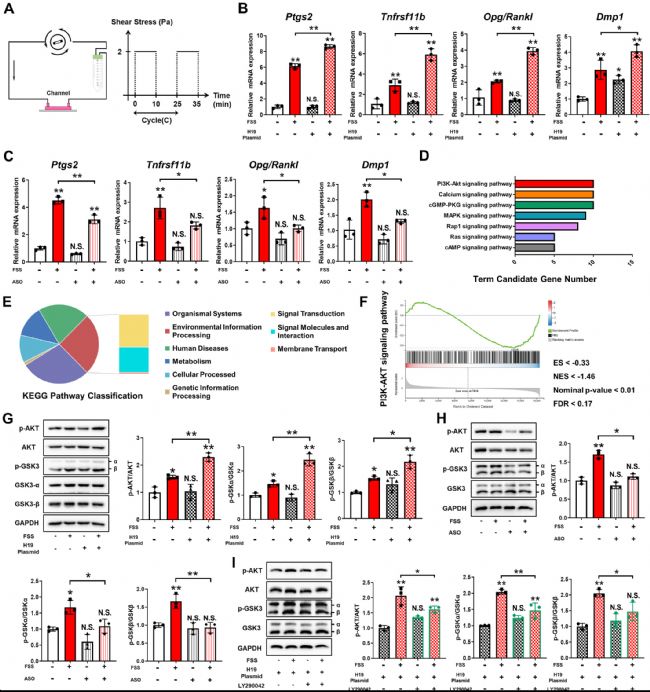 图2 H19 通过 PI3K/AKT/GSK3 信号介导的骨细胞机械反应。
图2 H19 通过 PI3K/AKT/GSK3 信号介导的骨细胞机械反应。
为了进一步研究 H19 对骨细胞机械转导的下游靶点,比较了 FSS 刺激后 ASO 处理和对照 MLO-Y4 细胞中与 PI3K/AKT/GSK3 信号通路相关的差异表达基因。在因 H19 还原而失调的候选信号转导基因中,Ppp2r1a 和 Ppp2r5d 属于蛋白质磷酸酶2A(PP2A)复合酶的亚基基因(图3 A)。H19 过表达或缺失,独立于 FSS 刺激,影响了骨细胞中 Ppp2r1a 和 Ppp2r5d 的表达(图3 B、C)。
为了阐明 PP2A 在 H19 介导的骨细胞机械转导中的作用,用 DT-601(PP2A 激活剂)或OKA(PP2A 抑制剂)在 FSS 刺激前干扰 PP2A。在 DT-601 存在下,响应 FSS 刺激和 H19 过表达的 Ptgs2、Tnfrsf11b、Opg/Rankl 比率和 Dmp1 的上调表达被消除,而 OKA 恢复了在FSS 刺激下由 H19 敲低引起的这些标记基因的下调(图3 D、E)。此外,H19 过表达激活的 AKT/GSK3 信号通路被 DT-601 抑制(图3 F)。相比之下,即使在 H19 缺乏的情况下,OKA 也促进了 AKT/GSK3 信号通路的激活(图3 G)。这些结果表明,H19 通过 AKT/GSK3 信号通路对骨细胞机械转导的调节作用可由 PP2A 介导。
为了探讨 H19 和 PP2A 之间的相互作用,测定了 H19 过表达或敲低后骨细胞中 PPP2R1A 和 PPP2R5D 的蛋白表达水平,发现 H19 过表达降低其蛋白水平,而 H19 敲低诱导其蛋白水平,表明 H19 可能负向调节 PP2A 的表达。鉴于 H19 主要存在于骨细胞的细胞核中,并且之前报道过 EZH2可被 H19 募集且可激活组蛋白H3赖氨酸27(H3K27me3)的甲基化,因此推测 EZH2 抑制可能参与 H19 介导的 PP2A 抑制。MLO-Y4 细胞通过 H19 过表达证实了 H3K27me3 的诱导,其可被 GSK126(一种选择性 EZH2 甲基转移酶抑制剂)显著抑制(图3 H)。有趣的是,EZH2 甲基转移酶抑制以浓度依赖性方式增加 PPP2R1A 和 PPP2R5D 表达。抑制 EZH2 可以抑制 H19 对 PPP2R1A 和 PPP2R5D 表达的抑制作用(图3 I)。这些研究结果表明,EZH2 通过 PP2A 相关信号通路对 H19 介导的骨细胞机械转导具有合理的调节作用。
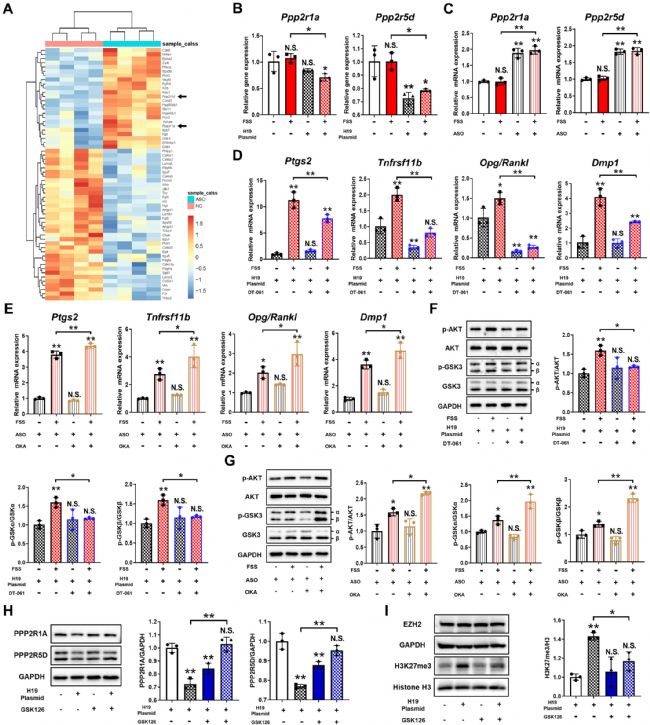 图3 通过 PP2A 调控H19 介导的骨细胞机械反应和机械转导。
图3 通过 PP2A 调控H19 介导的骨细胞机械反应和机械转导。
最后,为了通过调节软骨下骨重塑来确认 H19 作为 OA 治疗靶点的潜力,设计了一个 MMOF 纳米平台,以可控方式将抗-H19 ASO 输送到靶点,ASO 成功与 MMOF 偶联。ASO 释放曲线表明,54% 的 ASO 在前 3 小时内释放,而在释放培养基中孵育 6 小时后释放百分比达到最大值。此外,在体外补充 MMOF 后有效抑制骨细胞中 H19 表达揭示了 MMOF 将 ASO 递送到具有适当生物利用度的细胞的能力。
采用体内荧光成像验证磁场暴露下 MMOF 在膝关节中的有效积累。吲哚菁绿(ICG)标记的 MMOF 的荧光强度主要积累在暴露于外部磁场的目标膝关节中,而没有磁场暴露的对侧显示出微弱的荧光信号(图4 A、B)。注射后 6 小时磁场暴露,负载有 ASO 的 MMOF 在膝关节的有效积累得到了证实的,因为与在整个研究期间没有磁刺激的样本相比,这些样本中的荧光信号在膝关节中显著更高(图4 C)。由于 MMOF 一旦暴露在磁场中,就可以在关节中保留更长的时间,因此它们在暴露于磁场时会延迟循环到其他器官。MMOF 注射 24 小时后切除器官和膝关节的离体图像显示,肝脏和肾脏中具有显著的荧光信号,表明在后续治疗中其他器官可能存在毒性积累(图4 D)。
用 DMM 诱导的 OA 小鼠模型评估负载 ASO 的 MMOF 的治疗效果。治疗 8 周后,接受磁引导、ASO 负载 MMOF 治疗的小鼠软骨降解和软骨下骨硬化显著缓解。在没有磁场的情况下,骨关节炎OARSI评分和软骨下骨硬化有细微的改善(图4 E-G)。FISH 染色结果证实,单独负载 ASO 的 MMOF 治疗略微降低了骨细胞 H19 在软骨下骨区域的分布,而一旦与磁场结合,观察到对 H19 阳性骨细胞的显著抑制(图4 E、H)。暴露于磁场后,MMOF 注射显著降低 OA 软骨下骨细胞中 COX-2、OPG 和 DMP1 的表达。 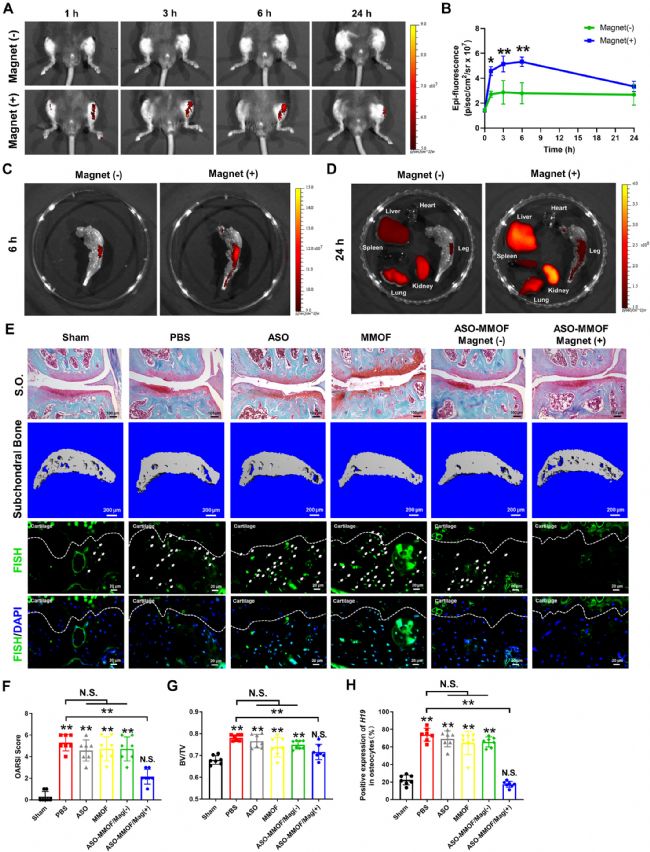 图4 MMOF 的体内治疗。
图4 MMOF 的体内治疗。
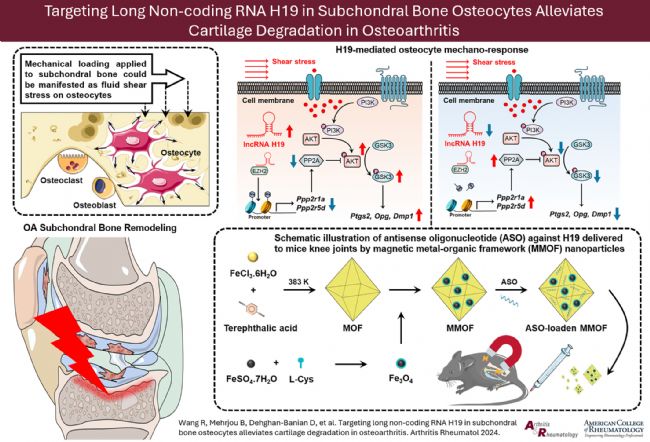 图5 图形概要
图5 图形概要
总之,这项结果提供了新的证据,表明骨细胞中 H19 表达升高可能导致异常的软骨下骨重塑和 OA 进展。H19 似乎是骨细胞对机械刺激的反应所必需的,靶向 H19 代表了 OA 治疗的一种新的有前途的方法。
参考文献:Wang R, Mehrjou B, Dehghan-Banian D, Wang BYH, Li Q, Deng S, Liu C, Zhang Z, Zhu Y, Wang H, Li D, Lu X, Cheng JCY, Ong MTY, Chan HF, Li G, Chu PK, Lee WYW. Targeting Long Noncoding RNA H19 in Subchondral Bone Osteocytes and the Alleviation of Cartilage Degradation in Osteoarthritis. Arthritis Rheumatol. 2024 Oct 31. doi: 10.1002/art.43028. Epub ahead of print. PMID: 39482250.
原文链接:https://pubmed.ncbi.nlm.nih.gov/39482250/
Online ISSN:2326-5205
Print ISSN:2326-5191
Journal Impact Factor (Clarivate):11.4
图片来源: 所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:流体剪切力系统

