三大技术如何联手揭开PAC1肿瘤免疫的神秘面纱?
2025-05-13 来源:本站 点击次数:139在医学研究前沿,肿瘤免疫治疗是备受瞩目的“主战场”。科研人员努力寻找新靶点和治疗新机制,却困难重重。肿瘤微环境抑制T细胞功能,让宿主抗肿瘤防线脆弱。T细胞功能障碍的真相不明,现有免疫治疗手段难以根治肿瘤。此时,寻找T细胞特异性抑制途径成为破局关键。而CUT&Tag、ATAC-seq和ChIP-seq这三大技术,宛如三把“神兵利器”,在这场与肿瘤的较量中发挥了关键作用。
经典文献解读
2020年1月,在《Nature Immunology》发表的题为“The phosphatase PAC1 acts as a T cell suppressor and attenuates host antitumor immunity”的研究论文,揭示了磷酸酶PAC1在肿瘤免疫中的作用及其分子机制。研究团队借助CUT&Tag、ATAC-seq和ChIP-seq等技术,证实了PAC1通过招募NuRD复合体,重塑T细胞染色质开放性,抑制下游效应基因表达,促使T细胞耗竭,削弱宿主抗肿瘤免疫力。此项研究首次将PAC1明确为肿瘤免疫治疗的潜在靶点,为开发新型肿瘤免疫疗法提供了关键理论依据。

☟ 下面我们通过一个简单的技术路线图,来看看他们是如何做的:
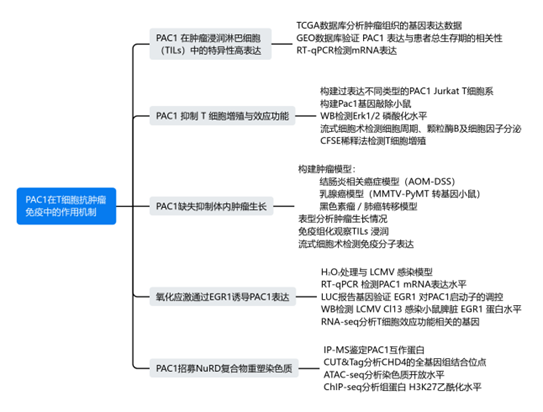
研究结果
TCGA和GEO数据库分析显示,PAC1在TILs中特异性高表达,高PAC1表达预示不良预后。为了评估PAC1在T细胞激活中的作用,在Jurkat T细胞系中过表达不同类型的PAC1以及利用PAC1基因敲除小鼠进行实验,结果表明,PAC1以不依赖磷酸酶的方式抑制T细胞的增殖和效应功能。
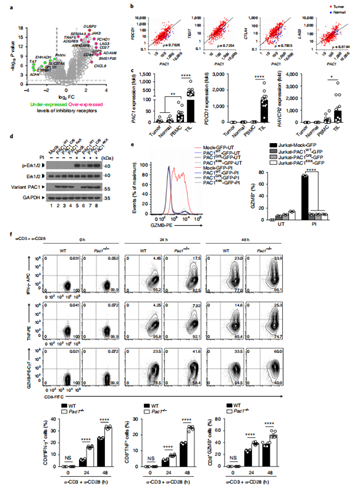
图1. PAC1在耗竭的TIL中选择性上调,抑制T细胞反应。
图E1. PAC1与癌症中的抑制性受体相关。

图E2. PAC1减轻T细胞反应。

图E1. PAC1与癌症中的抑制性受体相关。

图E2. PAC1减轻T细胞反应。
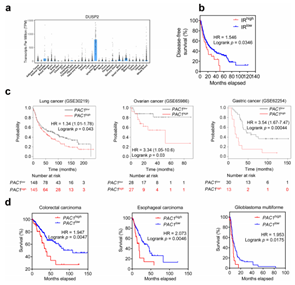
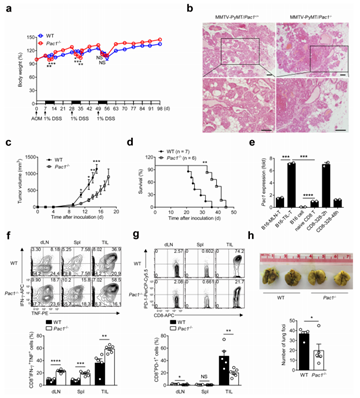
作者进一步研究了PAC1在T细胞反应中的抑制作用是否影响宿主的抗肿瘤免疫。野生型和PAC1敲除的小鼠经AOM-DSS 诱导获得结肠炎相关癌症模型,评估肿瘤数量、大小及组织学分级;杂交获得MMTV-PyMT模型,观察自发性乳腺癌生长及TILs浸润;皮下接种 B16-F10细胞获得黑色素瘤模型,检测肿瘤生长曲线及肺转移灶数量。结果显示,PAC1敲除的小鼠结肠肿瘤数量减少60%,乳腺癌体积缩小50%,肺转移灶数量降低40%;肿瘤组织中 CD3⁺ T细胞浸润增加,PD-1等抑制性受体表达降低。以上结果表明,PAC1抑制宿主对癌症的免疫反应。
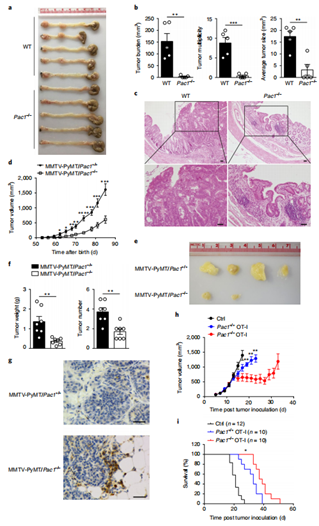
图2. PAC1通过抑制免疫反应促进肿瘤发展。
图E3. PAC1抑制宿主抗肿瘤免疫。

图E3. PAC1抑制宿主抗肿瘤免疫。
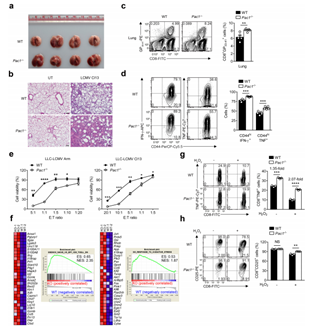
肿瘤浸润T淋巴细胞持续高表达PAC1,与T细胞激活时PAC1的短暂诱导不同。作者推测肿瘤微环境成分参与其调控,经实验发现,H2O2诱导的氧化应激能维持激活T细胞中PAC1高表达,结肠癌患者肿瘤间质液中ROS水平上升,LCMV Cl13慢性感染也会使PAC1持续上调。通过LUC报告基因实验,发现氧化应激通过激活EGR1,结合PAC1启动子特定区域维持其高表达。随后,评估了PAC1在氧化应激下T细胞反应中的作用。用LCMV Cl13感染野生型和PAC1敲除的小鼠,发现敲除的小鼠体重恢复快、病毒载量低,CD8+T细胞数量和功能更好,抑制性受体表达低。感染早期免疫反应分析发现,敲除PAC1的小鼠T细胞增殖和产生效应细胞因子能力增强,CTL溶细胞功能提升。RNA-seq分析显示,PAC1敲除的CD8+T细胞中效应功能和抗氧化应激相关基因上调。以上结果表明,炎症早期PAC1上调会抑制T细胞抗氧化和效应功能,导致T细胞耗竭。
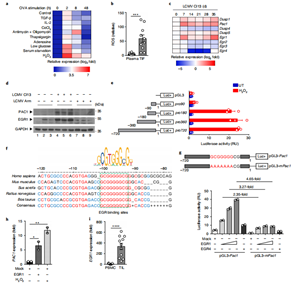
图3. 氧化应激通过诱导EGR1维持PAC1的表达。
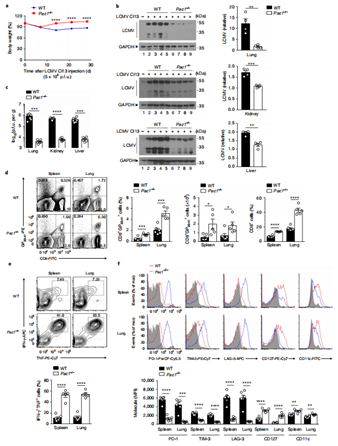
图4. PAC1对ROS介导的T细胞功能障碍至关重要。
图E4. PAC1对ROS介导的T细胞功能障碍至关重要。

图4. PAC1对ROS介导的T细胞功能障碍至关重要。

图E4. PAC1对ROS介导的T细胞功能障碍至关重要。
研究发现,PAC1在染色质上的积累对其抑制免疫功能至关重要。为进一步了解PAC1对染色质可及性的影响及其作用机制,作者首先通过IP-MS分析发现,PAC1与NuRD复合物存在关联,并且这种相互作用的发生依赖于PAC1的C端结构域,而与PAC1的催化活性并无关联。随后,在Jurkat细胞中使用HDAC抑制剂进行处理,结果显示该抑制剂能够有效缓解PAC1所介导的T细胞抑制现象。同时,借助CUT&Tag技术,研究人员发现当PAC1缺失时,会导致CHD4(作为NuRD复合物的核心组成成分)与T细胞效应功能相关基因位点之间的结合能力减弱。通过ChIP-seq分析,进一步揭示PAC1能够对组蛋白H3和H4的乙酰化过程以及H3K36的甲基化过程产生抑制作用。另外,ATAC-seq分析结果表明,敲除PAC1 会显著增加与T细胞效应功能相关基因的染色质可及性,并且这些基因还与记忆T细胞的发育过程密切相关。以上结果表明,增强的PAC1招募NuRD复合物来改变染色质的可及性。
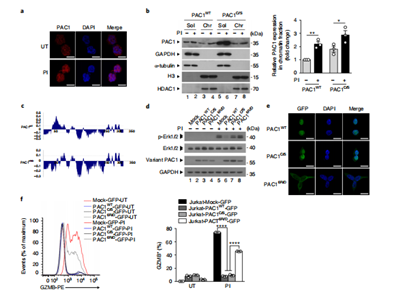
图5. PAC1在染色质上积累依赖于它的N端。
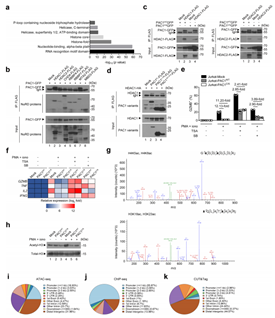
图E5. PAC1与NuRD复合物相互作用并调节染色质可及性。
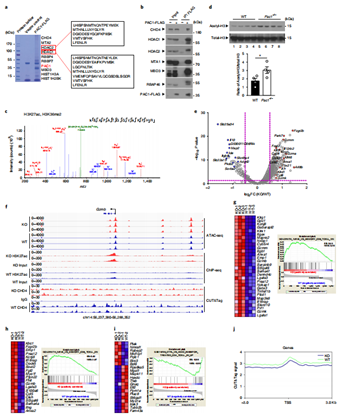
图6. PAC1在T细胞活化过程中招募NuRD复合物重塑染色质可及性。

图E5. PAC1与NuRD复合物相互作用并调节染色质可及性。

图6. PAC1在T细胞活化过程中招募NuRD复合物重塑染色质可及性。
综上所述,PAC1通过招募NuRD复合物重塑效应T细胞的表观遗传程序,抑制T细胞的细胞毒性功能。在炎症条件下,激活的T细胞通过ROS - EGR1信号通路表达高水平的PAC1,导致T细胞耗竭和宿主抗肿瘤免疫减弱。
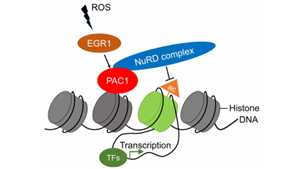
图E6. PAC1在ROS介导的肿瘤浸润淋巴细胞功能障碍中的作用模型。
相关文章
更多 >

