揭秘TH17细胞分化“开关”:ChIP-seq 技术破解基因调控密码
2025-04-27 来源:本站 点击次数:722017年发表在Nature上的“Reversing SKI–SMAD4-mediated suppression is essential for TH17 cell differentiation”的文章揭示了TGFβ的“反向调控”策略:正常情况下,SMAD4蛋白与抑制因子SKI形成复合物,像“基因刹车”一样抑制TH17核心转录因子RORγt的表达;而TGFβ通过诱导SKI降解,解除这一抑制,最终激活TH17分化程序。更重要的是,研究发现的SKI-SMAD4 信号轴,为靶向调控TH17细胞提供了全新治疗靶点。该研究通过ChIP-seq技术发现SMAD4并非广泛抑制TH17相关基因,而是特异性结合RORγt基因(Rorc)的启动子区域,直接抑制其转录。

研究背景
TH17细胞在宿主防御、炎症和自身免疫中至关重要,TGFβ与IL-6协同对TH17细胞分化起重要作用,但TGFβ促进TH17细胞分化的机制尚不清楚。
技术路线
TH17细胞在宿主防御、炎症和自身免疫中至关重要,TGFβ与IL-6协同对TH17细胞分化起重要作用,但TGFβ促进TH17细胞分化的机制尚不清楚。
技术路线

研究结果
本研究首先通过体外分化实验发现SMAD4缺失的T细胞在仅含IL-6、无TGFβ信号时,仍能高效分化为TH17细胞,而野生型T细胞无法分化;双敲除小鼠(同时缺失SMAD4和TGFβRII)的T细胞在IL-6单刺激下,TH17相关基因(Rorc、Il17a、Il23r等)表达显著上调,与SMAD4缺失的T细胞结果一致。进而又进行了体内功能验证,结果显示双敲除小鼠脾脏和淋巴结中TH17细胞比例与野生型相当,而单纯TGFβRII敲除小鼠几乎无TH17细胞。在实验性自身免疫性脑脊髓炎(EAE)模型中,双敲除的T细胞分化为致病性TH17细胞的能力与野生型一致,且小鼠表现出类似的病理损伤。诱导型SMAD4缺失实验显示,急性缺失 SMAD4可在无TGFβ受体信号时促进TH17分化,证实SMAD4是抑制TH17分化的关键分子。以上结果表明SMAD4缺失解除TGFβ信号依赖的TH17细胞分化抑制。
本研究首先通过体外分化实验发现SMAD4缺失的T细胞在仅含IL-6、无TGFβ信号时,仍能高效分化为TH17细胞,而野生型T细胞无法分化;双敲除小鼠(同时缺失SMAD4和TGFβRII)的T细胞在IL-6单刺激下,TH17相关基因(Rorc、Il17a、Il23r等)表达显著上调,与SMAD4缺失的T细胞结果一致。进而又进行了体内功能验证,结果显示双敲除小鼠脾脏和淋巴结中TH17细胞比例与野生型相当,而单纯TGFβRII敲除小鼠几乎无TH17细胞。在实验性自身免疫性脑脊髓炎(EAE)模型中,双敲除的T细胞分化为致病性TH17细胞的能力与野生型一致,且小鼠表现出类似的病理损伤。诱导型SMAD4缺失实验显示,急性缺失 SMAD4可在无TGFβ受体信号时促进TH17分化,证实SMAD4是抑制TH17分化的关键分子。以上结果表明SMAD4缺失解除TGFβ信号依赖的TH17细胞分化抑制。

图1. SMAD4缺失导致在缺乏TGFβ信号的情况下TH17细胞分化。

图S1. 在没有SMAD4的情况下TH17细胞分化。
接下来作者对SMAD4缺失如何影响控制TH 17细胞分化的分子机制进行了研究。利用RNA-seq检测基因表达差异,结果显示SMAD4缺失的T细胞激活后12h内,Rorc表达显著升高,早于其他TH17相关基因(如Il17a、Batf),且RORγt蛋白水平同步上调。回补SMAD4可抑制SMAD4缺失的T细胞Rorc表达及 TH17分化,而异位表达RORγt可逆转SMAD4的抑制作用,证实了RORγt是SMAD4的关键下游靶点。并通过ChIP-seq 进行了验证,结果显示SMAD4直接结合Rorc基因的启动子和增强子区域,但不结合Il17a/Il17f。以上结果表明SMAD4 通过直接抑制RORγt调控TH17分化。

图2. SMAD4通过直接抑制Rorc表达来控制TH17细胞程序。
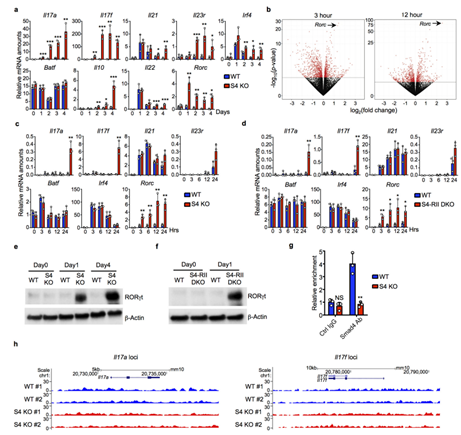
图S2. SMAD4抑制RORγt表达。

图S2. SMAD4抑制RORγt表达。
以上研究中发现无论是否存在TGFβ,SMAD4仍然与Rorc位点结合,作者提出TGFβ信号通路改变了SMAD4与其他蛋白质的相互作用的假设。通过IP-MS和Co-IP发现,SMAD4与转录抑制因子SKI结合,且TGFβ刺激可显著降低SKI蛋白水平,破坏SKI-SMAD4复合物;SMAD4突变体(无法结合SKI)失去对TH17分化的抑制能力,证实了SKI-SMAD4互作是抑制RORγt的关键。接着对SKI的调控机制进行了研究,发现SKI过表达可抑制Rorc启动子区H3K9乙酰化,而SMAD4缺失可逆转这一效应,表明SKI-SMAD4复合物通过调控染色质修饰抑制基因表达。经TGFβ处理的野生型T细胞,Rorc启动子H3K9乙酰化水平升高,而SMAD4缺失的T细胞在无TGFβ时仍维持高乙酰化,进一步证明了TGFβ通过降解SKI解除去乙酰化抑制。以上结果表明,TGFβ通过降解SKI解除SMAD4介导的抑制。

图3. TGFβ信号破坏SKI-SMAD4复合物,以促进TH17细胞分化。
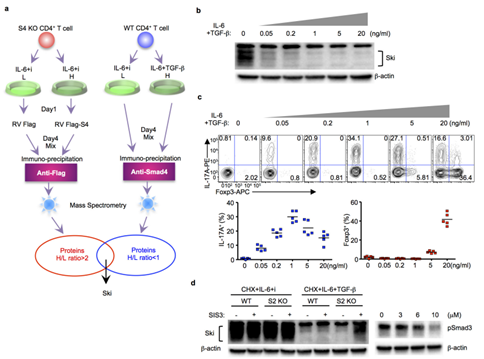
S3. 低剂量TGFβ下SKI的鉴定及其降解。
最后作者对SKI-SMAD4轴的功能进行了验证。异位表达SKI可显著抑制野生型T细胞的TH17 分化和Rorc表达,且该抑制作用依赖SMAD4;干扰SKI表达可使野生型T细胞在无TGFβ时分化为TH17细胞,证明了SKI是TH17分化的负调控因子。体内致病性结果显示,过表达SKI的T细胞在EAE模型中分化为TH17细胞的能力显著受损,而SKI缺陷细胞分化增强,表明SKI-SMAD4 轴在体内调控TH17细胞的致病性分化。

图4. SKI以SMAD4依赖的方式抑制TH17细胞分化。
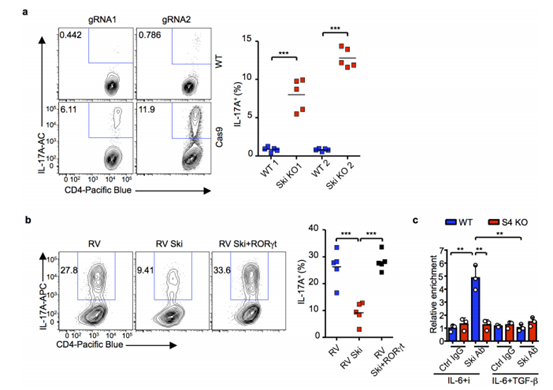
图S4. SKI和SMAD4协同抑制TH17细胞分化。
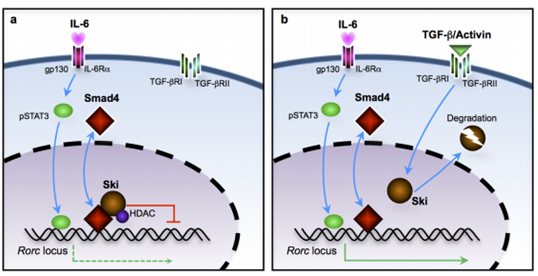
图S5. TGFβ超家族信号克服了激活T细胞中SKI-SMAD4复合物介导的RORγt表达抑制,以促进TH17细胞分化。
本研究通过基因敲除、分子互作、表观遗传及体内外功能实验,系统性阐明了TGFβ-SKI-SMAD4-RORγt通路在TH17细胞分化中的关键机制,为靶向SKI-SMAD4轴治疗TH17相关疾病(如自身免疫病)提供理论依据。
相关文章
更多 >

