抑制剂ML385的作用机制及在氧化应激和肿瘤研究中的应用
2025-06-20 来源:本站 点击次数:193
核因子E2相关因子 2(Nrf2)是细胞内重要的转录因子,在调节氧化应激、炎症反应及细胞代谢等多种生理过程中发挥关键作用。ML385(AbMole,M8692)作为一种特异性的Nrf2抑制剂,在科研领域受到广泛关注。它能够与 Nrf2 蛋白特定结构域结合,阻断 Nrf2 的激活及相关信号通路的传导,进而影响细胞的多种生物学功能。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。


一、ML385的作用机制
Nrf2是细胞应对氧化应激的关键蛋白,在正常生理状态下,细胞内的氧化还原平衡维持在一定水平,Nrf2与 Kelch样ECH相关蛋白 1(Keap1)结合,以无活性形式存在于细胞质中。当细胞受到氧化应激刺激时,Keap1上的某些半胱氨酸残基发生修饰,导致其与Nrf2的亲和力降低,Nrf2得以解离并进入细胞核,与ARE结合启动基因转录。ML385(AbMole,M8692)发挥抑制作用的首要机制是与Nrf2蛋白直接结合。研究发现,ML385能够特异性地与 Nrf2蛋白的 Neh2 结构域相互作用。Neh2结构域是Nrf2与Keap1结合的关键区域,同时也参与Nrf2的核转位及与 DNA 的结合过程。ML385与Neh2结构域结合后,可通过空间位阻效应以及改变Neh2结构域的构象,影响Nrf2与 Keap1的解离以及 Nrf2 与 ARE 的结合能力,从而阻断Nrf2信号通路的激活。

图 1. Nrf2激活和调节转录的经典途径[1]
二、ML385的研究应用
1.ML385用于细胞氧化应激研究
在多种细胞模型中,ML385(AbMole,M8692)被广泛用于研究氧化应激条件下 Nrf2 信号通路的作用[2]。例如,在人AML细胞系MV4-11、 MOLM13中,ML385通过抑制Nrf2信号通路,降低了抗氧化基因(如HO-1、NQO1)的表达,导致细胞内ROS水平持续升高,脂质过氧化增加,从而加剧细胞的氧化损伤[2]。还有研究发现,ML385通过抑制Nrf2/HO-1信号通路,可显著降低细胞的抗氧化能力,增加脂质过氧化物MDA含量,降低GSH水平[3]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
2.ML385用于动物模型氧化应激研究
在动物模型研究中,ML385(AbMole,M8692)同样展现出对氧化应激相关过程的影响。在小鼠脊髓损伤(SCI)模型中,ML385被用作Nrf2抑制剂,以研究Nrf2信号通路在神经保护中的作用。结果表明,ML385显著削弱了抗氧化剂,如Acacetin(AbMole,M4584),对氧化应激和炎症的缓解作用,表明Nrf2信号通路在SCI后的抗氧化防御中具有重要作用[4]。在小鼠肠道氧化应激模型中,ML385被用于研究Nrf2信号通路在缓解氧化应激中的作用。结果显示,ML385显著削弱了鞣花酸(AbMole,M2252)对氧化应激的缓解,降低了Nrf2、HO-1和NQO1的表达,增加了MDA水平[5]。
3.抗肿瘤研究
ML385(AbMole,M8692)在多种肿瘤模型中展现出显著的抗肿瘤活性。在NSCLC模型中,ML385对KEAP1突变导致Nrf2功能增强的细胞具有特异性和选择性[6]。此外,ML385还通过抑制PI3K-mTOR信号通路,抑制肺鳞状细胞癌的生长[7]。这些研究表明,ML385可能是一种有前途的肿瘤抑制策略。此外,ML385在研究肿瘤细胞耐药机制方面也发挥了作用,研究表明,ML385可以通过阻断Nrf2/HO-1通路来抑制缺氧诱导的乳腺癌细胞(MDA-MB-231)对抑制剂的耐受[8],ML385还能增强氧化应激损伤和铁死亡,逆转肿瘤细胞的耐受性[9]。
三、范例详解
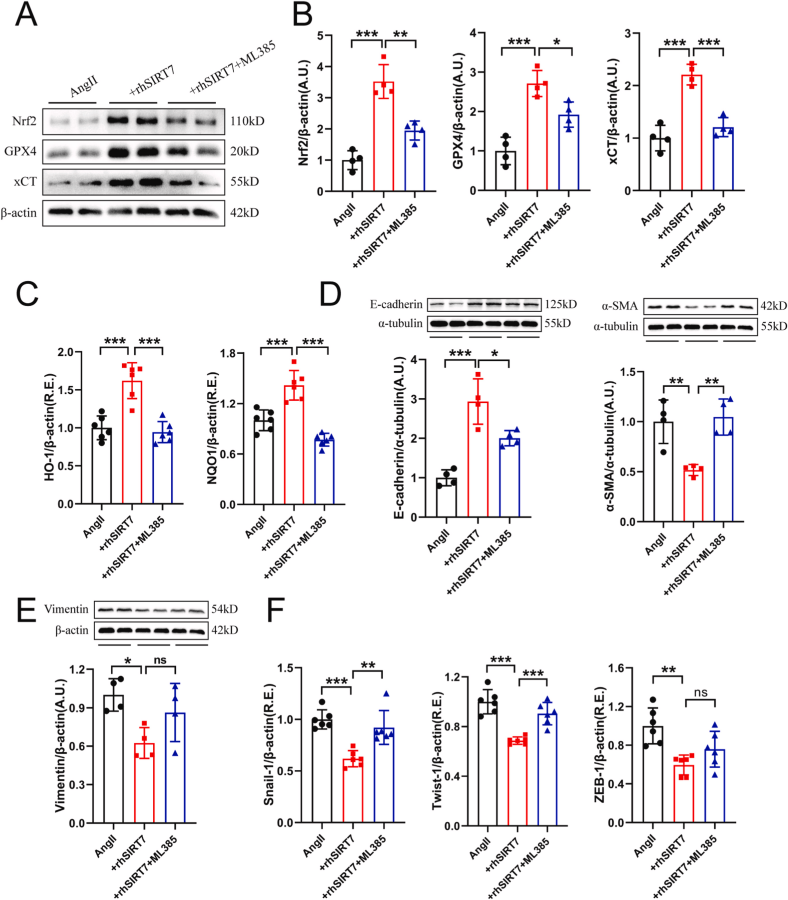
首都医科大学朝阳医院研究了Sirtuin 7(SIRT7)在高血压小鼠肾脏损伤中的作用及其机制,特别是其在铁死亡(ferroptosis)、肾纤维化和氧化应激中的调控作用。研究结果表明,SIRT7通过调节KLF15/Nrf2信号通路,减轻高血压引起的肾脏损伤和功能障碍。在这项研究中,AbMole的ML385(AbMole,M8692)被用来验证Nrf2是否是SIRT7的关键下游靶点[10]。最终证实Sirtuin 7通过促进 KLF15/Nrf2 信号传导减轻高血压小鼠的肾铁死亡、纤维化和损伤。

图 2. Inhibition of Nrf2 by ML385 antagonized rhSIRT7 mediated protective roles of ferroptosis and partial EMT in Ang Ⅱ-stimulated mouse renal TECs[10]

参考文献及鸣谢
[1] C. Tonelli, I. I. C. Chio, D. A. Tuveson, Transcriptional Regulation by Nrf2, Antioxidants & redox signaling 29(17) (2018) 1727-1745.
[2] Xibao Yu, Yan Wang, Jiaxiong Tan, et al., Inhibition of NRF2 enhances the acute myeloid leukemia cell death induced by venetoclax via the ferroptosis pathway, Cell Death Discovery 10(1) (2024) 35.
[3] Y. Liu, Y. Jia, C. Li, et al., [Dexmedetomidine attenuates heat stress-induced oncosis in human skeletal muscle cells by activating the Nrf2/Ho-1 pathway], Nan Fang Yi Ke Da Xue Xue Bao 45(3) (2025) 603-613.
[4] X. Zhang, L. Xu, X. Chen, et al., Acacetin alleviates neuroinflammation and oxidative stress injury via the Nrf2/HO-1 pathway in a mouse model of spinal cord injury, Transl Neurosci 13(1) (2022) 483-494.
[5] X. Zhang, S. Wang, Y. Wu, et al., Ellagic Acid Alleviates Diquat-Induced Jejunum Oxidative Stress in C57BL/6 Mice through Activating Nrf2 Mediated Signaling Pathway, Nutrients 14(5) (2022).
[6] A. Singh, S. Venkannagari, K. H. Oh, et al., Small Molecule Inhibitor of NRF2 Selectively Intervenes Therapeutic Resistance in KEAP1-Deficient NSCLC Tumors, ACS chemical biology 11(11) (2016) 3214-3225.
[7] L. Ji, N. Moghal, X. Zou, et al., The NRF2 antagonist ML385 inhibits PI3K-mTOR signaling and growth of lung squamous cell carcinoma cells, Cancer Med 12(5) (2023) 5688-5702.
[8] Huan Yang, Wentian Zheng, Hehua Lin, et al., ML385 Suppresses Hypoxia-Induced Drug Resistance and Cancer Stemness of Breast Cancer Cells by Blocking the Nrf2/HO-1 Pathway, Pharmaceutical Chemistry Journal 58(10) (2025) 1506-1513.
[9] L. Yan, H. Hu, L. Feng, et al., ML385 promotes ferroptosis and radiotherapy sensitivity by inhibiting the NRF2-SLC7A11 pathway in esophageal squamous cell carcinoma, Med Oncol 41(12) (2024) 309.
[10] X. T. Li, J. W. Song, Z. Z. Zhang, et al., Sirtuin 7 mitigates renal ferroptosis, fibrosis and injury in hypertensive mice by facilitating the KLF15/Nrf2 signaling, Free radical biology & medicine 193(Pt 1) (2022) 459-473.
相关文章
更多 >

