CosMx SMI助力揭示结直肠癌ICI疗效预测因子CD74
2025-06-24 来源:本站 点击次数:55题目:A constitutive interferon-high immunophenotype defines response to immunotherapy in colorectal cancer
期刊:Cancer cell
IF:48.8
Doi: 10.1016/j.ccell.2024.12.008

免疫检查点抑制剂(ICI)疗法的出现,彻底改变了晚期或转移性错配修复缺陷(dMMR)和微卫星高度不稳定性(MSI-H)结直肠癌(CRC)患者的治疗格局,大幅提升了无进展生存期(PFS)。然而, dMMR CRC因其高突变负荷(TMB),理论上更易对免疫疗法产生反应,但实际响应率不足50%;此外,绝大多数具备正常错配修复功能的pMMR CRC患者则几乎无法受益。肿瘤免疫微环境(TIME)的复杂机制是影响治疗效果的关键,但其具体调控机制目前仍未明晰。本文通过多区域转录组分析及单细胞空间转录组技术检测(SMI),深入解析了两种CRC亚型肿瘤与免疫环境的互作关系,发现了独立于TMB和MMR状态的新型免疫治疗反应标志物,为精准治疗和扩大免疫疗法应用带来了新的希望。
研究收集了来自28例dMMR和30例pMMR结直肠癌患者的59个肿瘤样本,两组患者在年龄和肿瘤分期上的分布相似。另有23例dMMR患者(24个肿瘤样本)接受了抗PD-1免疫检查点抑制剂治疗,依据治疗反应被分为应答组和非应答组。
空间转录组学技术手段
1、利用激光显微切割(LCM)技术对肿瘤核心区和浸润边缘区域进行了精确分区,分别选取肿瘤上皮Te、肿瘤间质Ts及相邻正常上皮(Ne)区域,进行转录组测序。
2、通过两例ICI应答的dMMR和两例IFN-high型的pMMR CRC样本,利用CosMx SMI技术在单细胞水平上获取了细胞的空间位置以及转录组信息。
文章主要结果
1、研究团队利用激光显微切割(LCM)技术,精确分割到结直肠癌核心区与浸润边缘区域的肿瘤上皮(Te)、肿瘤相关间质(Ts)及相邻正常上皮(Ne),通过优化文库构建实现高质量转录组测序。结果显示,组织类型(Te vs. Ts)对基因表达影响远大于不同CRC亚型之间的差异,且dMMR亚型展现出更高的异质性,而pMMR亚型基因表达更丰富,可能关联其干性表型。肿瘤核心与边缘区域异质性较小。功能分析揭示IFN反应、STING通路及肿瘤干性等在不同亚型间差异显著,暗示肿瘤内在特征与免疫微环境的复杂互作。
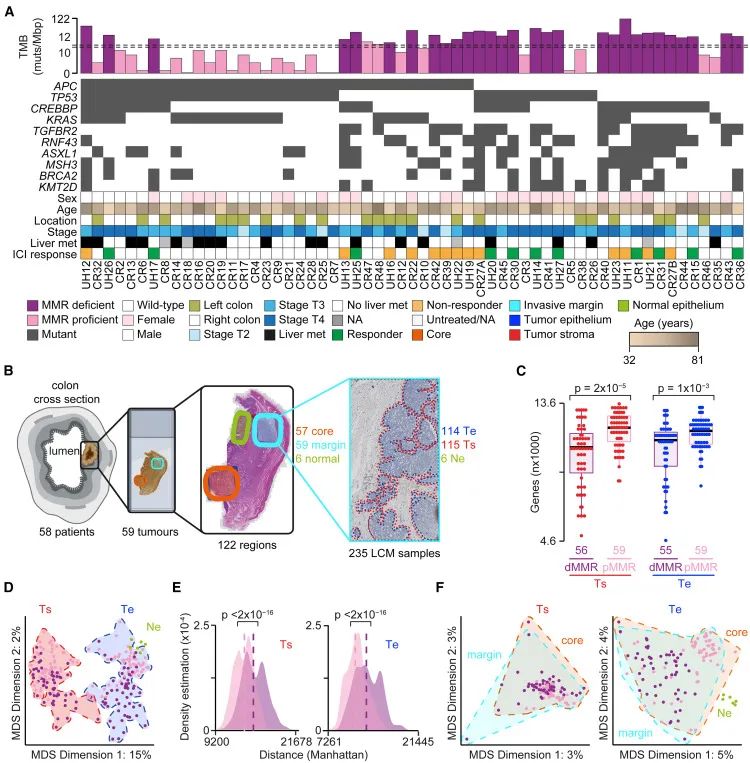 LCM揭示肿瘤内部异质性
LCM揭示肿瘤内部异质性2、研究团队借助CosMx SMI技术,实现了细胞空间位置与细胞转录组信息的同步获取。结果显示,紧邻T细胞的肿瘤相关巨噬细胞(TAMs)中,抗原呈递(APP)相关基因(如CD74、HLA-DRA)显著上调,同时干扰素响应(IFN response)通路相关基因也表现活跃。此现象表明,T细胞不仅通过细胞接触,还可能通过分泌细胞因子调控TAMs的免疫激活状态,增强其抗原呈递功能,推动肿瘤微环境的免疫应答。更为重要的是,这种转录变化同样在邻近T细胞的肿瘤上皮细胞中出现,肿瘤细胞中CD74、ICAM1、STING等免疫调控基因显著升高,提示非抗原呈递细胞也能被T细胞激活,显示肿瘤微环境的高度可塑性和复杂的免疫互作。
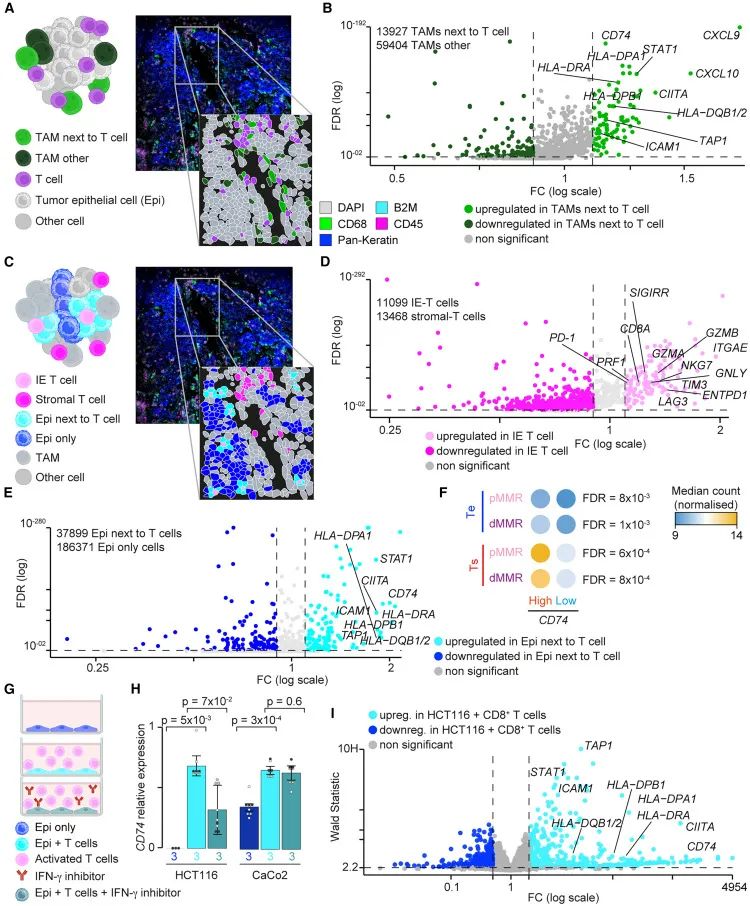 T细胞诱导的TAM和CRC细胞中的CD74过表达
T细胞诱导的TAM和CRC细胞中的CD74过表达3、进一步的机制研究发现,CD74在邻近T细胞的TAMs和肿瘤细胞中均呈现出显著的高表达水平。特别是在IFN-high型免疫表型的结直肠癌中,CD74的表达模式高度一致且稳定。通过结合多组学数据和临床免疫检查点抑制剂(ICI)疗效分析,发现CD74是一个具有显著区分能力的免疫表型标志物。CD74能够跨组织区室有效预测患者对ICI治疗的反应。这一发现不仅揭示了肿瘤免疫微环境中T细胞对抗原呈递机制的调控作用,也为精准免疫治疗提供了潜在的生物标志物,助力临床个性化治疗方案的制定和疗效监测。
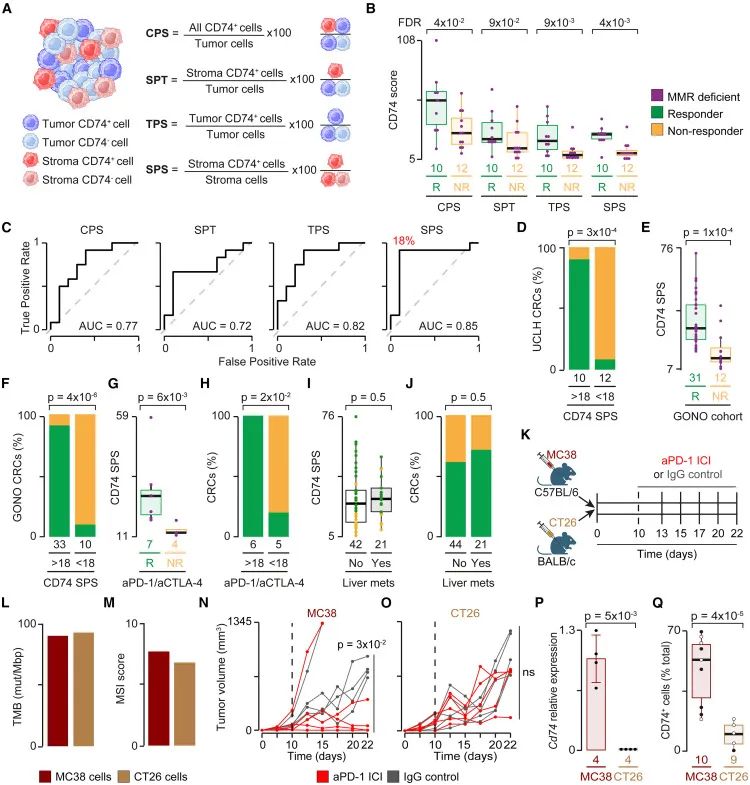 跨物种验证CD74作为免疫治疗预测标志物
跨物种验证CD74作为免疫治疗预测标志物总结
本研究通过激光显微切割(LCM)+转录组测序、空间转录组(CosMx SMI)及临床样本验证等多维手段,系统描绘了结直肠癌不同亚型中肿瘤上皮(Te)与基质(Ts)之间的分子差异和免疫互作。研究发现,组织类型对表达谱的影响远大于分子亚型,dMMR肿瘤呈现更强异质性,而pMMR更具“干性”特征。空间层面上,Te与Ts表达谱相互交错,提示边界模糊,区域异质性较低。
利用CosMx高分辨率空间转录组平台,研究进一步揭示T细胞对局部微环境的深远影响。无论是TAMs还是肿瘤上皮细胞,在靠近T细胞时均显著上调抗原呈递(APP)和干扰素(IFN)响应通路基因。这一现象表明,免疫信号可塑性并非仅限于专业免疫细胞,而是可渗透至肿瘤细胞本身。
进一步验证显示,CD74作为关键的抗原呈递相关分子,在T细胞邻近区中持续高表达,并能跨组织区室稳定预测患者对免疫检查点抑制剂(ICI)的应答。结合小鼠模型和多个临床队列数据,CD74被确立为具临床转化潜力的空间免疫表型标志物。

