高分辨率空间转录组技术揭示胰腺癌转移过程中的谱系塑性
2025-06-12 来源:本站 点击次数:115
在癌症治疗领域,胰腺导管腺癌(PDAC)因其高度侵袭性与转移性,长期被视为“最难攻克的堡垒”之一。肿瘤组织内部及不同转移部位之间存在的空间异质性,是导致治疗抵抗和预后不良的重要原因。然而,传统研究手段难以系统性、精细化地描绘这一异质性。
近日,发表在《Nature》的重磅研究《Spatial mapping of transcriptomic plasticity in metastatic pancreatic cancer》,通过应用高分辨率空间转录组技术,系统绘制了转移性胰腺癌的空间转录组图谱。该研究为理解肿瘤转移过程中的细胞谱系演变、克隆动态变化及微环境重塑提供了洞察。
文章研究亮点
1.技术平台与样本
本研究基于13位转移性胰腺导管腺癌(PDAC)患者,共收集49份原发灶及多器官转移灶(肝、肺、腹膜)的冷冻组织样本,为确保RNA质量与空间结构保存,全部样本经快速自体解剖获得。
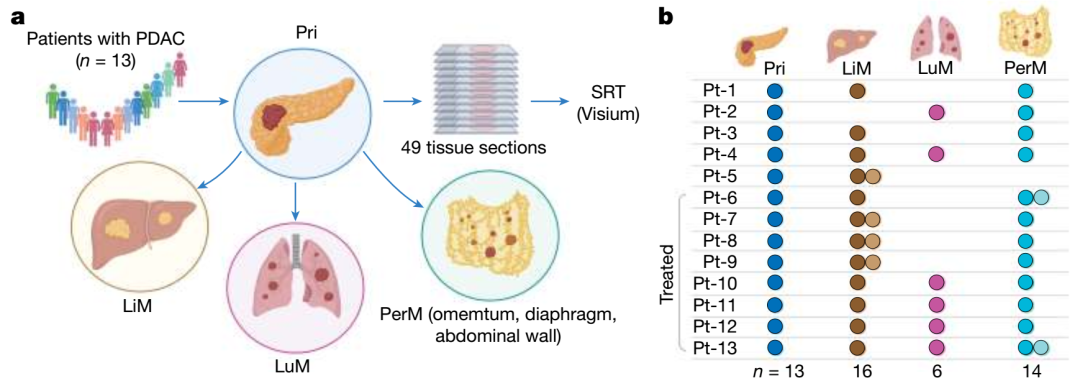
研究采用10x Genomics Visium平台进行高通量空间转录组测序,实现了在组织结构背景下对超过13万空间点的转录组水平数据采集与分析。同时,辅以CosMx Spatial Molecular Imaging (SMI)平台,搭配1,000-plex RNA panel,开展单细胞分辨率的空间多重RNA成像,针对关键细胞类型与信号通路(如TGFB1、CXCL12–CXCR4)进行独立验证与空间互作细节解析。
通过Visium平台的广覆盖能力与CosMx技术的超高分辨率互补结合,本研究得以系统揭示转移性PDAC内部的谱系演化、克隆异质性及肿瘤微环境重塑特征,为后续空间生物学分析提供坚实的数据基础。
2.多样化克隆演化模式
通过推断空间拷贝数变异(CNV)构建的系统发育树,揭示了患者间高度异质的转移模式,包括原发灶内部多克隆分化、器官特异性克隆适应等现象,为进一步理解治疗耐药提供了新视角。
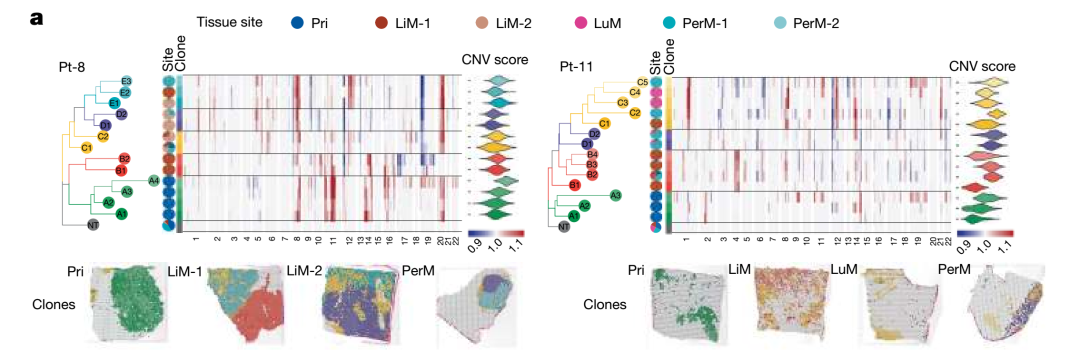 系统进化克隆树揭示PDAC中多样化的进化模式
系统进化克隆树揭示PDAC中多样化的进化模式
3.揭示转移过程中的谱系塑性
研究发现,癌细胞在从原发灶向肝脏、肺部和腹膜转移过程中,发生了显著的谱系状态切换。例如,肝转移灶中以侵袭性较强的basal-like谱系为主,而肺转移灶则富集较为分化的classical谱系细胞。
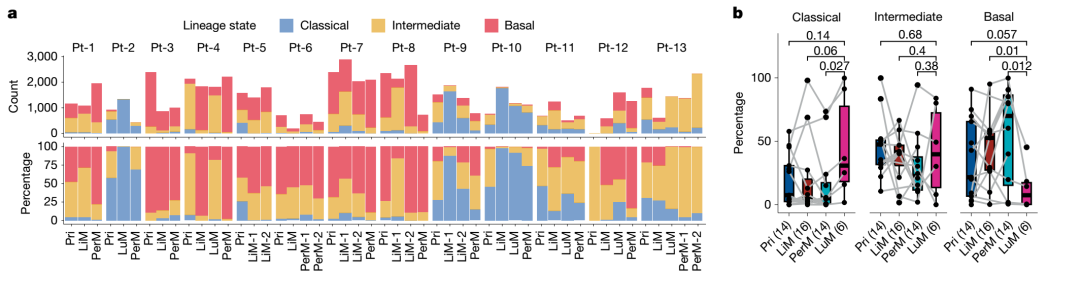 肿瘤谱系状态在原发及转移灶中的空间重塑
肿瘤谱系状态在原发及转移灶中的空间重塑
4.空间结构与免疫微环境重塑
研究发现,在转移性胰腺癌组织中,basal-like肿瘤细胞群周围高度富集表达TGFB1的肌成纤维样癌相关成纤维细胞(myCAFs),与肿瘤细胞形成致密包裹,并伴随明显的浆细胞排斥现象。进一步应用CosMx SMI平台进行单细胞分辨率空间验证,确认了myCAFs与肿瘤细胞的邻近分布,以及CXCL12在myCAFs中、CXCR4在浆细胞中的表达模式。空间邻域分析显示,浆细胞在肿瘤细胞邻近区域显著减少,支持空间排斥现象,提示CXCL12–CXCR4轴可能在局部免疫抑制中发挥关键作用。
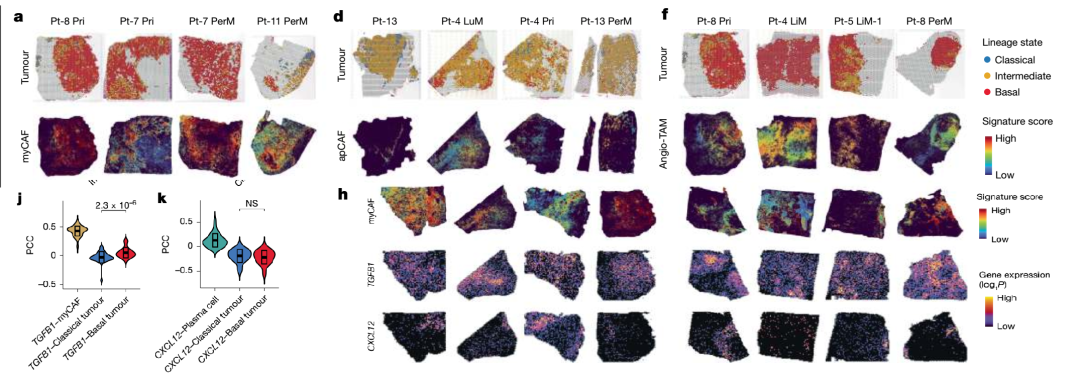 PDAC肿瘤点在基础谱系中的共同定位和myCAF的标志性评分
PDAC肿瘤点在基础谱系中的共同定位和myCAF的标志性评分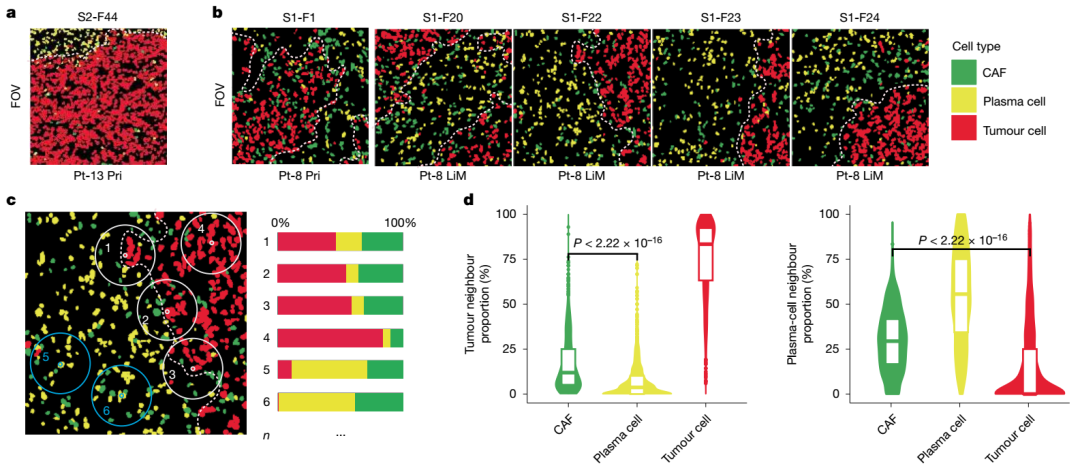 CosMx SMI揭示myCAFs与浆细胞的空间排斥分布
CosMx SMI揭示myCAFs与浆细胞的空间排斥分布空间转录组技术的关键价值
本研究充分展现了空间转录组技术在癌症研究中的核心优势,主要体现在以下四个方面:
1、空间定位与高通量表达检测同步实现
保留组织原位结构,避免传统单细胞测序因解离导致的空间信息丢失。实现数万空间点位的转录组层面数据采集,兼顾高分辨率与广覆盖。
2、细胞间互作与微环境重塑的深入解析
精准揭示肿瘤细胞、成纤维细胞、免疫细胞等不同类型细胞的空间邻近关系。解析关键信号轴(如TGFB1、CXCL12–CXCR4)在肿瘤免疫逃逸与微环境塑形中的作用。
3、肿瘤谱系演化与克隆异质性重建
结合空间拷贝数变异推断,绘制肿瘤从原发灶至多器官转移灶的克隆进化轨迹。揭示个体间、不同转移器官间乃至同器官不同病灶之间的克隆演化多样性D。
4、推动精准干预策略与新靶点发现
在空间信息指导下,可识别具有治疗意义的特定细胞群体及其微环境依赖特征。为肿瘤免疫治疗、抗纤维化干预及联合疗法开发提供新的空间生物学依据。
随着测序平台不断升级与空间解析算法的持续优化,空间转录组学正逐步在肿瘤学、发育生物学、再生医学、神经科学等多个领域展现出突破性应用潜力,成为解码复杂组织微环境不可或缺的研究工具。

