单细胞转录组+PDX模型揭示胶质母细胞瘤复发机制
2025-05-28 来源:本站 点击次数:621编者按
单细胞转录组测序技术与患者来源异种移植模型(PDX)正成为肿瘤研究的“双剑合璧”,为攻克胶质母细胞瘤(GBM)复发之谜提供了全新视角。GBM以其高度异质性和治疗耐药性闻名,但复发机制仍不明确。本研究通过单细胞技术解析了GBM的六种细胞状态,揭示了癌症干细胞(CSCs)在复发中的核心作用,同时利用PDX模型高度保真地模拟了肿瘤进展和治疗反应。两者的结合,不仅为理解GBM的分子机制提供了深度,也为开发精准治疗策略奠定了基础。想了解单细胞技术和PDX模型如何破解肿瘤复发的科学密码?这篇解读带你一探究竟!
01 研究背景
胶质母细胞瘤(GBM)是一种预后极差的致命疾病,主要原因是手术和化疗后的肿瘤复发。GBM的高度瘤内异质性被认为是治疗失败和复发的主要驱动因素,但关于其异质性来源及其在复发中的作用尚未达成共识。基因组和单细胞转录组研究揭示了GBM的细胞和分子异质性,但现有临床前模型(如肿瘤来源的细胞系和基因工程小鼠模型)在模拟人类GBM治疗反应和复发方面存在局限性。患者来源的异种移植模型(PDX)虽然提供了更接近人类肿瘤的模型,但其在连续移植中的稳定性和保真度仍需验证。此外,尽管多项研究提出了GBM细胞状态的可塑性,但鉴定和分离导致治疗耐药性和复发的关键细胞类型仍是亟待解决的问题。本研究旨在通过单细胞转录组技术和原位PDX模型,解析GBM异质性,揭示癌症干细胞(CSCs)在肿瘤复发中的核心作用,为开发更有效的治疗策略提供理论基础。
02 文章详情
文章题目:Glioblastoma functional heterogeneity and enrichment of cancer stem cells with tumor recurrence
中文题目:胶质母细胞瘤的功能异质性与肿瘤复发中癌症干细胞的富集
发表时间:2024.12
期刊名称:Neuron
影响因子:14.7
技术平台:10x Genomics单细胞转录组测序技术
DOI:10.1016/j.neuron.2024.10.012
03 研究结果
1. 无监督聚类PDX中的GBM细胞
为了解决GBM肿瘤异质性及其在复发中的作用问题,研究者利用10X单细胞RNA测序(scRNA-seq)和UMAP可视化技术,对8个GBM PDX样本进行了无监督聚类分析。通过Seurat包和典型相关分析(CCA),研究者识别出六个独特的GBM转录状态(CT1–CT6),每个簇具有特定的基因特征。这些特征在整合的PDX样本中表现出高特异性和稳健性,揭示了GBM细胞异质性的层次结构,并验证了无监督分析方法的可靠性。
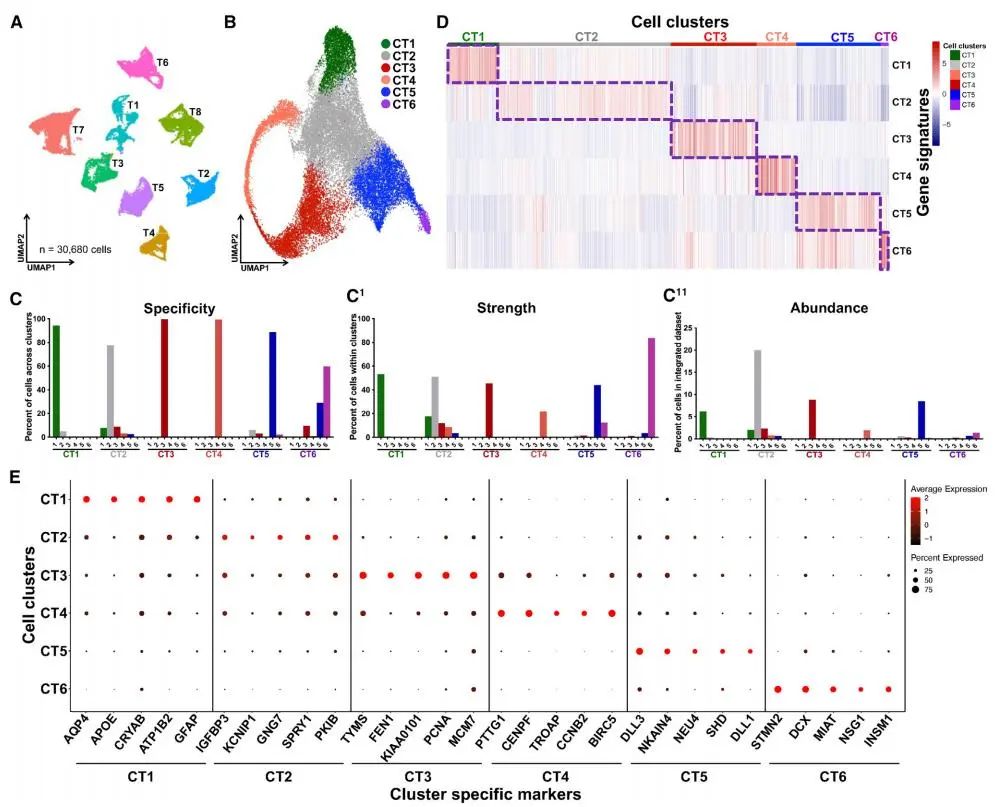 Fig1. 无监督的转录细胞簇的描述和8个人GBM的特征
Fig1. 无监督的转录细胞簇的描述和8个人GBM的特征2. 经验性细胞簇划分与CNS细胞谱系的一致性
为了验证GBM细胞簇是否与中枢神经系统(CNS)细胞谱系相关,研究者将CT1–CT6簇与已知的CNS细胞基因特征进行比较。结果显示,CT1簇与神经干细胞(NSC)特征一致,CT3和CT4分别与增殖相关的S期和有丝分裂基因特征相关,CT5和CT6分别与少突胶质细胞和神经元谱系相关。CT2簇则表现出独特的代谢和形态发生特征,未与任何CNS谱系直接关联。这些结果表明,GBM细胞异质性与CNS细胞谱系密切相关,但部分细胞状态可能代表独特的肿瘤细胞类型。
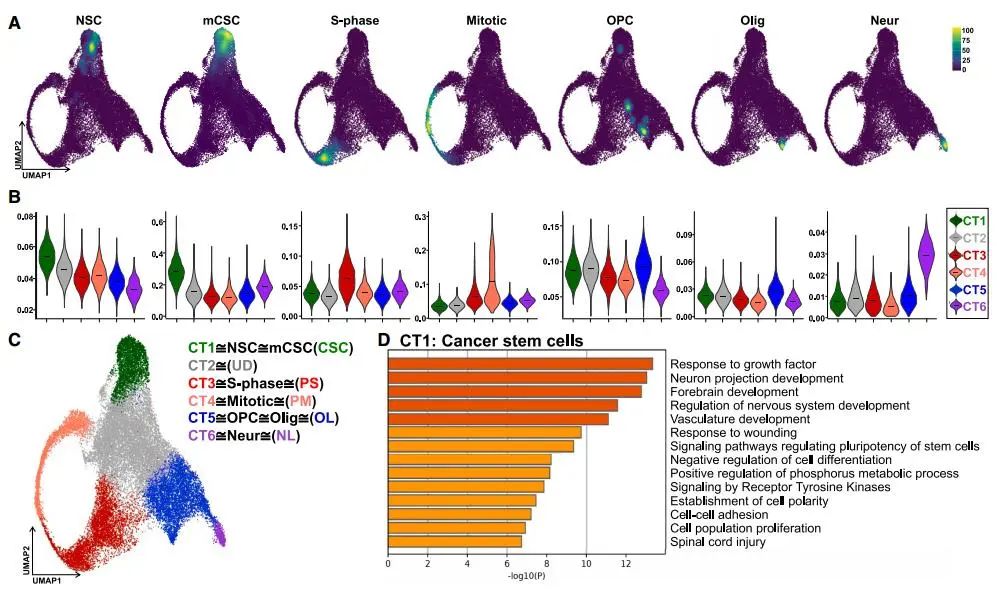 Fig2. 无监督的GBM细胞簇名称与CNS谱系转录特征一致
Fig2. 无监督的GBM细胞簇名称与CNS谱系转录特征一致3. 连续异种移植中的基因组稳定性和层次结构
为了研究GBM异质性在连续异种移植中的稳定性,研究者对多个PDX样本进行了长达10次的连续移植,并通过体细胞突变测序(MSK-IMPACT)和RNA-seq分析基因组和转录组的稳定性。结果显示,GBM相关驱动突变和拷贝数变异(CNV)在移植过程中保持稳定。CT1簇(CSC)在移植中持续存在并扩增,而CT6簇(神经元谱系)逐渐减少。这些发现支持了CSC在肿瘤层次结构中的顶端地位,并揭示了GBM异质性在长期移植中的动态变化。
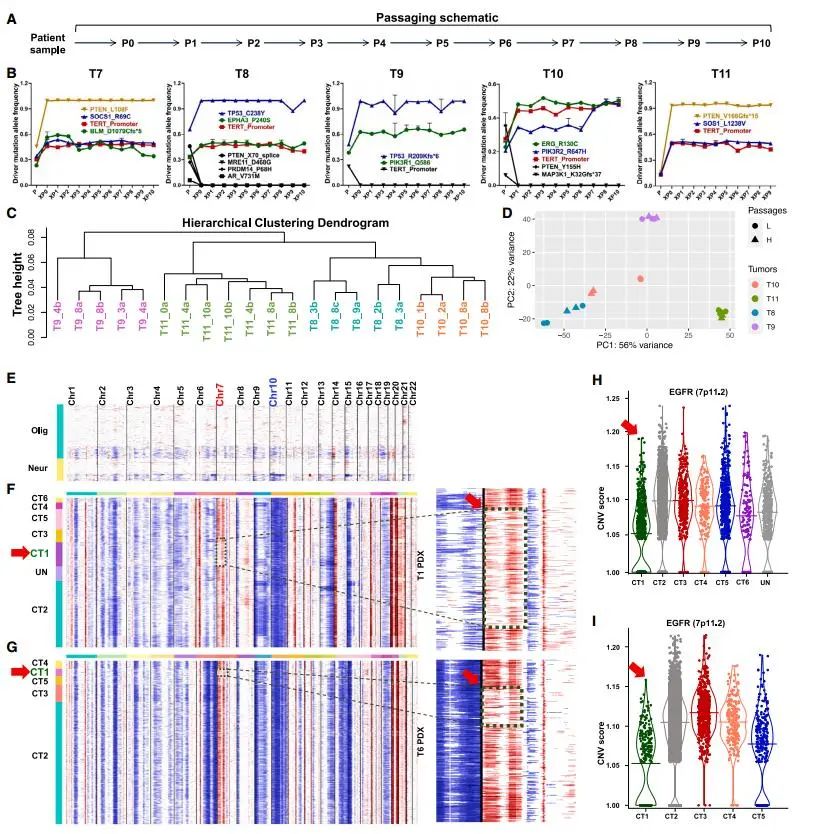 Fig3. GBM的扩展异种移植的基因组和转录稳定性
Fig3. GBM的扩展异种移植的基因组和转录稳定性4. CT1 CSCs在化疗后富集
为了探究化疗对GBM细胞异质性的影响,研究者使用替莫唑胺(TMZ)处理原位移植的PDX模型,并通过scRNA-seq分析细胞簇的变化。结果显示,TMZ处理后,CT1簇(CSC)显著扩增,而CT2–CT6簇减少。这表明TMZ介导的细胞毒性导致GBM异质性减少,CSC在化疗后富集,进一步支持了CSC在治疗耐药性中的关键作用。
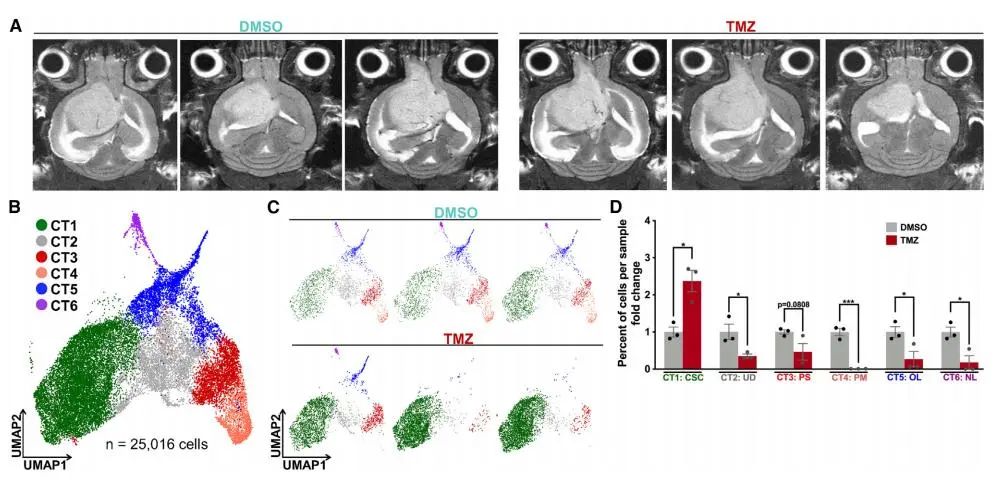 Fig4. CSC(CT1)GBM细胞簇通过扩展对急性TMZ治疗做出反应
Fig4. CSC(CT1)GBM细胞簇通过扩展对急性TMZ治疗做出反应5. CT1 CSCs在复发性人类GBM中扩增
为了研究GBM复发中CSC的作用,研究者比较了同一患者原发性和复发性GBM样本的PDX模型。流式细胞术和功能性实验显示,复发性肿瘤中F3+ CSC含量显著增加,且复发性肿瘤表现出更快的生长速度和更低的TMZ敏感性。scRNA-seq分析进一步证实,复发性肿瘤中CT1簇(CSC)显著扩增,而CT6簇(神经元谱系)减少。这些结果表明,GBM复发伴随着CSC的扩增,导致更具侵袭性的表型。
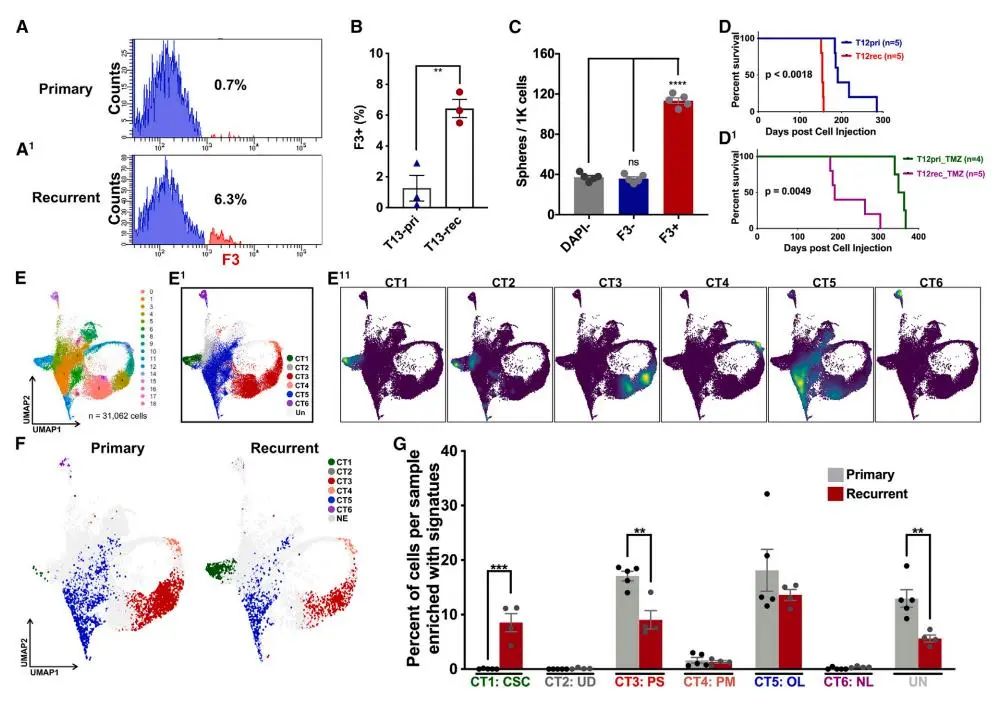 Fig5. 同一患者复发性肿瘤中的CSC(CT1)GBM细胞扩增
Fig5. 同一患者复发性肿瘤中的CSC(CT1)GBM细胞扩增6. CT1–CT6 GBM异质性在原发性GBM患者样本中持续存在
为了验证CT1–CT6特征在患者样本中的普遍性,研究者分析了多个独立产生的原发性和复发性GBM单细胞数据集。结果显示,CT1–CT6特征专门识别肿瘤细胞,并与TME细胞(如神经元、胶质细胞和免疫细胞)明显区分。复发性肿瘤中CT1簇显著扩增,而CT6簇减少,进一步支持了CSC在肿瘤复发中的核心作用。这些结果表明,CT1–CT6特征能够有效评估GBM异质性,并强调了原位PDX模型在重现GBM进展和复发中的保真性。
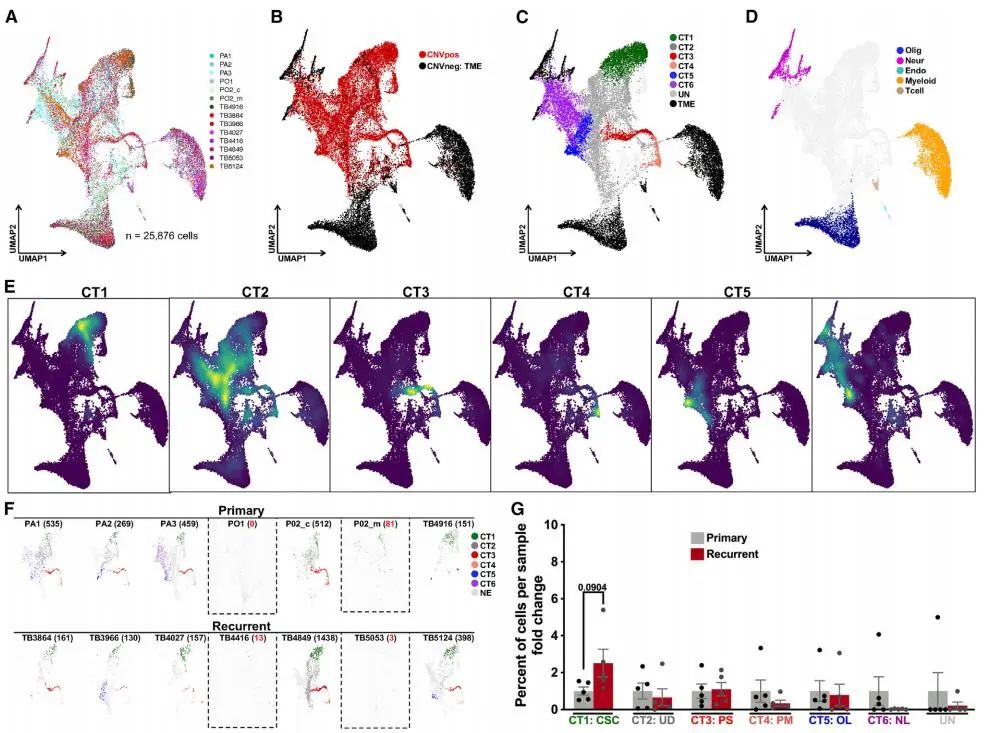 Fig6.CT1–CT6特征描述了肿瘤微环境和CT1细胞在复发的GBM中更丰富
Fig6.CT1–CT6特征描述了肿瘤微环境和CT1细胞在复发的GBM中更丰富主要结论
本研究描述了GBM的异质性,并强调了静止癌症干细胞(qCSCs)在表型和层次结构中的关键作用。通过对患者来源的异种移植模型(PDXs)进行无监督的单细胞转录组分析,我们划分了六种GBM转录状态,这些状态具有独特的肿瘤特异性基因特征,其中五种与中枢神经系统(CNS)细胞谱系一致。我们通过连续异种移植实验模拟肿瘤进化,证明了体细胞突变、转录组和qCSCs的忠实保留。PDX化疗导致CSC耐药性和扩增,这种现象在复发性患者GBM中也可见到。总体而言,这些新颖的GBM转录特征能够特异性地识别肿瘤细胞,并将其层次结构定义为稳定的、生物学上可区分的细胞类型,从而捕捉其在复发时的进化过程,强调了CSC的重要性,并证明了其对所有GBM的普遍意义。
参考文献
Xie, Xuanhua P et al. “Glioblastoma functional heterogeneity and enrichment of cancer stem cells with tumor recurrence.” Neuron vol. 112,24 (2024): 4017-4032.e6.

