陆军军医大学第二附属医院团队发现改善急性肾损伤的重要靶点
2025-10-20 来源:本站 点击次数:51损伤相关分子模式(DAMPs)诱导的无菌性炎症被认为是急性肾损伤(AKI)的典型特征。肾小管上皮细胞(RTECs)的质膜破裂是DAMP释放的主要原因,神经损伤诱导蛋白1(NINJ1)被认为是质膜破裂的执行者,而其在AKI病理生理学中的作用在很大程度上尚不清楚。
2025年8月11日,陆军军医大学第二附属医院赵景宏教授团队在International Journal of Biological Sciences(IF 10)上发表了题为“Targeting NINJ1-Mediated Plasma Membrane Rupture in Tubular Epithelial Cell Prevents Inflammatory Response in Acute Kidney Injury”的论文。研究发现ELK1-NINJ1轴是急性肾损伤后肾小管上皮细胞质膜破裂的关键调节因子,表明其可能是AKI治疗和预后改善的潜在靶点。
· 维真助力 - AAV·
基因信息:Ninj1:神经损伤诱导蛋白1
病毒产品及滴度:AAV9-Ksp-cadherin-shNinj1、AAV9-vector(9.64×10^13vg/ml );
实验动物:C57BL/6J 小鼠
注射方式:肾盂注射
注射剂量:1×10^12 copies
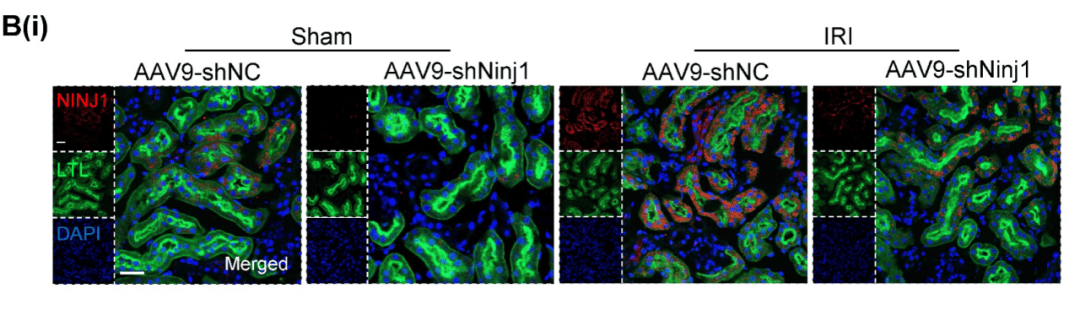 免疫荧光染色证明AAV9在RTECs中成功转染
免疫荧光染色证明AAV9在RTECs中成功转染
研究结果分享
1、抑制NINJ1寡聚化减弱RTECs中DAMP的释放和炎症反应
作者研究发现在AKI期间,RTECs中NINJ1的表达和寡聚化以及质膜破裂、DAMP释放和炎症反应被高度诱导。为了验证NINJ1在RTECs中对AKI响应的具体功能及其寡聚化作用,在体外HK-2细胞中敲低NINJ1,发现NINJ1的缺失阻碍了其寡聚反应。NINJ1缺失显著减少了由H/R诱导的气泡解体和质膜破裂而释放的蛋白质,表明NINJ1敲低可以减弱释放的DAMPs。NINJ1缺失显著降低了H/R后促炎细胞因子的释放,相应地,敲低NINJ1也减轻了HK-2细胞的损伤。表明敲低NINJ1可以防止其寡聚化,从而进一步减轻RTECs损伤和炎症反应。使用细胞保护剂甘氨酸处理HK-2细胞,单独的甘氨酸处理不影响NINJ1的表达或寡聚化,但甘氨酸处理显著抑制了H/R条件下NINJ1的寡聚化,同时伴随没有膜破裂,DAMPs的释放以及HK-2细胞的炎症减少。以上结果表明NINJ1通过诱导质膜破裂和DAMP释放导致RTECs损伤和炎症。
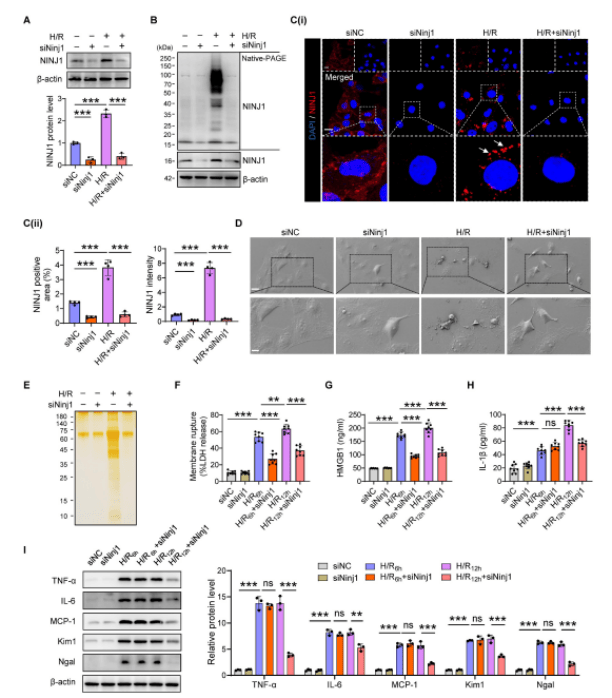 图1. Ninj1缺失会阻断H/R条件下DAMP的释放和炎症反应
图1. Ninj1缺失会阻断H/R条件下DAMP的释放和炎症反应
2、抑制NINJ1可预防AKI并改善AKI预后
为了确定NINJ1在AKI小鼠模型中的治疗潜力,作者使用AAV9-shNinj1在小鼠中敲低NINJ1,观察到AAV9-shNinj1在RTECs中成功转染,并且使用蛋白质印迹和免疫荧光验证了NINJ1表达的降低。与AAV9-shNC小鼠相比,AAV9-shNinj1治疗显著缓解了IRI诱导的NINJ1寡聚化,导致LDH和DAMPs释放减少,促炎细胞因子产生减少;IRI后巨噬细胞和中性粒细胞显著浸润到肾间质中,而AAV9-shNinja1小鼠中这些细胞的浸润减少。此外,敲低NINJ1降低了血清Scr和BUN水平,减轻了肾小管损伤。进一步探讨了NINJ1在AKI向CKD转变中的作用,发现AAV9-shNinj1治疗显著降低了AKI后第28天的胶原沉积、α-SMA和FN表达,从而挽救了恶化的肾功能。表明阻断RTECs中NINJ1的表达可能是预防AKI和改善AKI预后的一种有前景的策略。
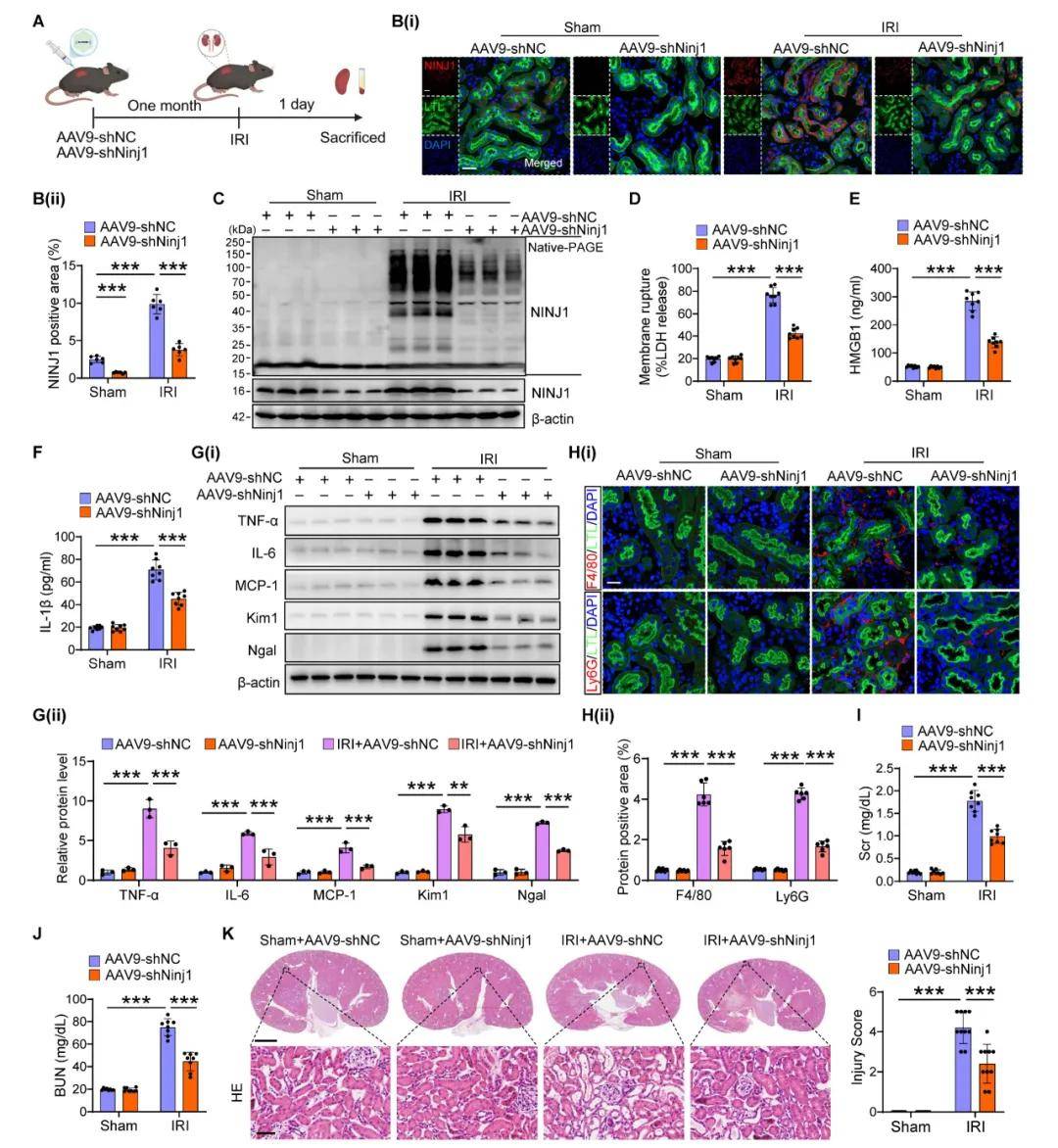 图2. 肾小管特异性NINJ1敲除减轻IRI诱导的AKI小鼠的肾损伤
图2. 肾小管特异性NINJ1敲除减轻IRI诱导的AKI小鼠的肾损伤
3、ELK1在Ser383磷酸化的突变减轻了NINJ1诱导的炎症反应
作者进一步研究了NINJ1表达的分子机制,发现ELK1的Ser383磷酸化可以通过在AKI后直接结合NINJ1启动子来调节NINJ1的转录表达。为了进一步确定ELK1的Ser383磷酸化位点在NINJ1诱导的DAMPs释放和炎症反应中的作用,作者突变了Ser383残基并将突变体转染到HK-2细胞中,发现Ser383的突变以及NINJ1的表达显著消除了ELK1在Ser383的磷酸化和核转位的显著增加。ELK1 Ser383突变的HK-2细胞中NINJ1寡聚化受到抑制,从而保持了气球状形态而不是气泡解体,并在细胞上清液中发现LDH、HMGB1、IL-1β和其他蛋白质明显减少,减轻IRI诱导的RTEC损伤和炎症反应。以上表明靶向ELK1的Ser383磷酸化可能限制NINJ1诱导的炎症反应和肾损伤。作者进一步利用可以抑制ELK1在Ser383处的磷酸化的细胞穿透肽(TDE)进行体内外实验,以防止NINJ1转录上调引起的炎症,实验表明TDE通过靶向Ser383磷酸化ELK1来缓解NINJ1介导的无菌炎症,可能是一种有前景的治疗药物。
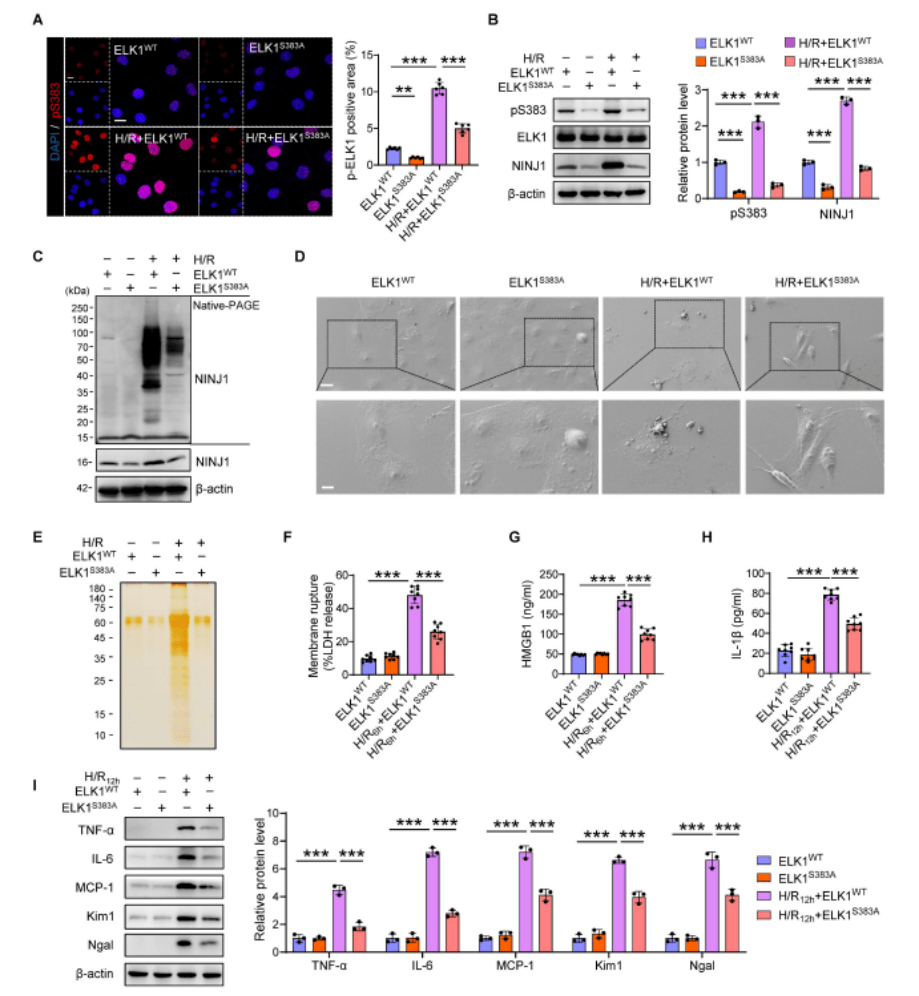 图3. ELK1在Ser383磷酸化的突变减轻了NINJ1诱导的炎症反应
图3. ELK1在Ser383磷酸化的突变减轻了NINJ1诱导的炎症反应
结论
本研究表明,RTECs中NINJ1表达的增加是AKI后质膜破裂和肾脏炎症反应的基础,并表明Ser383磷酸化ELK1是NINJ1表达的新转录调节因子。这些发现不仅为AKI的发病机制提供了深入的见解,而且表明靶向ELK1-NINJ1信号轴可能是预防这一病理过程和改善AKI预后的新策略。

