研究结果:PHB2通过线粒体调控保护心脏免受压力损伤
2025-10-20 来源:本站 点击次数:48心肌重塑是各种心血管疾病的关键病理过程,其中氧化还原失衡和线粒体生物能量紊乱是关键决定因素。抗增殖蛋白2(PHB2)位于线粒体内膜,是线粒体稳态的关键调节因子。
武汉大学人民医院唐其柱教授团队在Acta Pharmacologica Sinica(IF 8.4)上发表题为“PHB2 protects against pressure overload-induced myocardial remodeling in mice via stabilizing TOMM40 and regulating mitochondrial morphofunctional homeostasis”的文章。研究发现PHB2通过促进TOMM40稳定来保护线粒体形态功能稳态以应对病理应激方面的新功能,表明PHB2是心脏病潜在干预措施的有前景的治疗靶点。
· 维真助力 - AAV & Ad ·
In Vivo病毒产品:AAV9-cTnT-PHB2
实验动物:8周龄雄性C57BL/6小鼠
注射方式:尾静脉注射
注射剂量:1×10^12VG,100μL
In Vitro
病毒产品:Ad-PHB2
感染细胞:新生大鼠心肌细胞(NRCMs)
· 维真助力 - AAV & Ad ·
In Vivo病毒产品:AAV9-cTnT-PHB2
实验动物:8周龄雄性C57BL/6小鼠
注射方式:尾静脉注射
注射剂量:1×10^12VG,100μL
In Vitro
病毒产品:Ad-PHB2
感染细胞:新生大鼠心肌细胞(NRCMs)
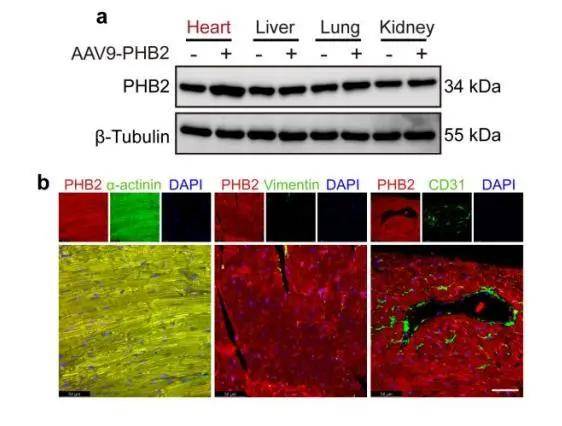 AAV9-cTnT-PHB2介导PHB2在小鼠心肌细胞特异性表达
AAV9-cTnT-PHB2介导PHB2在小鼠心肌细胞特异性表达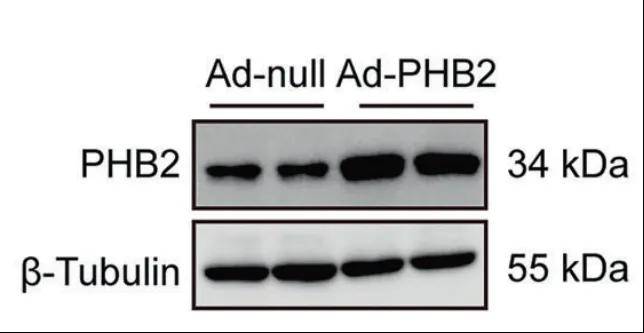
WB证实腺病毒转导后PHB2成功过表达
研究结果分享
1、PHB2过表达可以减轻体外心肌细胞肥大和体内心脏重塑
作者研究发现PHB2在人类扩张型心肌病(DCM)和实验性心肌肥大模型中表达下调。接下来,利用腺病毒在NRCMs中过表达PHB2,并使用Ang II处理细胞,发现PHB2过表达显著减小了心肌细胞大小,同时逆转了Ang II诱导的心脏肥大标志物水平的上调,表明PHB2对心肌细胞肥大具有明显的保护作用。利用AAV9-cTnT-PHB2在小鼠体内过表达PHB2,免疫印迹和荧光染色证实了PHB2在心肌细胞中特异性过表达。进一步采用TAC手术建立心肌肥大模型,4周后,发现PHB2过表达减轻了心肌肥大以及压力超负荷诱导的肥大,表明PHB2过表达有效地抑制了压力超负荷诱导的心脏重塑。此外,PHB2沉默加重了Ang II诱导的体外心肌细胞肥大。
1、PHB2过表达可以减轻体外心肌细胞肥大和体内心脏重塑
作者研究发现PHB2在人类扩张型心肌病(DCM)和实验性心肌肥大模型中表达下调。接下来,利用腺病毒在NRCMs中过表达PHB2,并使用Ang II处理细胞,发现PHB2过表达显著减小了心肌细胞大小,同时逆转了Ang II诱导的心脏肥大标志物水平的上调,表明PHB2对心肌细胞肥大具有明显的保护作用。利用AAV9-cTnT-PHB2在小鼠体内过表达PHB2,免疫印迹和荧光染色证实了PHB2在心肌细胞中特异性过表达。进一步采用TAC手术建立心肌肥大模型,4周后,发现PHB2过表达减轻了心肌肥大以及压力超负荷诱导的肥大,表明PHB2过表达有效地抑制了压力超负荷诱导的心脏重塑。此外,PHB2沉默加重了Ang II诱导的体外心肌细胞肥大。
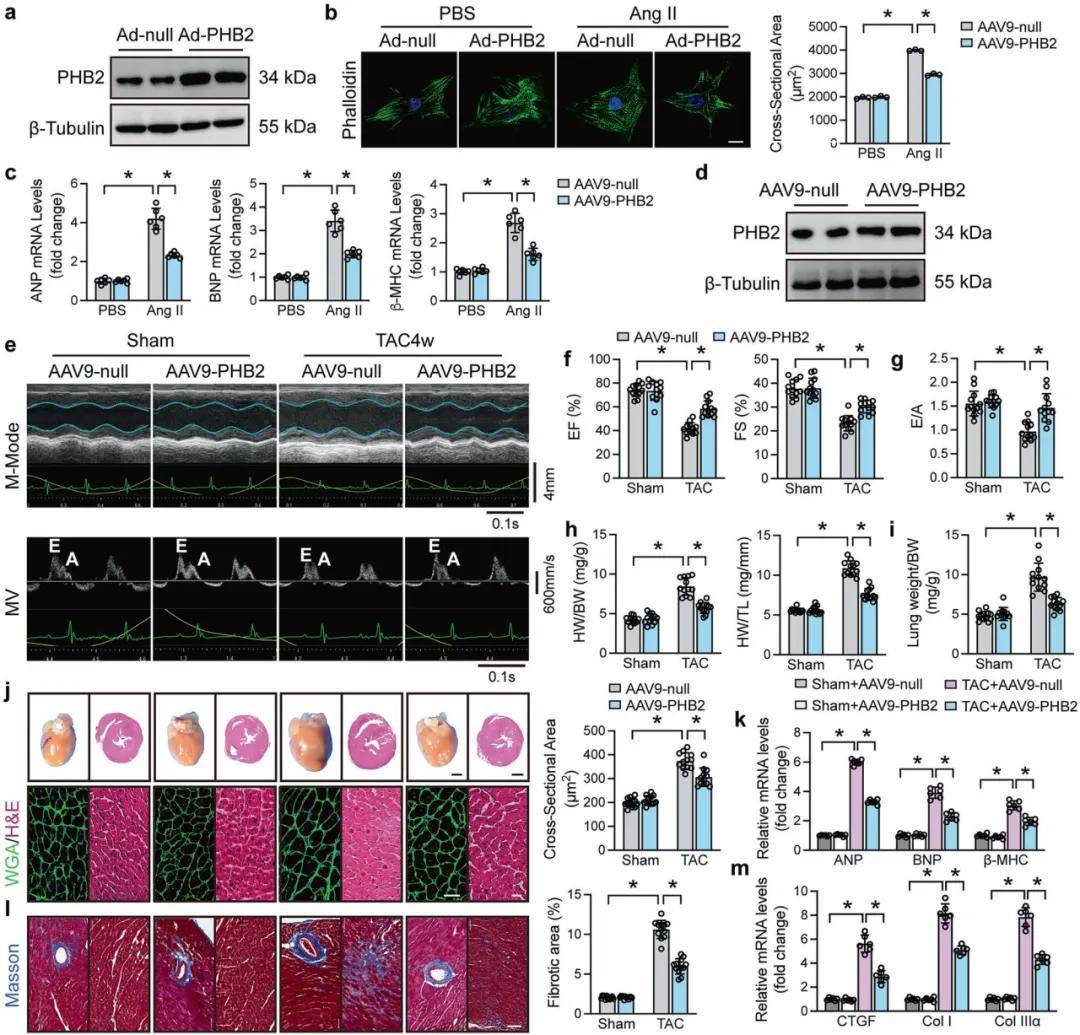
图1. PHB2过表达减轻了体外心肌细胞肥大和体内心脏重塑
2、PHB2过表达改善线粒体形态和功能
心肌肥大通常伴随着氧化应激的增加,作者发现PHB2过表达对心肌肥大期间的氧化应激具有保护作用。进一步使用TEM评估PHB2过表达对心脏线粒体超微结构的影响,发现上调PHB2通过防止线粒体嵴损伤来保护线粒体的完整性和功能。JC-1染色表明,PHB2过表达通过保持线粒体膜电位来减弱Ang II诱导的JC-1单体形成。此外,PHB2过表达显著减轻了Ang II诱导的线粒体ROS积累。线粒体能量产生与线粒体嵴密切相关,与Ang II治疗的对照组相比,PHB2过表达后线粒体功能增强,基础和最大呼吸能力以及ATP生成显著增加。此外,免疫印迹分析表明,PHB2过表达增加了Ang II处理样本中关键呼吸链成分(复合物I-V)的水平。
心肌肥大通常伴随着氧化应激的增加,作者发现PHB2过表达对心肌肥大期间的氧化应激具有保护作用。进一步使用TEM评估PHB2过表达对心脏线粒体超微结构的影响,发现上调PHB2通过防止线粒体嵴损伤来保护线粒体的完整性和功能。JC-1染色表明,PHB2过表达通过保持线粒体膜电位来减弱Ang II诱导的JC-1单体形成。此外,PHB2过表达显著减轻了Ang II诱导的线粒体ROS积累。线粒体能量产生与线粒体嵴密切相关,与Ang II治疗的对照组相比,PHB2过表达后线粒体功能增强,基础和最大呼吸能力以及ATP生成显著增加。此外,免疫印迹分析表明,PHB2过表达增加了Ang II处理样本中关键呼吸链成分(复合物I-V)的水平。
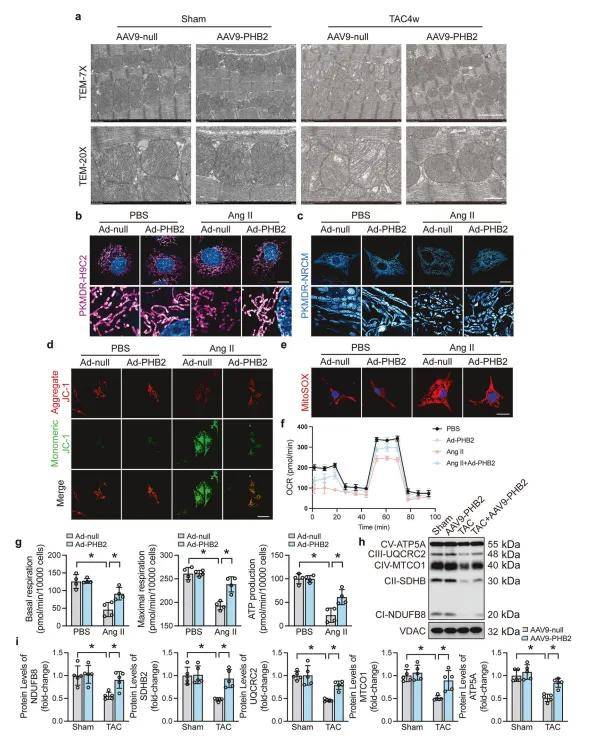
图2. PHB2过表达改善了线粒体形态和功能
3、PHB2过表达通过TOMM40依赖机制改善分离心肌细胞线粒体功能障碍
作者进一步研究了病理性心肌肥大期间PHB2介导的线粒体生物能量学调节的分子机制,根据全面的蛋白质相互作用分析,线粒体蛋白质导入机制的重要组成部分TOMM40可能与PHB2相互作用,并通过CO-IP证实了这一点,PHB2的5-101aa区域是其与TOMM40相互作用的关键结构域,PHB2过表达足以恢复TOMM40蛋白水平。进一步探究PHB2-TOMM40相互作用在心肌肥大中的功能意义,在心肌细胞中使用腺病毒过表达PHB2,并利用RNAi沉默TOMM40。结果表明PHB2与TOMM40起协同作用,增强线粒体功能,减轻心肌肥大。作者探究了PHB2与TOMM40的调节机制,发现PHB2通过泛素-蛋白酶体途径调节TOMM40水平。
作者进一步研究了病理性心肌肥大期间PHB2介导的线粒体生物能量学调节的分子机制,根据全面的蛋白质相互作用分析,线粒体蛋白质导入机制的重要组成部分TOMM40可能与PHB2相互作用,并通过CO-IP证实了这一点,PHB2的5-101aa区域是其与TOMM40相互作用的关键结构域,PHB2过表达足以恢复TOMM40蛋白水平。进一步探究PHB2-TOMM40相互作用在心肌肥大中的功能意义,在心肌细胞中使用腺病毒过表达PHB2,并利用RNAi沉默TOMM40。结果表明PHB2与TOMM40起协同作用,增强线粒体功能,减轻心肌肥大。作者探究了PHB2与TOMM40的调节机制,发现PHB2通过泛素-蛋白酶体途径调节TOMM40水平。
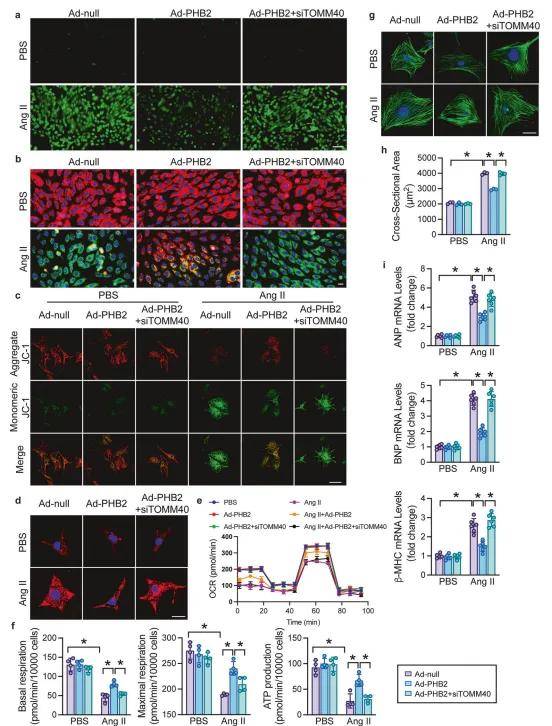
图3. PHB2过表达通过TOMM40缓解分离心肌细胞线粒体功能障碍
总结
本研究确定了PHB2是压力超负荷下线粒体功能和心脏重塑的关键调节因子,通过物理相互作用和翻译后调节稳定TOMM40。PHB2保护线粒体稳态,减轻氧化损伤,减轻TAC诱导的心脏重塑,显示出巨大的治疗潜力。本研究为PHB2在心脏病中的治疗潜力提供了新的见解,并为将PHB2视为有前景的心脏病治疗靶点奠定了基础。
本研究确定了PHB2是压力超负荷下线粒体功能和心脏重塑的关键调节因子,通过物理相互作用和翻译后调节稳定TOMM40。PHB2保护线粒体稳态,减轻氧化损伤,减轻TAC诱导的心脏重塑,显示出巨大的治疗潜力。本研究为PHB2在心脏病中的治疗潜力提供了新的见解,并为将PHB2视为有前景的心脏病治疗靶点奠定了基础。
相关文章
更多 >

