GeoMx DSP联合Stereo-seq助力揭示胃癌空间异质性与免疫逃逸机制
2025-10-21 来源:本站 点击次数:50
题目:Spatially Resolved Tumor Ecosystems and Cell States in Gastric Adenocarcinoma Progression and Evolution
期刊:Cancer Discovery
IF:33.3
DOI:10.1158/2159-8290.CD-24-0605
研究背景
胃癌是一类全球范围内高发且致死率高的消化系统恶性肿瘤。尽管近年来免疫治疗取得一定进展,但其疗效仍不稳定。究其原因,其核心问题在于胃癌组织内部存在高度的空间异质性。不同区域的免疫浸润、信号通路活性和肿瘤细胞状态可能由于完全不同,会导致临床治疗反应参差不齐。
为系统解析胃癌肿瘤系统的空间结构与功能状态,本研究联合使用GeoMx DSP空间转录组、Stereo-seq空间转录组以及10x单细胞转录组测序,多维度揭示胃癌组织表达状态的分子特征、空间定位规律及其与免疫逃逸机制的潜在联系,提出了G2(高增殖/低免疫浸润)表达状态作为肿瘤进化与免疫逃逸的关键节点。
技术手段
本研究整合GeoMx DSP空间转录组、Stereo-seq空间转录组以及10x单细胞转录组,系统描绘胃癌组织中肿瘤表达状态的异质性。研究通过GeoMx DSP识别肿瘤区域的表达亚型,结合单细胞测序解析肿瘤细胞功能特征及免疫微环境组成,并利用Stereo-seq验证胃癌组织的表达状态和空间定位特征。
主要发现
1.G1/G2表达状态揭示肿瘤细胞功能异质性
研究团队基于GeoMx DSP空间转录组平台,对胃癌全切片中的上千个肿瘤ROI区域进行表达谱分析,识别出两类显著的表达状态,命名为G1(低增殖/高免疫浸润)与G2(高增殖/低免疫浸润)。G1状态呈现低增殖、高免疫浸润的特征;而G2状态则富集细胞周期相关基因,缺乏免疫相关信号,表现为典型的“高增殖/免疫抑制”型。随后在TMA(组织芯片)中进行大样本验证,发现G2状态常出现在肿瘤边缘区域,且与肿瘤晚期分期、预后不良显著相关。这一发现表明,G2状态可能代表一种更具侵袭性、并能逃避免疫监视的肿瘤亚型。
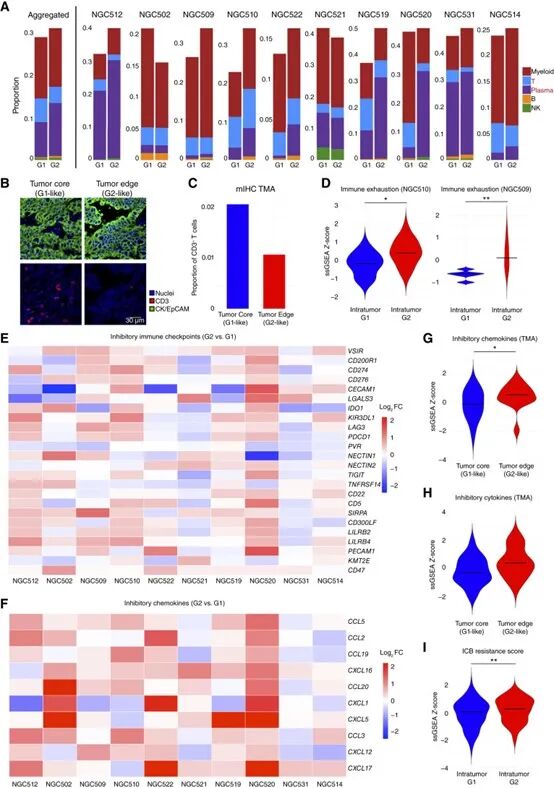 G1/G2的表达状态及其功能差异
G1/G2的表达状态及其功能差异2.G2状态源于肿瘤细胞表达转变
为了明确G2状态是源自肿瘤细胞本身,还是受到微环境影响,研究者对多个样本开展了单细胞转录组测序。结果显示,G2特征基因主要在肿瘤细胞簇中富集,而非来源于免疫或间质成分,确认该表达状态属于肿瘤细胞内在转录特征。同时,处于G2状态的肿瘤区域普遍表现出免疫浸润降低、免疫抑制通路增强等现象,进一步提示其与免疫逃逸密切相关。
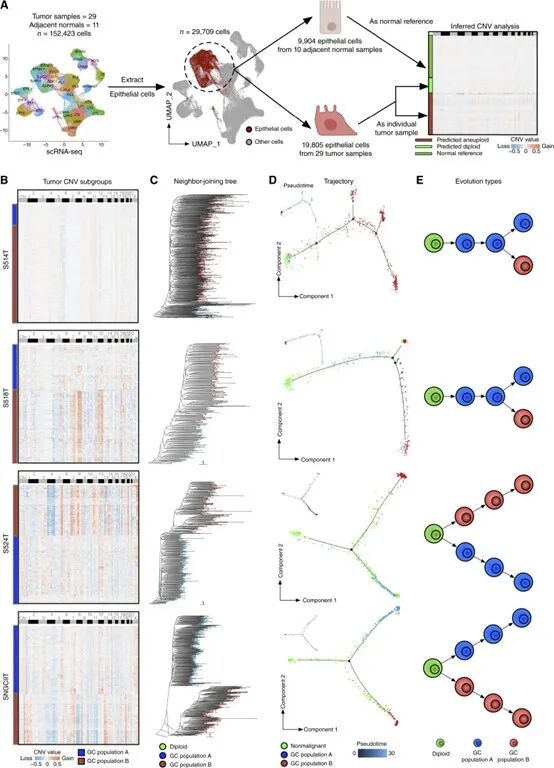 单细胞转录组证实G2状态源自肿瘤细胞表达转变
单细胞转录组证实G2状态源自肿瘤细胞表达转变3.G2状态呈边缘富集,表现出空间结构性
通过Stereo-seq空间转录组平台,研究者在原发肿瘤切片中以近单细胞分辨率绘制空间表达图谱,发现G2状态的肿瘤细胞倾向于分布在肿瘤与间质交界区域。该区域不仅富含成纤维细胞与免疫抑制细胞,还呈现出免疫细胞缺乏、ECM(细胞外基质)重构等特征,形成典型的免疫抑制微环境。这表明肿瘤的表达状态与空间位置之间存在紧密联系,边缘生态位可能是诱导G2状态形成的关键区域。
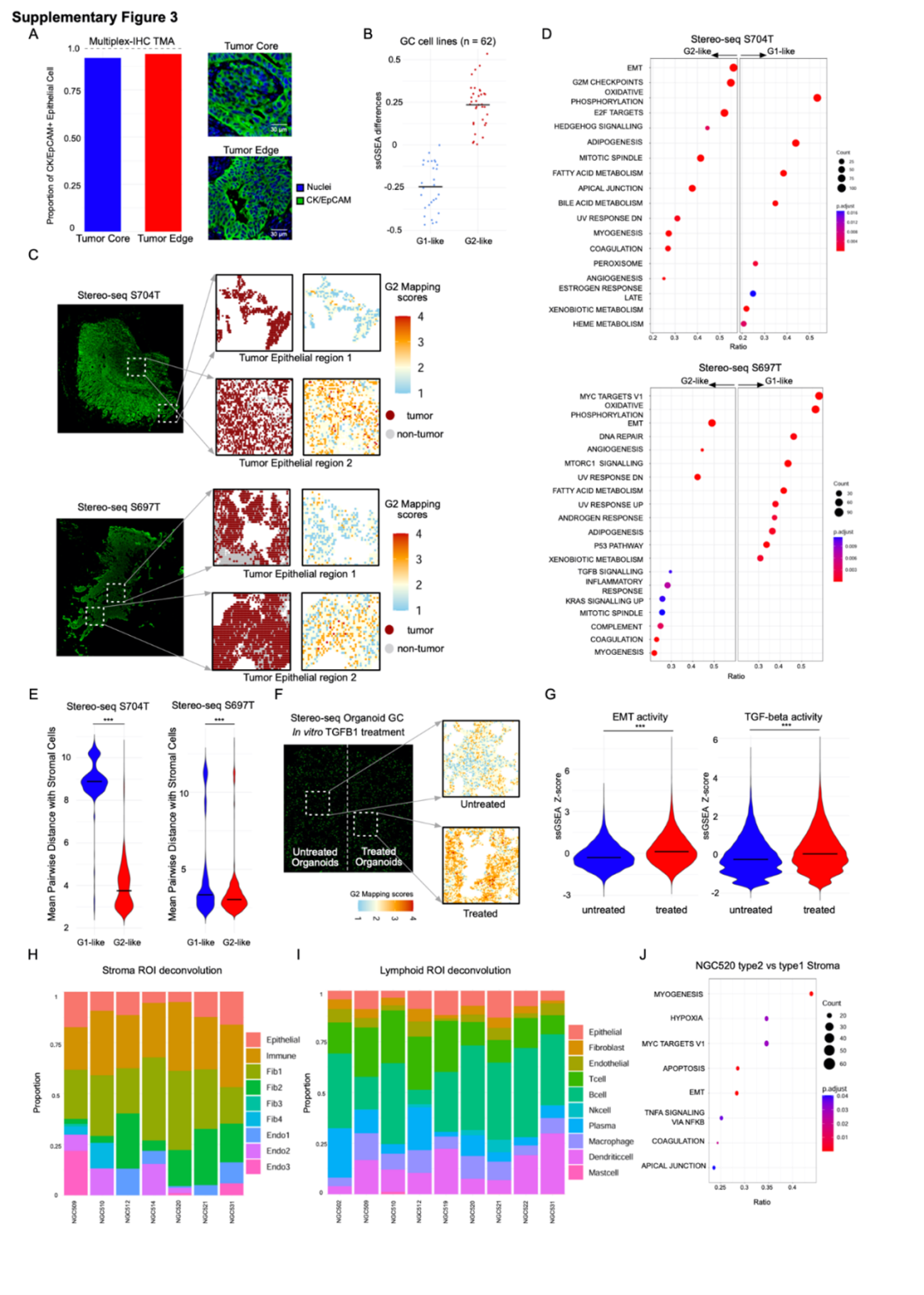 Stereo-seq揭示G2状态呈边缘富集
Stereo-seq揭示G2状态呈边缘富集4.类器官实验揭示G2状态具有诱导性与可塑性
为了验证G2状态是否为可诱导、可逆转的表达程序,研究者在体外构建了胃癌类器官模型,并施加TGFB1信号模拟微环境刺激。实验发现,TGFB1处理可使原本处于G1状态的类器官逐渐获得G2状态特征,包括细胞增殖基因上调与免疫相关基因下调。这一结果说明,G2状态具有动态可塑性,其形成不仅源自肿瘤细胞内在特性,也受到微环境调控,为未来靶向干预提供了理论依据。
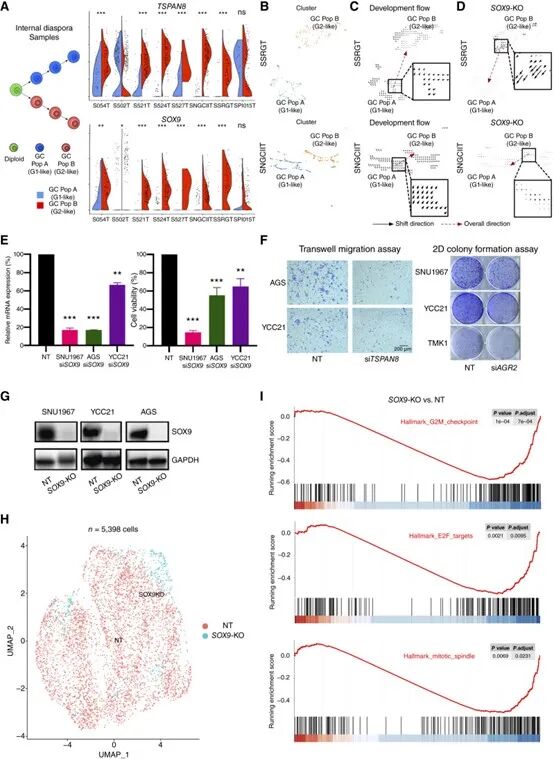 G2状态的驱动因子筛选与功能验证
G2状态的驱动因子筛选与功能验证文章总结
本研究通过系统整合多种空间与单细胞组学平台,建立了一个从分子状态识别 → 空间定位 → 细胞来源追溯 → 可塑性机制验证的完整分析路径,首次明确了胃癌中G2表达状态作为“进化型/免疫逃逸型”肿瘤特征的重要地位。研究提示:靶向G2相关通路或抑制其诱导信号,可能成为提高胃癌免疫治疗响应率的潜在方向。

