空间组学技术助力高精度解析肺纤维化空间演化路径
2025-07-08 来源:本站 点击次数:122
题目:Spatial transcriptomics identifies molecular niche dysregulation associated with distal lung remodeling in pulmonary fibrosis.
期刊:Nature genetics
IF:29
Doi: 10.1038/s41588-025-02080-x
研究背景
肺纤维化(PF)是一类进展性肺部疾病,表现为远端肺组织结构和细胞组成的大规模改变。特发性肺纤维化(IPF)是其中最常见且最严重的类型,患者预后极差,多数在诊断后3至5年内死亡或需肺移植,现有的治疗手段仅能部分减缓病情。
IPF的病理特点具有显著的空间异质性,纤维化严重的病灶常与结构相对完整的肺泡结构相邻存在,表现为病变非同步发展。此外,IPF肺中常出现异常的近端上皮化生、黏液囊性结构及纤维母细胞灶,这些现象共同推动疾病进展。
IPF病变在空间上存在多条并行的病理进程,从空间上理解细胞分布及分子间相互作用极为关键。传统的多组学技术难以揭示肺组织的细胞复杂性和空间异质性,本研究采用高细胞分辨率的空间转录组技术,系统地解析了肺纤维化病灶的空间组织架构和分子演变轨迹,揭示了肺纤维化过程中多阶段、多路径的并行演化过程。
主要结论
1.空间原位测序绘制肺组织图谱及纤维化特征
利用空间原位检测技术,研究团队对45个远端肺组织样本进行了亚细胞级的空间表达分析,绘制了覆盖47种细胞类型、超过160万个细胞的肺组织图谱。识别出肺纤维化过程中多种关键的细胞状态及其空间分布特征:包括位于纤维化区域边缘的 KRT5⁻/KRT17⁺ 转化型上皮细胞,与邻近的 CTHRC1⁺/FAP⁺ 激活型成纤维细胞,它们在疾病早期形成了组织结构重塑的关键区域。同时,晚期病灶中发现的 SPP1⁺ 巨噬细胞在空间上逐渐取代了原有的 FABP4⁺ 亚群,反映了免疫细胞组成的动态调整和重塑过程。
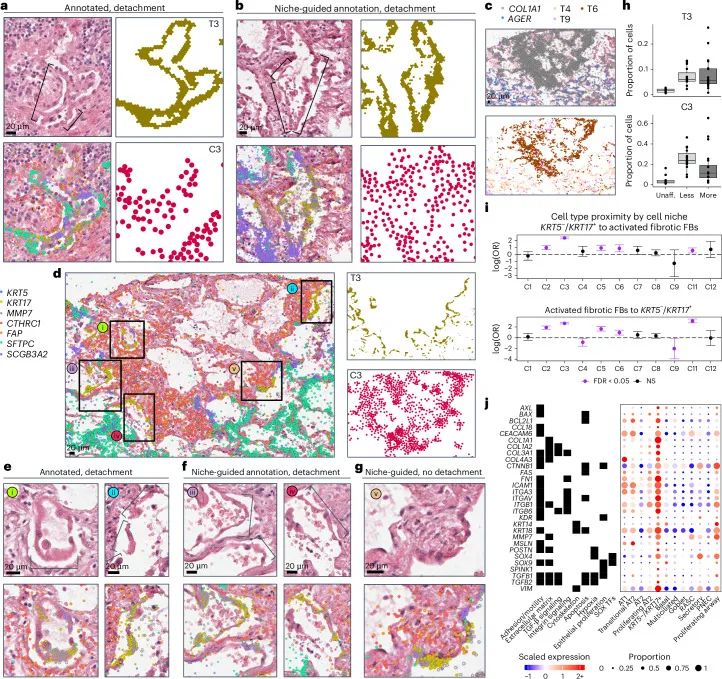 肺纤维化中KRT5⁻/KRT17⁺转化型上皮细胞在纤维化区域边缘的空间定位与脱离特征
肺纤维化中KRT5⁻/KRT17⁺转化型上皮细胞在纤维化区域边缘的空间定位与脱离特征2.Visium HD验证成纤维细胞与其他细胞之间的空间分布特征
为进一步验证所发现的空间表达模式,研究团队选取其中两例样本,利用 Visium HD空间转录组平台进行补充验证。结果显示,在纤维化前缘区域,Visium HD 明确复现了 KRT17⁺ 上皮细胞与 CTHRC1⁺ 成纤维细胞的空间共定位,印证了前期所揭示的早期组织的重塑区域。此外,Visium HD 同样检测到 FABP4⁺ 与 SPP1⁺ 巨噬细胞在不同病灶区域的空间分布差异,显示 FABP4⁺ 与 SPP1⁺ 巨噬细胞在不同病灶区域呈现出明显的空间分布差异,反映免疫细胞群体组成和功能状态随着疾病进展发生阶段性变化。
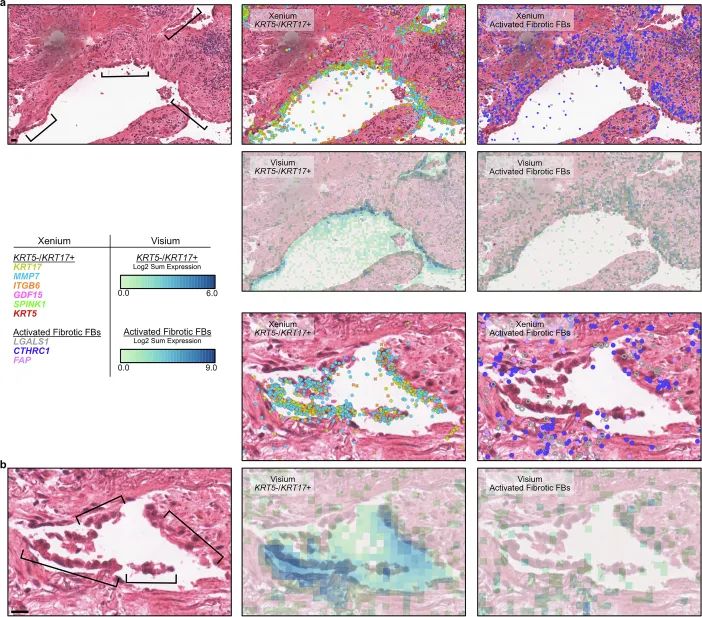 Visium HD验证的肺纤维化生态位中KRT5⁻/KRT17⁺细胞空间脱离
Visium HD验证的肺纤维化生态位中KRT5⁻/KRT17⁺细胞空间脱离3.机器学习构建肺纤维化的空间级疾病进程模型
在此基础上,研究团队进一步引入机器学习算法,对肺泡结构进行自动识别与空间重建,并结合细胞状态与空间分布的层级关系,构建出一条从健康肺泡 → 上皮增殖 → 细胞转化 → 成纤维活化 → 晚期免疫浸润的空间“伪时间”演化轴(基于空间结构排序+细胞状态演变构建的空间轨迹),清晰地描绘出肺纤维化多阶段、多路径并行演化的过程。综合分析多种细胞的空间分布与转录状态,研究明确了上皮细胞转化、成纤维细胞扩增及免疫谱系转换在空间层级中的时间序列及相互联系,构建了肺纤维化的空间级疾病进程模型,加深了对肺纤维化病理异质性形成机制的理解。
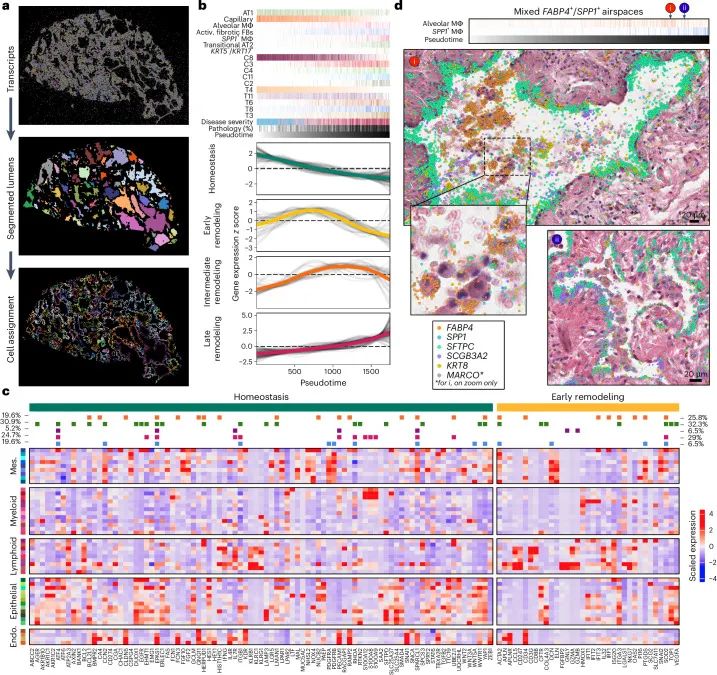 基于空间单元分辨率的肺泡重塑
基于空间单元分辨率的肺泡重塑文章总结
本研究利用空间组学平台,结合机器学习算法,实现了对特发性肺纤维化中多种细胞类型的精细描绘,同时揭示了其亚细胞级的空间分布特征。通过系统分析肺纤维化过程中关键细胞群的空间定位及动态变化,揭示了肺泡结构重塑的多阶段空间进展过程和多条并行的纤维化进展机制。研究突破了传统线性病程模型的局限,提供了肺纤维化在多个空间微环境中并行发展的新证据,也为精准分型和靶向治疗提供了重要的空间分子依据。

