空间多组学助力还原边界性卵巢癌建立侵袭的能力
2025-07-23 来源:本站 点击次数:228
题目:Spatial proteo-transcriptomic profiling reveals the molecular landscape of borderline ovarian tumors and their invasive progression
期刊:Cancer Cell
IF:44.5
DOI:10.1016/j.ccell.2025.06.007
研究背景
低级别浆液性卵巢癌(LGSC)是一类起源于浆液性边界性肿瘤(SBT)的惰性恶性肿瘤,临床表现为生长缓慢、转移广泛,但对传统化疗反应差、预后差。尽管SBT与LGSC共享部分突变特征(如KRAS/BRAF/ERBB2),但两者之间具体的转化路径和调控机制仍不清楚,尤其是SBT中部分具有微乳头结构的中间态病灶是否预示着更高风险,以及浸润性LGSC如何在空间层面逐步建立侵袭能力。
本研究采用空间转录组平台GeoMx DSP和空间蛋白组平台,系统地描绘了SBT向LGSC演化的空间分子图谱,并聚焦于上皮细胞、肿瘤基质及其交互的空间转录特征,重构恶性肿瘤进展过程中的关键通路及潜在靶点,为转化性治疗策略提供了新的分子依据。
实验设计与技术手段
研究纳入来自多位患者的代表性卵巢肿瘤样本,覆盖浆液性肿瘤演化过程中的关键阶段,包括:
边界性浆液性肿瘤(SBT):4位患者;
微乳头型SBT(SBT-MP):4位患者,具有更高癌变风险的中间态;
原发性低级别浆液性癌(LGSC-PT):3位患者;
转移性LGSC(LGSC-Met):来自3位LGSC-PT患者的配对转移灶,主要分布于网膜等远端区域。
所有样本采用连续切片,在空间蛋白组平台分析特定细胞类型(上皮和 基质)的蛋白表达谱,以及在GeoMx DSP平台上选取特征区域(ROI),分别对上皮区与基质区进行空间转录分析。通过对比不同病理阶段和组织区域之间的表达差异,构建空间演化轨迹,并识别关键通路与潜在靶点。
主要发现
1. 边界性肿瘤向低级别浆液性癌的空间分子演化路径
研究明确描绘了从SBT → 微乳头型SBT(SBT-MP)→ LGSC → 转移灶的一条空间演化路径。特别是在SBT-MP阶段,空间转录组数据显示,MAPK通路、c-MET 以及ERF、SRC等促迁移信号显著上调,为后续恶性转化奠定基础。
空间表达模式显示,从SBT到LGSC,肿瘤上皮区域逐步激活促增殖与促迁移基因簇,提示SBT-MP具有明确的“癌变中间体”特征。
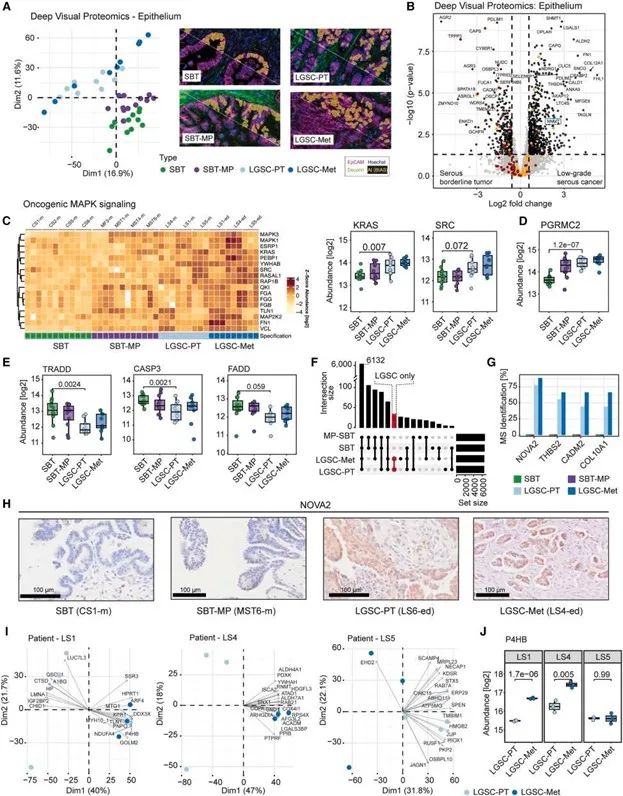 边界性肿瘤向LGSC演化的空间路径
边界性肿瘤向LGSC演化的空间路径2. 癌细胞与基质细胞协同进化,形成跨区室的促迁移信号网络
在LGSC进展过程中,空间转录组揭示了肿瘤上皮细胞与基质细胞间的动态联动变化,形成协同的促迁移状态:上皮细胞出现类神经特征基因(如NOVA2、SNCG、SLIT2)的激活,提示其获得类似神经迁移的功能;基质区域显著富集成纤维细胞活化相关基因(如NNMT、MMP14、SPARC),提示形成促癌CAF表型;上皮与基质间形成互作配对(如FN1–整合素、MMP14–SDC1等),构建促迁移信号轴,空间邻接区域表达高度协同。
这一空间信号协作网络说明,LGSC并非癌细胞单独演化的结果,而是肿瘤----基质间长期协同作用塑造的结果。
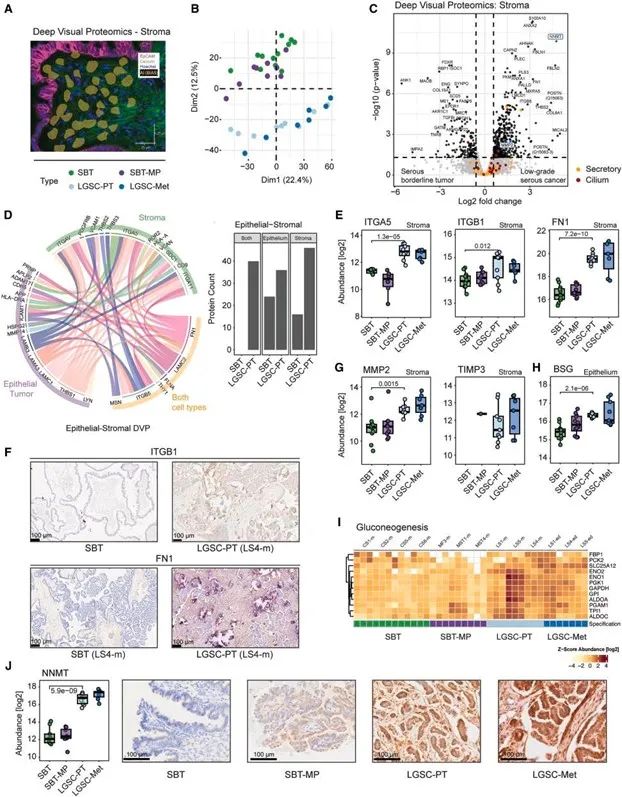 上皮细胞–基质细胞协同构建迁移信号网络
上皮细胞–基质细胞协同构建迁移信号网络3. 识别CDK4/6与FOLR1为可转化治疗靶点,联合治疗显著抑制LGSC进展
结合空间表达趋势与多组学整合分析,研究锁定了两个高表达的潜在治疗靶点:CDK6 与 FOLR1。在LGSC小鼠模型中,CDK4/6抑制剂 milciclib 与 FOLR1抗体偶联药物 mirvetuximab soravtansine 联合使用,显著抑制肿瘤体积、腹水及远端转移。研究提供了具有临床可转化前景的靶向组合方案,尤其适用于当前缺乏有效治疗方案的LGSC患者。
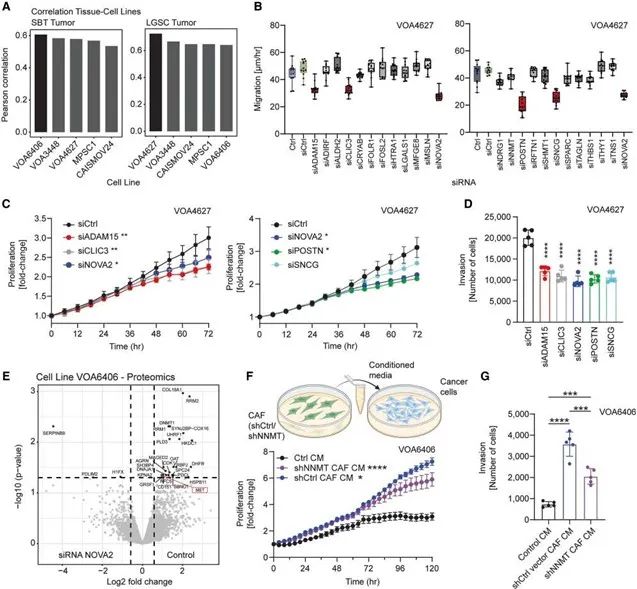 CDK6与FOLR1联合靶向治疗验证
CDK6与FOLR1联合靶向治疗验证总结
本研究借助GeoMx DSP空间转录组平台和空间蛋白检测技术,首次系统构建了SBT向LGSC进展的多阶段空间图谱。揭示了微乳头结构在转化过程中的生物学意义,发现肿瘤与基质细胞通过空间协同演化形成促迁移信号轴,并识别出可被药物靶向的关键分子,如NOVA2、NNMT、FOLR1等。研究不仅深化了对LGSC空间病理机制的理解,也为临床上精准识别高危SBT病灶与个性化治疗提供了全新思路与空间分子依据。

