机械超负荷经 Piezo1 促进钙内流诱导GPX4 调节的软骨细胞铁死亡
2025-09-03 来源:本站 点击次数:137Mechanical overloading induces GPX4-regulated chondrocyte ferroptosis in osteoarthritis via Piezo1 channel facilitated calcium influx
Keywords: Chondrocytes, Osteoarthritis, Ferroptosis, Mechanical stress, Piezo1
机械刺激(尤其是高应变机械应力)会导致软骨细胞分解代谢和死亡,与骨关节炎(OA)发病相关,而 OA 作为常见退行性关节疾病,其诱发因素和机制尚不明确。细胞死亡(尤其是程序性细胞死亡)与衰老相关,其中铁死亡是一种以磷脂氧化损伤为特征的坏死性细胞死亡形式,GPX4 通过谷胱甘肽合成调控铁死亡,Fsp1 则借助辅酶 Q10 抵御 GPX4 相关铁死亡。Piezo1 作为机械敏感性钙离子通道,其激活与细胞死亡及软骨退变相关,且在机械刺激引发的钙内流和细胞生物物理变化中起重要作用。
基于此,山东大学齐鲁医院骨科的研究团队为了探究铁死亡与骨关节炎的关联及相关机制,通过构建GPX4 条件性敲除小鼠模型和高应变培养的软骨细胞进行研究。研究成果发表在Journal of advanced research期刊题为“Mechanical overloading induces GPX4-regulated chondrocyte ferroptosis in osteoarthritis via Piezo1 channel facilitated calcium influx”。

首先,为了探究机械应力介导的铁死亡在骨关节炎(OA)发展中的作用,研究人员从 OA 患者全膝关节置换术中的负荷区和非负荷区收集软骨样本,发现负荷区软骨损伤更显著(图 1A),图 1B 中的 X 射线显示膝关节负荷区存在集中负荷(红色箭头),且该区域软骨细胞的线粒体呈现铁死亡特征(如膜增厚)(图 1C)。微阵列分析显示,负荷区软骨细胞中铁死亡标志物 GPX4 的水平较非负荷区降低,且与衰老相关分子趋势一致(图 1D )。
为了研究机械刺激对软骨细胞铁死亡的直接影响,研究人员对原代小鼠软骨细胞施加 1 MPa、1 Hz 的机械应力下培养 1 小时,随后继续培养 24 小时并进行 TEM 观察 ,发现其线粒体出现铁死亡相关结构变化(图 1E ),经机械应力刺激的软骨细胞中 GPX4 水平(红色箭头)降低(图 1F )。进一步检测发现高应变负荷降低了 GPX4 的 mRNA(图 1G)和蛋白(图 1H-1I)水平 ,免疫荧光染色也证实高应变负荷导致 GPX4 水平降低(图 1J-1K)。此外,在小鼠内侧半月板失稳(DMM)模型中,关节软骨表层区的 GPX4 水平较对照组显著降低(图 1L-1M)。
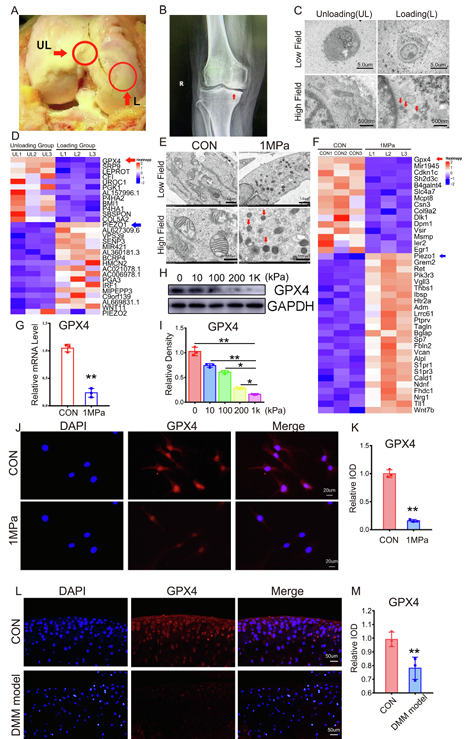
图1 过度的应力负荷会导致软骨细胞发生铁死亡。
接着,研究人员通过建立他莫昔芬诱导的软骨细胞特异性 GPX4 条件性敲除(GPX4-CKO)小鼠模型,探究 GPX4 在关节软骨中的作用。与 GPX4+/+(野生型,WT)同窝小鼠相比,该模型小鼠发育正常,无骨骼异常(图 2A-2D)。经他莫昔芬处理后软骨细胞中 GPX4 成功敲除(图 2E)。此后,在注射他莫昔芬的 12 周龄 GPX4-CKO 小鼠和 WT 小鼠中建立DMM模型(图 2F)。
在建立DMM模型两个月后,与WT小鼠相比,GPX4-CKO 小鼠膝关节骨赘形成更多(图 2G-2H),番红O 染色及组织学分析显示其 OA 进展更严重(图 2I-2M)。同时,GPX4 缺陷小鼠的软骨合成代谢标志物(聚集蛋白聚糖、Col2)表达降低,分解代谢标志物(MMP13、ADAMTS-5)表达升高(图 2N-2O)。
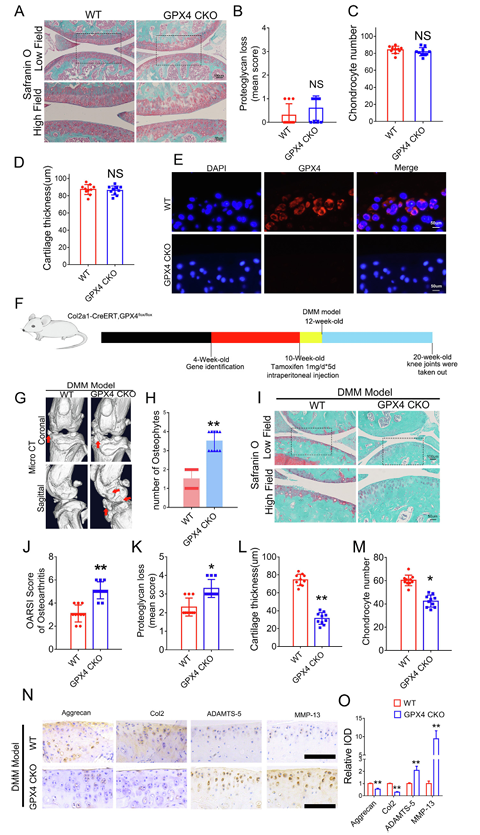
图2 与 GPX4 相关的铁死亡会加剧 OA 的发展。
为了探究 Piezo1 通道是否参与机械过载诱导的铁死亡,研究人员对野生型小鼠原代软骨细胞施加高应变机械负荷并辅以 Piezo1 抑制剂 GsMTx4 处理。结果显示,机械刺激诱导钙内流,GsMTx4 可缓解(图 3A-3B)。GsMTx4 抑制 Piezo1 能减少机械刺激导致的细胞死亡(图 3C-3D)。机械过载降低 GSH 表达(图 3E) 、诱导线粒体铁死亡损伤(图 3F),GsMTx4 可减轻这些变化。机械过载还会增加 ROS 产生(图 3G-3H)、损害线粒体膜电位(图 3I-3J),减弱线粒体活性(图 3K-3L),GsMTx4 对 Piezo1 的抑制可逆转这些变化。同时,机械过载降低 GPX4 表达并损害软骨细胞代谢(图 3Q-3R)。
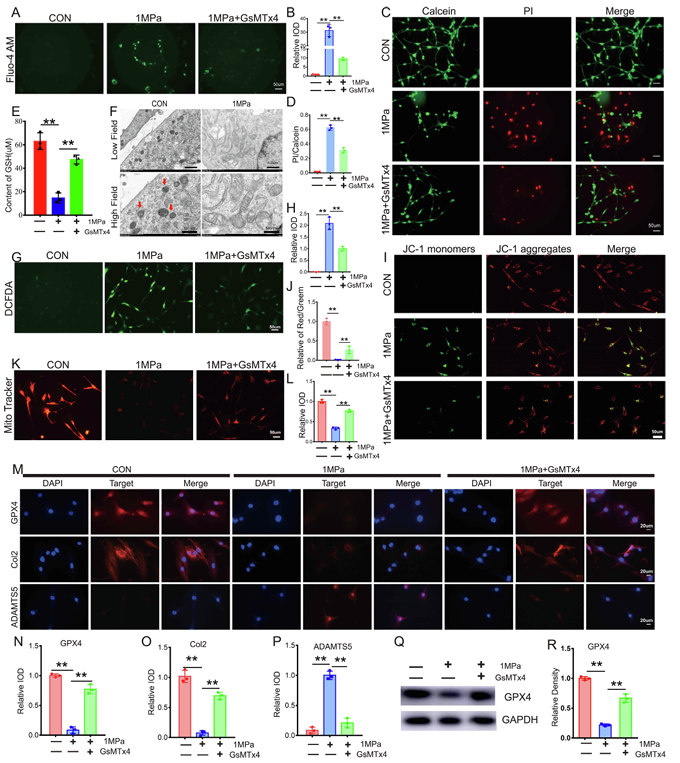
图3 机械过载通过 Piezo1 离子通道诱导软骨细胞发生铁死亡。
为了进一步探究 Piezo1 在OA发展中的作用, 研究人员构建了DMM 骨关节炎小鼠模型。结果表明,关节内注射 Piezo1 抑制剂 GsMTx4 可减轻模型小鼠膝关节的骨赘形成(图 4B-4C),改善软骨老化及 OARSI 评分(图 4D-4E),维持软骨中 GPX4 的水平(图 4F-4G)。此外,关节软骨的免疫组织化学结果显示,在 DMM 模型中,GsMTx4 处理可增加合成代谢生物标志物(聚集蛋白聚糖和 Ⅱ 型胶原)的表达,并抑制分解代谢分子(ADAMTS-5 和 MMP-13)的产生(图 4H-4I)。

图4 抑制 Piezo1 可减轻 DMM 骨关节炎模型中的软骨老化。
接下来,为了研究 GPX4 与 Piezo1 通道在机械过载致软骨细胞损伤中的相互作用,研究人员通过敲低 GPX4 软骨细胞进行探究。结果证实,软骨细胞中 GPX4 的敲除效率较高(图 5A-5E)。实验发现,GsMTx4 虽能缓解机械过载引起的钙内流(图 5F-5G)。然而,无论是否抑制 Piezo1 通道,细胞死亡率均无显著差异(图 5H-5I)。机械应力仍会降低谷胱甘肽(GSH)的表达(图 5J),但由于 GPX4 表达不足,GsMTx4 无法维持 GSH 含量。 在 GPX4 缺失情况下,抑制 Piezo1 通道无法减少 机械过载诱导 的ROS 产生(图 5K-5L) 以及无法改善软骨细胞代谢(图 5M-5O)。GPX4 敲低会削弱 GsMTx4 对机械过载介导的线粒体膜电位损伤(图 5P-5Q)和线粒体破坏(图 5R-5S)的保护作用。
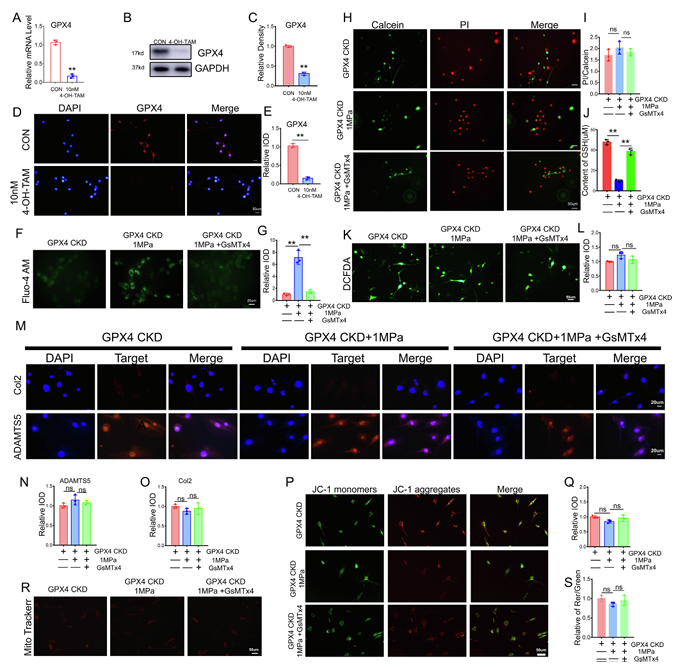
图5 在 GPX4 缺陷小鼠中,抑制 Piezo1 通道无法逆转机械过载诱导的软骨细胞损伤。
最后,鉴于紊乱的钙内流可引发铁死亡且机械过载诱导软骨细胞铁死亡时伴随钙离子内流增加,研究通过使用无钙培养基培养野生型小鼠软骨细胞,探究钙离子是否为机械过载诱导铁死亡所必需。结果表明,无钙环境下机械刺激不会引发明显钙内流图 6A-6B),且能大幅降低软骨细胞死亡率(图 6C-6D)。抑制钙内流后, 可以维持谷胱甘肽水平(图 6E),减少活性氧产生(图 6F-6G),减轻线粒体损伤(图 6H-6I)并维持其膜电位(图 6J-6K)。在应对机械过载时,钙内流的缺失还能维持 GPX4 水平,减少分解代谢生物标志物产生并促进合成代谢生物标志物分泌(图 6M-6R)。

图6 机械刺激诱导软骨细胞发生铁死亡需要钙内流的参与。
总之,本研究阐述了机械过载在软骨细胞中作用的潜在机制:机械过载通过激活 Piezo1 并随后引发软骨细胞内的钙内流,从而诱导铁死亡。这些信息可能为骨关节炎及其他软骨退行性疾病的潜在治疗干预提供思路。
参考文献:Wang S, Li W, Zhang P, Wang Z, Ma X, Liu C, Vasilev K, Zhang L, Zhou X, Liu L, Hayball J, Dong S, Li Y, Gao Y, Cheng L, Zhao Y. Mechanical overloading induces GPX4-regulated chondrocyte ferroptosis in osteoarthritis via Piezo1 channel facilitated calcium influx. J Adv Res. 2022 Nov;41:63-75. doi: 10.1016/j.jare.2022.01.004. Epub 2022 Jan 11. PMID: 36328754; PMCID: PMC9637484.
原文链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC9637484/
Impact Factor: 13
ISSN: 2090-1224 (Electronic); 2090-1232 (Print)
图片来源: 所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:仿生压力细胞培养仪

