异常流体剪切应力经H3K4me3对ZBTB20遗传调控促进关节软骨发病机制
2025-09-03 来源:本站 点击次数:117Aberrant Fluid Shear Stress Contributes to Articular Cartilage Pathogenesis via Epigenetic Regulation of ZBTB20 by H3K4me3
Keywords: osteoarthritis, fluid shear stress, H3K4me3, epigenetic, cartilage degeneration
骨关节炎(OA)作为一种常见的退行性关节疾病,病理机制复杂,涉及软骨降解、滑膜炎症、软骨下骨硬化等多个方面,严重影响人类生活质量。但由于对其进展机制缺乏全面了解,当前治疗手段仅能缓解症状或延缓进展,晚期需依赖关节置换手术,因此阐明 OA 发病的潜在机制对探索创新治疗方法至关重要。
关节软骨作为与外力相关的生物力学部位,其发病与机械负荷密切相关,生理状态下软骨细胞会承受日常活动带来的应力、应变等,而异常机械过载则可能导致软骨细胞凋亡、细胞外基质退化,进而引发 OA。其中,流体剪切应力(FSS)是关键的生理和病理因素,较低的剪切应力具有软骨保护作用,较高的剪切应力则会诱导炎症反应、促进基质降解酶表达,导致 OA 样病理特征。鉴于软骨组织修复和再生能力有限,深入研究 FSS 诱导 OA 发病的潜在机制具有重要意义。
近年来,表观遗传改变因其可介导多种病理反应而受到广泛关注,其中组蛋白的甲基化、磷酸化、乙酰化等修饰会调控参与疾病发生发展的关键基因,例如 NSD3 组蛋白甲基化活性升高可驱动肺鳞状细胞癌恶性进展,提示了相关治疗策略的潜力。对于骨关节炎,已有研究发现组蛋白去乙酰化酶(HDAC)表达异常,暗示调节特定 HDAC 活性可能成为治疗 OA 的方向,另有研究证实 EZH2 可通过促进 miR-138 启动子的组蛋白甲基化抑制其表达,进而抑制 OA 进展。然而,尽管多项研究提示表观遗传在 OA 发病中具有潜在作用,但其详细调控机制、基于表观遗传的治疗靶点,尤其是与机械力相关的 OA 发病中的表观遗传调控具体机制仍不明确。
因此,上海交通大学医学院附属第九人民医院口腔正畸科的研究团队通过体外FSS 模型和体内单侧前牙反合(UAC)小鼠模型,明确异常 FSS 对原代软骨细胞的影响,阐明 H3K4me3 在异常 FSS 诱导 OA 中的作用,同时探究表观遗传调控在机械相关软骨发病中的作用,以及靶向表观遗传事件作为未来治疗策略的可能性。研究成果发表在Journal of inflammation research期刊,题为“Aberrant Fluid Shear Stress Contributes to Articular Cartilage Pathogenesis via Epigenetic Regulation of ZBTB20 by H3K4me3 ”。

首先,研究人员对原代软骨细胞施加 20 达因 / 平方厘米的流体FSS 并处理 2 小时,以探究异常高剪切应力的影响。结果显示,FSS 会显著破坏细胞形态(表现为 F - 肌动蛋白排列不规则)(图 1A),且通过 EdU 染色发现,FSS 作用下的原代软骨细胞增殖能力和活力均有所下降(图 1B)。
然后,研究人员进一步研究了 FSS 对软骨相关标志物、分解代谢反应、炎症相关因子及细胞外基质降解的影响。结果显示:FSS 处理后,软骨相关标志物 Sox9、Acan、Col2 的 mRNA 水平显著下调,而肥大相关标志物(如 Col10、Cox-2 、Adamts4 和 Adamts5 )、多种基质金属蛋白酶(包括 Mmp3、Mmp9 和 Mmp13 )及典型炎症因子(TNF-α、IL-1β 和 IL-6 )均显著上调。蛋白质印迹和免疫荧光实验也证实,FSS 会抑制 COLII 和 SOX9 的表达,升高 COX-2 和 MMP13 的水平(图 1D )。免疫荧光实验也一致显示,异常 FSS 对原代软骨细胞具有负向调控作用(图 1E)。
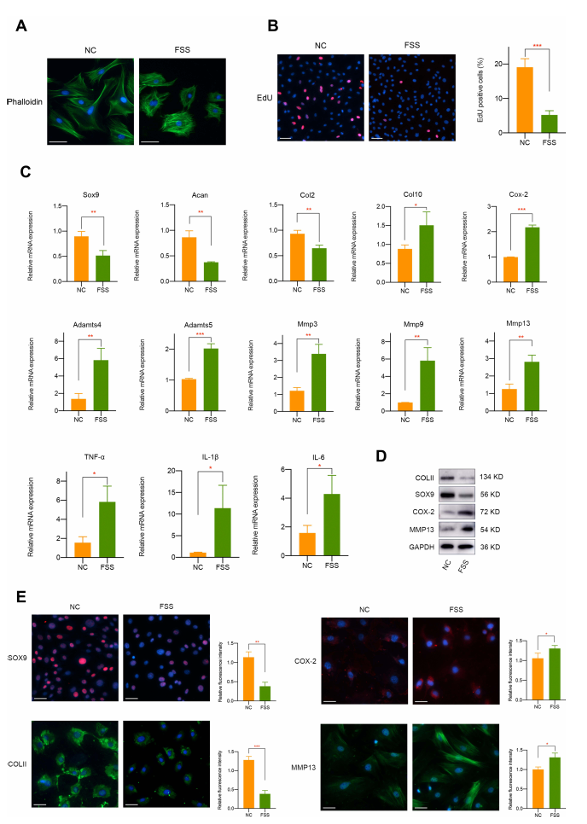
图 1 异常流体剪切应力(FSS)对原代软骨细胞的生物学影响。
接着,由于组蛋白甲基化是基因表达中最重要的表观遗传调控方式之一,研究人员检测了经 FSS 处理的软骨细胞中主要的组蛋白甲基化修饰(H3K4me3、H3K9me3、H3K27me3、H3K36me3 和 H3K79me3)。结果显示 ,FSS 处理后 H3K4me3 显著过表达,而 H3K27me3 表达受抑制(图 2A ),且免疫荧光实验证实 FSS 会使软骨细胞中 H3K4me3 显著上调(图 2B)。由于 H3K4me3 与基因激活密切相关,研究进一步探究其激活机制,结果显示 FSS 处理后组蛋白甲基转移酶 Kmt2b 的 mRNA 表达及 KMT2B 蛋白水平均明显升高(图 2C和图 2D),表明FSS 可能通过上调 KMT2B 来激活 H3K4me3。
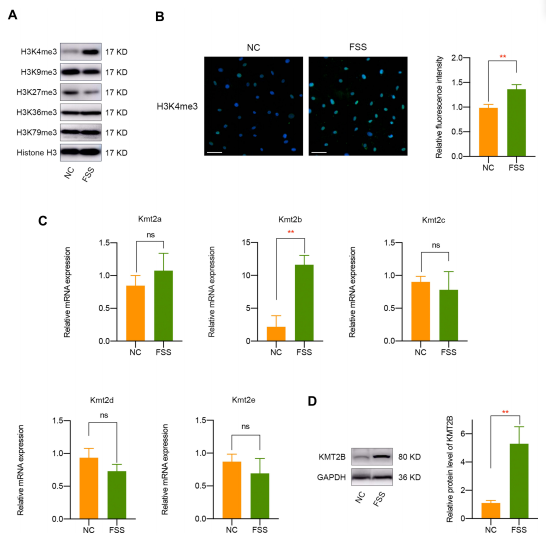
图2 FSS 导致 H3K4me3 激活和 KMT2B 上调。
由于H3K4me3 激活在 OA 中起重要作用,研究人员用 MM-102 抑制其活性进行探究。实验先用 20μM MM-102 预处理细胞 24 小时,再用常用于模拟软骨细胞凋亡的SNP(500μM)孵育,结果显示 MM-102 预处理减轻了 SNP 对软骨细胞的凋亡刺激(图 3A)。更重要的是,MM-102 预处理有效逆转了 FSS 对软骨细胞的负面影响,这为基于表观遗传学的 OA 治疗提供了基础(图 3B 和3C)。
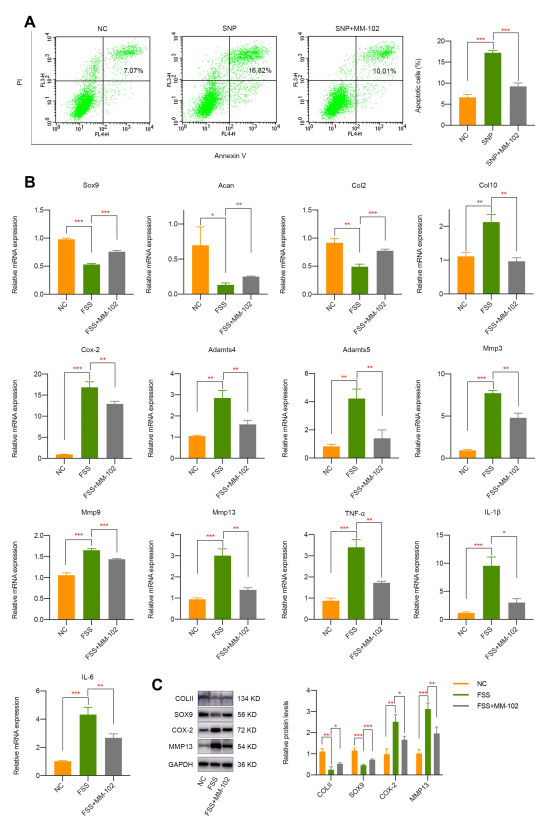
图3 通过 MM-102 药理学抑制 H3K4me3 激活可部分逆转 FSS 对软骨细胞的负面影响。
接下来,为了探究 FSS 诱导 OA 的分子机制,研究人员先通过转录组分析确定 FSS 处理后 430 个上调基因,再经 CUT&Tag 测序发现 586 个受 H3K4me3 调控的基因,两者交集筛选出 10 个基因(Capn12、Cldn1、Gpcpd1、Il13ra2、Mex3b、Nexn、Slc20a1、Srek1、Tgif1 和 Zbtb20)(图 4A)。经 qPCR 验证,Zbtb20 是 FSS 处理后上调zui显著的基因(图 4B),故被选为潜在的 H3K4me3 靶基因。CUT&Tag 验证显示 Zbtb20 是 FSS 引起的 H3K4me3 激活的直接靶标(图 4D),且 FSS 处理后 ZBTB20 蛋白表达显著升高(图 4E),而 MM-102 预处理可逆转 FSS 导致的 ZBTB20 在 mRNA 和蛋白水平的升高(图 4F 和 4G)。以上结果表明,ZBTB20 直接受 FSS 诱导的 H3K4me3 激活调控。
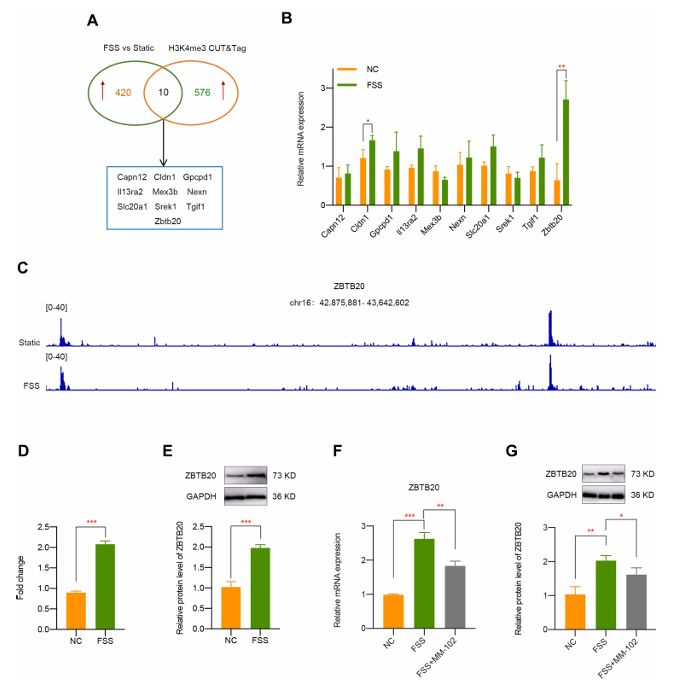
图4 在暴露于 FSS 的软骨细胞中确定 ZBTB20 为 H3K4me3 的靶基因。
为进一步研究 ZBTB20 对软骨细胞的调控作用,研究人员通过腺病毒实现 ZBTB20 过表达。qPCR 和 Western blot 结果验证了原代软骨细胞中 ZBTB20 的过表达成功(图 5A)。结果显示其会诱导软骨细胞凋亡(图 5B),抑制 Col2、Sox9 和 Acan 的 mRNA 表达(图 5C),同时上调 Col10、Cox-2 等肥大与分解代谢相关标志物(图 5C),以及 Mmp 家族和炎症因子(图 5C),表明 ZBTB20 对软骨细胞有负面影响,会引发基质降解和炎症反应。ZBTB20 过表达后,COLII 和 SOX9 的蛋白表达显著下调,而 COX-2 和 MMP13 的水平则出现统计学意义上的显著升高(图 5D)。鉴于 Wnt 信号通路与机械刺激响应及关节疾病相关,且 KEGG 富集分析涉及该通路,进一步研究发现 ZBTB20 过表达可激活 Wnt 信号通路(β- 连环蛋白水平显著上调)(图 6A )。而 Wnt/β- 连环蛋白抑制剂 LF3 处理能有效缓解 ZBTB20 的负面影响,减少细胞凋亡(图 6B)。在过表达 ZBTB20 且经 LF3 处理的软骨细胞中,软骨相关的正向标志物 Sox9、Col2 和 Acan 的表达得到改善,而代表软骨退化和炎症反应的标志物表达降低(图 6C )。Western blot 实验也得到了相同结果,表现为 LF3 处理的细胞中 COLII 和 SOX9 上调,COX-2 和 MMP13 下调(图 6D )。
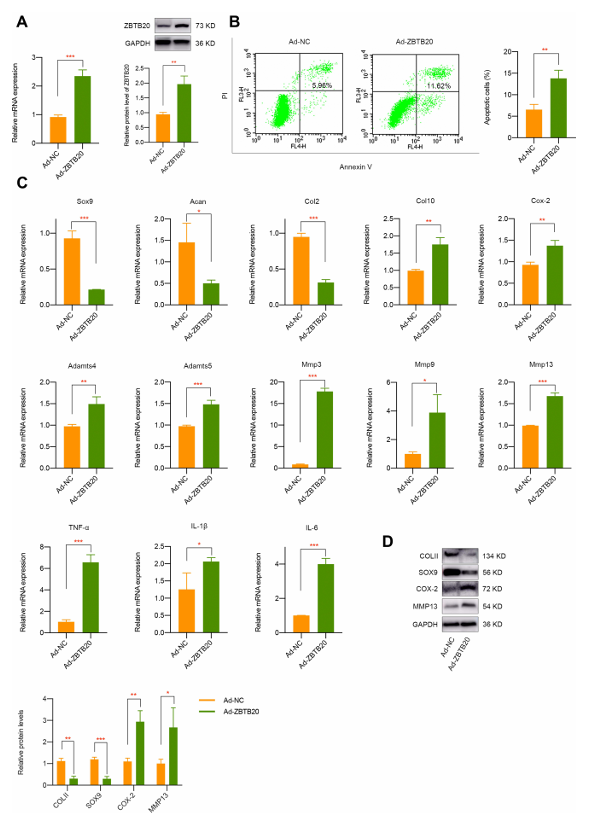
图5 ZBTB20 显著影响原代软骨细胞的生物学表型、软骨退化及炎症反应。
研究发现 FSS 会激活 Wnt 信号通路(图 6E),为明确该通路是否参与异常 FSS 诱导的软骨发病,使用 Wnt/β- 连环蛋白抑制剂 LF3 进行实验,结果显示 LF3 预处理可逆转SNP 引起的细胞凋亡(图 6F),且能减轻 FSS 对原代软骨细胞的破坏,使 COLII、SOX9 水平升高,COX-2、MMP13 水平降低(图 6G和6H)。由此推测,FSS 通过 KMT2B-H3K4me3-ZBTB20 介导的 Wnt 信号通路激活来破坏软骨。
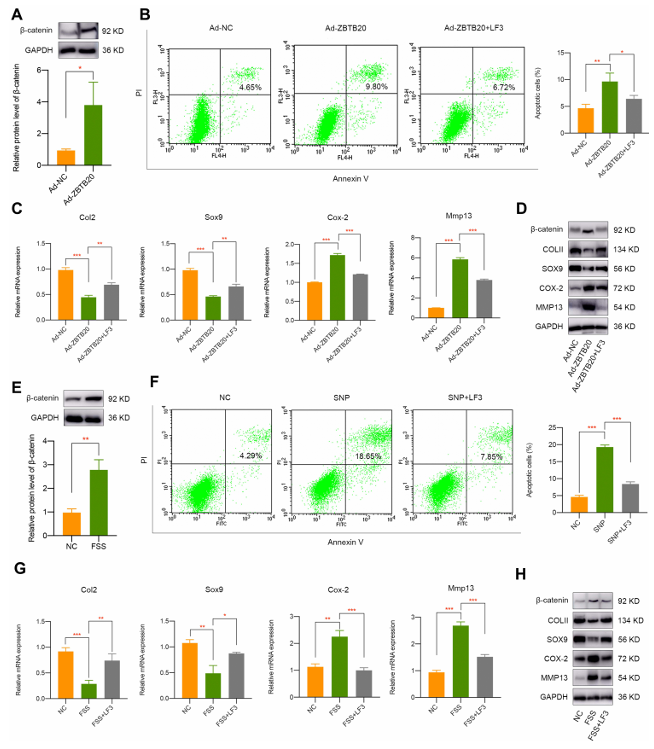
图6 Wnt 信号通路密切参与 ZBTB20 或 FSS 介导的软骨发病机制。
最后,研究人员通过 UAC 小鼠模型(模拟异常咬合诱导的 TMJOA)进行体内验证,结果显示 UAC 组小鼠存在明显的软骨降解和退化:显微 CT 显示,与假手术对照组相比,UAC 组的骨密度(BMD)、骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)和骨小梁数量(Tb.N)降低,而骨小梁分离度(Tb.Sp)增加(图 7A);UAC 组中 Col2 和 Sox9 的 mRNA 表达水平下调,Cox-2 和 Mmp13 的 mRNA 表达水平上调(图 7B);H&E 和番红 O 染色显示UAC 小鼠 的OARSI 评分升高和软骨细胞密度降低 (图 7C);免疫组化显示,UAC 组的 COLII、SOX9 蛋白减少,COX-2、MMP13 蛋白增加(图 7D)。同时,UAC 小鼠颞下颌关节组织中 H3K4me3 和 ZBTB20 被强烈激活(阳性细胞数量显著增多)(图 7D)。在异常机械力诱导的 TMJOA 中,H3K4me3 和 ZBTB20 的表达失调, 表明H3K4me3-ZBTB20 轴可能在剪切应力相关的颞下颌关节发病中发挥调控作用。异常 FSS 诱导 OA 的基于表观遗传学机制的整体工作模型如图 8 所示。

图7 体内单侧前牙反合小鼠模型验证。
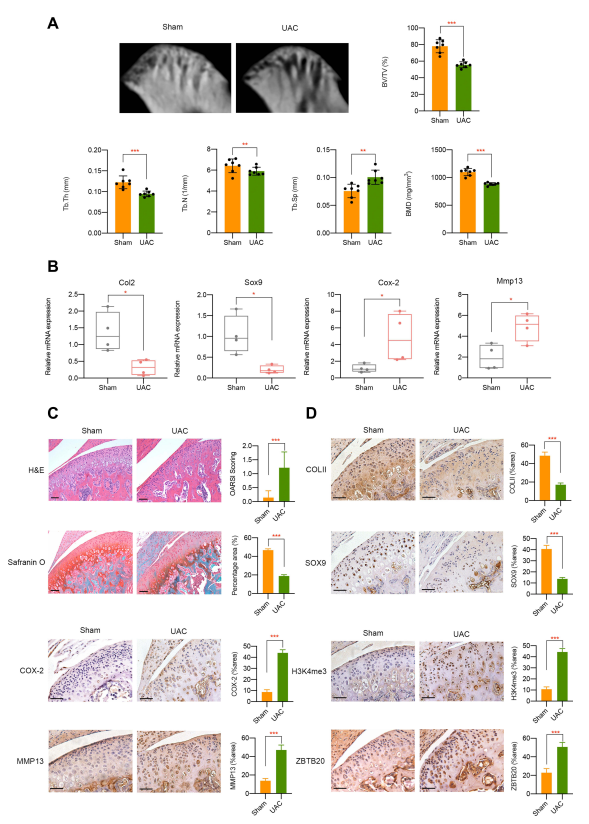
图8 异常 FSS 诱导 OA 的基于表观遗传学机制的整体工作模型。
总之,研究揭示了高 FSS 相关软骨发病中的新表观遗传修饰,明确 H3K4me3-ZBTB20 是关键介导因子,且抑制 H3K4me3 或 Wnt 信号可部分逆转 FSS 对软骨细胞的破坏。该研究第一次发现 OA 发病中机械应力与表观遗传事件的潜在关联,为基于表观遗传学的关节疾病治疗方法提供了基础。
参考文献:Jin Y, Li Z, Wu Y, Li H, Liu Z, Liu L, Ouyang N, Zhou T, Fang B, Xia L. Aberrant Fluid Shear Stress Contributes to Articular Cartilage Pathogenesis via Epigenetic Regulation of ZBTB20 by H3K4me3. J Inflamm Res. 2021 Nov 19;14:6067-6083. doi: 10.2147/JIR.S339382. PMID: 34824542; PMCID: PMC8610757.
原文链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC8610757/
Impact Factor: 4.1
ISSN: 1178-7031
图片来源: 所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:流体剪切力系统

