C25-140作为TRAF6-Ubc13抑制剂的作用机理及在动物模型研究中的应用
2025-09-19 来源:本站 点击次数:105
TRAF6(Tumor Necrosis Factor Receptor-Associated Factor 6)是一种E3泛素连接酶,在先天免疫和炎症信号通路中起核心调控作用。其功能实现依赖于与泛素结合酶Ubc13(一种E2泛素结合酶,又称UBE2N)形成复合物,后者催化形成K63连接的多聚泛素链,进而激活下游信号级联反应。C25-140(AbMole,M13561)通过干扰TRAF6与Ubc13的相互作用,抑制TRAF6的E3泛素连接酶活性,从而阻断其下游信号通路。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、C25-140的作用机理
TRAF6(肿瘤坏死因子受体相关因子6)属于TRAF蛋白家族,它在多条细胞信号传导通路中发挥关键作用,包括Toll样受体(TLRs)、白介素-1受体(IL-1R)、肿瘤坏死因子受体(TNFR)等介导的信号通路。TRAF6通过与Ubc13形成复合物后,激活自身泛素化活性,再通过泛素化修饰激活下游信号通路,如NF-κB和MAPK通路,从而调控基因表达,影响细胞的存活、增殖、分化并调节免疫反应[1]。
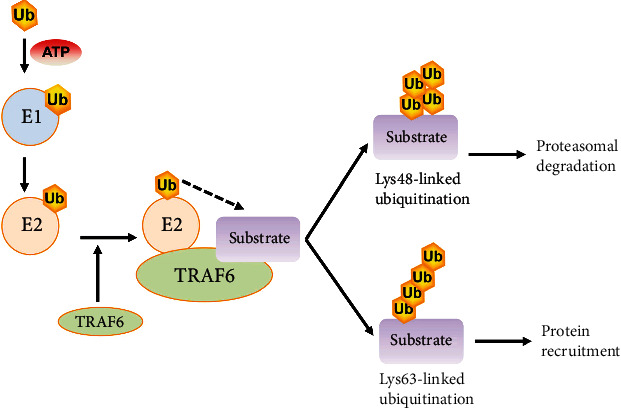

C25-140(AbMole,M13561)是一种TRAF6-Ubc13蛋白相互作用的高选择性抑制剂。C25-140通过直接结合TRAF6的TRAF-C结构域,特异性阻断TRAF6与Ubc13的相互作用界面,从而抑制TRAF6的E3泛素连接酶活性。这种作用机制不涉及对酶催化中心的直接抑制,而是通过变构调节破坏蛋白质-蛋白质相互作用(PPI)。在分子选择性方面,C25-140对TRAF6-Ubc13相互作用的抑制表现出显著特异性。在多种E3连接酶筛选中,仅对细胞凋亡抑制蛋白1(cIAP1)表现出轻微交叉反应性,而对其他TRAF家族成员(TRAF2/5)或独立E3连接酶(如MDM2)几乎无影响。这种选择性源于C25-140与TRAF6蛋白结合口袋的精确空间匹配,其中三唑并哒嗪环与TRAF6的Arg392形成关键氢键,而苯甲基哌啶基团则嵌入由Phe473和Tyr470构成的疏水腔[2]。
二、C25-140的科研应用
(一)C25-140对炎症及免疫信号通路的调控
在多种细胞类型中,C25-140(AbMole,M13561)展现出对炎症及免疫信号通路的强大调控能力。在巨噬细胞中,C25-140能够高效抑制 IL-1β和TNFα 介导的受体信号。当巨噬细胞受到IL-1β或TNFα刺激时,会启动一系列炎症信号级联反应,而C25-140的存在可使这些信号通路的关键节点失活,减少炎症介质的释放及相关基因的表达[3]。在T细胞和B细胞等免疫细胞中,C25-140同样能够干扰由抗原或细胞因子激活的免疫信号通路,影响免疫细胞的活化、增殖与分化过程,进一步凸显其在调节机体免疫反应中的重要作用[4]。
(二)C25-140在肿瘤研究中的应用
TRAF6在多种肿瘤细胞中过表达,并与肿瘤的侵袭性和预后不良相关。C25-140(AbMole,M13561)可通过抑制TRAF6的活性,减少PRMT5(Protein Arginine Methyltransferase 5)的甲基化活性,进而抑制肿瘤细胞的增殖。PRMT5是一种II型蛋白精氨酸甲基转移酶,其表达异常可导致细胞内的表观遗传学修饰发生变化,并形成肿瘤。C25-140与PRMT5抑制剂联合使用,显示出对乳腺癌细胞系更强的抗增殖效果。这表明C25-140在肿瘤研究中具有潜在的应用价值[5]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
(三)C25-140在动物模型中的应用
1. C25-140用于动物银屑病模型的研究
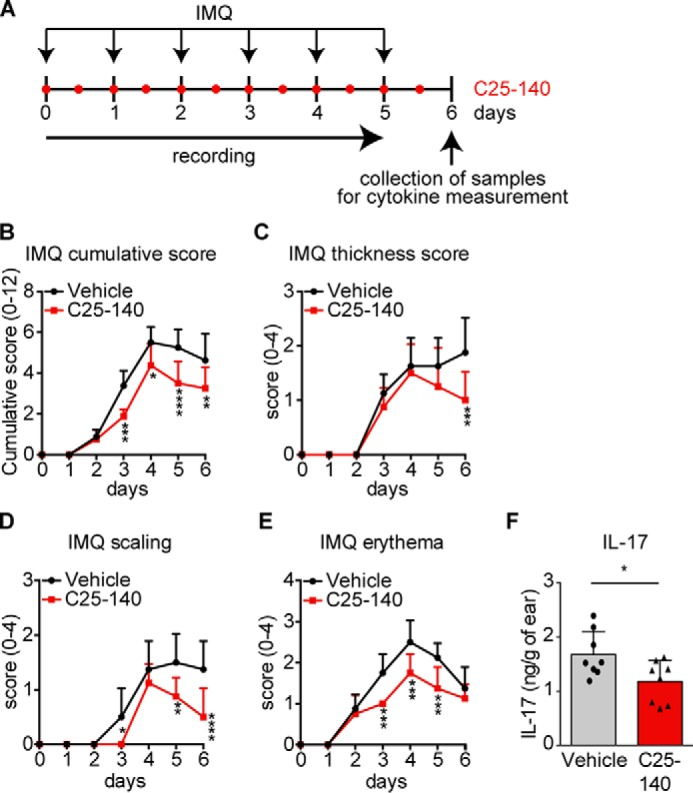
在银屑病的研究中,C25-140 被用于评估其对Imiquimod(IMQ)诱导的银屑病BALB/c小鼠小鼠模型的抗炎作用。研究中,C25-140通过局部涂抹(每天两次,每次剂量为1.5 mg/kg),显著改善了银屑病的症状,包括皮肤厚度、鳞屑和红斑的减少。此外,C25-140还降低了IL-17等炎症因子的表达,进一步证明了其在免疫调节中的作用[2]。

C25-140(AbMole,M13561)也是类风湿性关节炎(RA)动物模型中的重要科研工具,例如有文献报导C25-140可用于处理胶原诱导的关节炎(CIA)小鼠模型(DBA/1J)。DBA/1J小鼠是一种常用的近交系小鼠,常用于类风湿关节炎的研究[6]。CIA模型是一种广泛用于研究类风湿关节炎(Rheumatoid Arthritis, RA)的动物模型,该模型通过诱导动物产生针对II型胶原的自身免疫反应,并在此过程中混合弗氏完全佐剂(Freund′s Adjuvant, Complete)以增强免疫,CIA可以有效模拟RA的特征。结果显示经C25-140处理的CIA模型小鼠(C25-140的注射剂量为6 mg/kg、10 mg/kg、14 mg/kg,注射方式为皮下注射)显著降低了关节炎指数,尤其是在10 mg/kg和14 mg/kg剂量下,关节炎症状几乎恢复到基线水平。组织切片显示,C25-140剂量依赖性地改善了症状,包括炎症和关节结构损伤[7]。并且C25-140处理的小鼠在关节组织中显示出较低的炎症因子水平,如IL-1β、TNF-α和IL-6等[7]。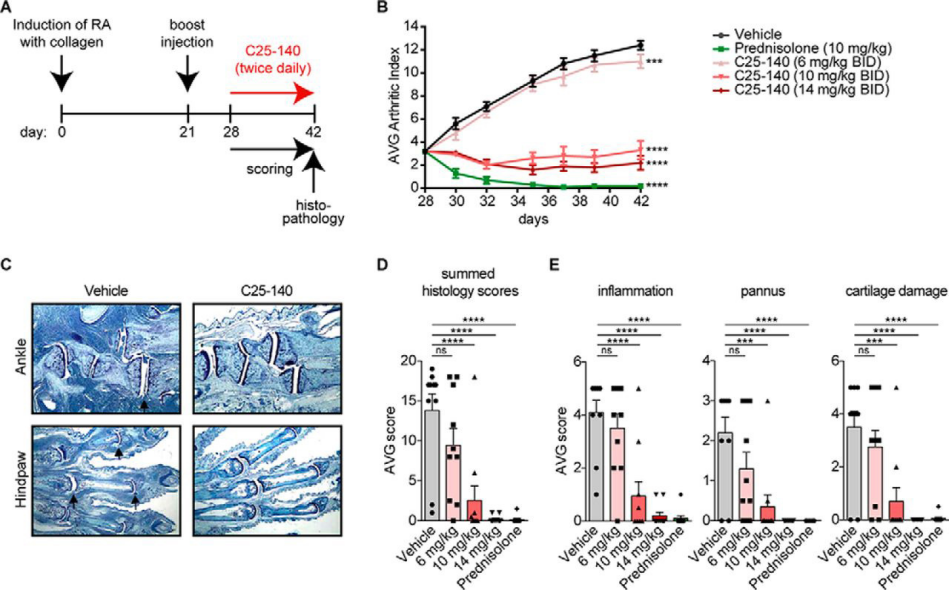

3. C25-140在动物肺损伤模型中的应用
C25-140(AbMole,M13561)除了用于自身免疫疾病中的研究,也可用于研究肺损伤及其它急性感染动物模型。在一项研究中,使用了6-8周龄的雄性Sprague Dawley(SD)大鼠(体重180-220 g)来评估C25-140对脂多糖(LPS)诱导的急性肺损伤(ALI)的保护作用。SD大鼠通过气管内注入LPS(5 mg/kg)以构建ALI模型,通过腹腔注射给予C25-140(20 μM )处理[8]。组织切片结果表明C25-140处理的大鼠肺组织损伤显著减轻,表现为肺泡壁增厚、肺泡间隔部分破裂、肺泡结构变形和上皮细胞变性等病理变化的改善,证实C25-140可减轻ALI大鼠模型中的肺组织损伤和炎症反应[8]。
4. C25-140用于脓毒症动物模型的研究
C25-140 在一项研究中,对脓毒症诱导的C57BL/6小鼠心肌损伤表现出保护作用[9]。在该研究中,脓毒症模型是通过腹腔注射大肠杆菌(E. coli)来诱导的。C25-140通过腹腔注射给药,剂量为5 μM,处理2小时后,再用10 μg/ml LPS(脂多糖) 处理24小时。结果显示C25-140显著减轻了心肌损伤,降低了心肌细胞凋亡率。组织病理学检查显示,C25-140处理的小鼠心肌组织损伤显著减轻,表现为心肌细胞变性及坏死比例的减少。上述现象的分子机制涉及C25-140对TRAF6和NF-κB p65磷酸化的抑制,最终实现了降低炎症反应的目的效果[9]。
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] J. Wang, X. Wu, M. Jiang, et al., Mechanism by which TRAF6 Participates in the Immune Regulation of Autoimmune Diseases and Cancer, BioMed research international 2020 (2020) 4607197.
[2] J. K. Brenke, G. M. Popowicz, K. Schorpp, et al., Targeting TRAF6 E3 ligase activity with a small-molecule inhibitor combats autoimmunity, The Journal of biological chemistry 293(34) (2018) 13191-13203.
[3] A. Liu, P. Bai, H. You, et al., SLAMF7 Restrains Pro-Inflammatory Macrophage Activation to Counteract Doxorubicin-Induced Cardiotoxicity, JACC. Basic to translational science (2025) 101256.
[4] J. Bojarska, W. M. Wolf, Short Peptides as Powerful Arsenal for Smart Fighting Cancer, Cancers 16(19) (2024).
[5] L. Liu, S. Yin, W. Gan, TRAF6 Promotes PRMT5 Activity in a Ubiquitination-Dependent Manner, Cancers 15(9) (2023).
[6] D. D. Brand, K. A. Latham, E. F. Rosloniec, Collagen-induced arthritis, Nature protocols 2(5) (2007) 1269-75.
[7] Jara K. Brenke, Grzegorz M. Popowicz, Kenji Schorpp, et al., Targeting TRAF6 E3 ligase activity with a small-molecule inhibitor combats autoimmunity, Journal of Biological Chemistry 293(34) (2018) 13191-13203.
[8] J. Li, Y. P. Hu, X. L. Liang, et al., Sodium Houttuyniae attenuates ferroptosis by regulating TRAF6-c-Myc signaling pathways in lipopolysaccharide-induced acute lung injury (ALI), BMC pharmacology & toxicology 25(1) (2024) 63.
[9] Y. Li, L. Zhang, P. Zhang, et al., Dehydrocorydaline Protects Against Sepsis-Induced Myocardial Injury Through Modulating the TRAF6/NF-κB Pathway, Frontiers in pharmacology 12 (2021) 709604.
一、C25-140的作用机理
TRAF6(肿瘤坏死因子受体相关因子6)属于TRAF蛋白家族,它在多条细胞信号传导通路中发挥关键作用,包括Toll样受体(TLRs)、白介素-1受体(IL-1R)、肿瘤坏死因子受体(TNFR)等介导的信号通路。TRAF6通过与Ubc13形成复合物后,激活自身泛素化活性,再通过泛素化修饰激活下游信号通路,如NF-κB和MAPK通路,从而调控基因表达,影响细胞的存活、增殖、分化并调节免疫反应[1]。


图 1. TRAF6-Ubc13互作示意图[1]
C25-140(AbMole,M13561)是一种TRAF6-Ubc13蛋白相互作用的高选择性抑制剂。C25-140通过直接结合TRAF6的TRAF-C结构域,特异性阻断TRAF6与Ubc13的相互作用界面,从而抑制TRAF6的E3泛素连接酶活性。这种作用机制不涉及对酶催化中心的直接抑制,而是通过变构调节破坏蛋白质-蛋白质相互作用(PPI)。在分子选择性方面,C25-140对TRAF6-Ubc13相互作用的抑制表现出显著特异性。在多种E3连接酶筛选中,仅对细胞凋亡抑制蛋白1(cIAP1)表现出轻微交叉反应性,而对其他TRAF家族成员(TRAF2/5)或独立E3连接酶(如MDM2)几乎无影响。这种选择性源于C25-140与TRAF6蛋白结合口袋的精确空间匹配,其中三唑并哒嗪环与TRAF6的Arg392形成关键氢键,而苯甲基哌啶基团则嵌入由Phe473和Tyr470构成的疏水腔[2]。
二、C25-140的科研应用
(一)C25-140对炎症及免疫信号通路的调控
在多种细胞类型中,C25-140(AbMole,M13561)展现出对炎症及免疫信号通路的强大调控能力。在巨噬细胞中,C25-140能够高效抑制 IL-1β和TNFα 介导的受体信号。当巨噬细胞受到IL-1β或TNFα刺激时,会启动一系列炎症信号级联反应,而C25-140的存在可使这些信号通路的关键节点失活,减少炎症介质的释放及相关基因的表达[3]。在T细胞和B细胞等免疫细胞中,C25-140同样能够干扰由抗原或细胞因子激活的免疫信号通路,影响免疫细胞的活化、增殖与分化过程,进一步凸显其在调节机体免疫反应中的重要作用[4]。
(二)C25-140在肿瘤研究中的应用
TRAF6在多种肿瘤细胞中过表达,并与肿瘤的侵袭性和预后不良相关。C25-140(AbMole,M13561)可通过抑制TRAF6的活性,减少PRMT5(Protein Arginine Methyltransferase 5)的甲基化活性,进而抑制肿瘤细胞的增殖。PRMT5是一种II型蛋白精氨酸甲基转移酶,其表达异常可导致细胞内的表观遗传学修饰发生变化,并形成肿瘤。C25-140与PRMT5抑制剂联合使用,显示出对乳腺癌细胞系更强的抗增殖效果。这表明C25-140在肿瘤研究中具有潜在的应用价值[5]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
(三)C25-140在动物模型中的应用
1. C25-140用于动物银屑病模型的研究
在银屑病的研究中,C25-140 被用于评估其对Imiquimod(IMQ)诱导的银屑病BALB/c小鼠小鼠模型的抗炎作用。研究中,C25-140通过局部涂抹(每天两次,每次剂量为1.5 mg/kg),显著改善了银屑病的症状,包括皮肤厚度、鳞屑和红斑的减少。此外,C25-140还降低了IL-17等炎症因子的表达,进一步证明了其在免疫调节中的作用[2]。


图 2. Topical application of the inhibitor C25-140 reduces in vivo outcome of imiquimod-induced psoriasis[2]
2. C25-140用于类风湿性关节炎动物模型的研究C25-140(AbMole,M13561)也是类风湿性关节炎(RA)动物模型中的重要科研工具,例如有文献报导C25-140可用于处理胶原诱导的关节炎(CIA)小鼠模型(DBA/1J)。DBA/1J小鼠是一种常用的近交系小鼠,常用于类风湿关节炎的研究[6]。CIA模型是一种广泛用于研究类风湿关节炎(Rheumatoid Arthritis, RA)的动物模型,该模型通过诱导动物产生针对II型胶原的自身免疫反应,并在此过程中混合弗氏完全佐剂(Freund′s Adjuvant, Complete)以增强免疫,CIA可以有效模拟RA的特征。结果显示经C25-140处理的CIA模型小鼠(C25-140的注射剂量为6 mg/kg、10 mg/kg、14 mg/kg,注射方式为皮下注射)显著降低了关节炎指数,尤其是在10 mg/kg和14 mg/kg剂量下,关节炎症状几乎恢复到基线水平。组织切片显示,C25-140剂量依赖性地改善了症状,包括炎症和关节结构损伤[7]。并且C25-140处理的小鼠在关节组织中显示出较低的炎症因子水平,如IL-1β、TNF-α和IL-6等[7]。


图 3. C25-140 ameliorates symptoms of RA in a preclinical mouse model.A, study design of a CIA preclinical mouse model for RA (n = 10/group)[7]
3. C25-140在动物肺损伤模型中的应用
C25-140(AbMole,M13561)除了用于自身免疫疾病中的研究,也可用于研究肺损伤及其它急性感染动物模型。在一项研究中,使用了6-8周龄的雄性Sprague Dawley(SD)大鼠(体重180-220 g)来评估C25-140对脂多糖(LPS)诱导的急性肺损伤(ALI)的保护作用。SD大鼠通过气管内注入LPS(5 mg/kg)以构建ALI模型,通过腹腔注射给予C25-140(20 μM )处理[8]。组织切片结果表明C25-140处理的大鼠肺组织损伤显著减轻,表现为肺泡壁增厚、肺泡间隔部分破裂、肺泡结构变形和上皮细胞变性等病理变化的改善,证实C25-140可减轻ALI大鼠模型中的肺组织损伤和炎症反应[8]。
4. C25-140用于脓毒症动物模型的研究
C25-140 在一项研究中,对脓毒症诱导的C57BL/6小鼠心肌损伤表现出保护作用[9]。在该研究中,脓毒症模型是通过腹腔注射大肠杆菌(E. coli)来诱导的。C25-140通过腹腔注射给药,剂量为5 μM,处理2小时后,再用10 μg/ml LPS(脂多糖) 处理24小时。结果显示C25-140显著减轻了心肌损伤,降低了心肌细胞凋亡率。组织病理学检查显示,C25-140处理的小鼠心肌组织损伤显著减轻,表现为心肌细胞变性及坏死比例的减少。上述现象的分子机制涉及C25-140对TRAF6和NF-κB p65磷酸化的抑制,最终实现了降低炎症反应的目的效果[9]。
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] J. Wang, X. Wu, M. Jiang, et al., Mechanism by which TRAF6 Participates in the Immune Regulation of Autoimmune Diseases and Cancer, BioMed research international 2020 (2020) 4607197.
[2] J. K. Brenke, G. M. Popowicz, K. Schorpp, et al., Targeting TRAF6 E3 ligase activity with a small-molecule inhibitor combats autoimmunity, The Journal of biological chemistry 293(34) (2018) 13191-13203.
[3] A. Liu, P. Bai, H. You, et al., SLAMF7 Restrains Pro-Inflammatory Macrophage Activation to Counteract Doxorubicin-Induced Cardiotoxicity, JACC. Basic to translational science (2025) 101256.
[4] J. Bojarska, W. M. Wolf, Short Peptides as Powerful Arsenal for Smart Fighting Cancer, Cancers 16(19) (2024).
[5] L. Liu, S. Yin, W. Gan, TRAF6 Promotes PRMT5 Activity in a Ubiquitination-Dependent Manner, Cancers 15(9) (2023).
[6] D. D. Brand, K. A. Latham, E. F. Rosloniec, Collagen-induced arthritis, Nature protocols 2(5) (2007) 1269-75.
[7] Jara K. Brenke, Grzegorz M. Popowicz, Kenji Schorpp, et al., Targeting TRAF6 E3 ligase activity with a small-molecule inhibitor combats autoimmunity, Journal of Biological Chemistry 293(34) (2018) 13191-13203.
[8] J. Li, Y. P. Hu, X. L. Liang, et al., Sodium Houttuyniae attenuates ferroptosis by regulating TRAF6-c-Myc signaling pathways in lipopolysaccharide-induced acute lung injury (ALI), BMC pharmacology & toxicology 25(1) (2024) 63.
[9] Y. Li, L. Zhang, P. Zhang, et al., Dehydrocorydaline Protects Against Sepsis-Induced Myocardial Injury Through Modulating the TRAF6/NF-κB Pathway, Frontiers in pharmacology 12 (2021) 709604.
相关文章
更多 >

