类器官研究发展历程、培养指南及其在药物评估的应用前景
2025-09-30 来源:本站 点击次数:55FDA 宣布将在临床前安全性研究中减少动物试验,该方案于 4 月 10 日已开始应用于临床试验新药 (IND) 申请.....

2025 年 4 月 10 日,美国食品药品监督管理局(FDA)宣布:计划逐步取消单克隆抗体及其他药物的动物实验要求。
不用实验动物?那用啥呢?
哎嘿,人家给的也很明确:使用包括 AI 计算模型、人类细胞系、类器官以及器官芯片系统等所谓的“新方法论”或 NAMs 数据替代动物实验。

图 1. 图片来源于 FDA 官网新闻公告截图。
这不,大佬发言了。

FDA 局长
Martin A. Makary 医学博士
“通过利用基于人工智能的计算模型、基于人体器官模型的实验室测试以及真实世界的人体数据,我们可以更快、更可靠地为患者提供更安全的治疗,同时降低研发成本和药品价格。这对公共卫生和伦理道德而言是双赢的。”
其实,美国早在2022年9月就正式通过了《FDA现代化法案2.0》《FDA Modernization Act 2.0》,该法案废除了先前要求新药在人体临床试验前必须进行强制性动物测试的规定,从而允许在新药的临床试验申请(IND)中使用人工智能模型、类器官芯片等非动物方法作为替代方案。
不过此番 FDA 更加坚定了自己前进的步伐!同时发布的还有一份《减少临床前安全性研究中动物实验的路线图》,该路线图概述了FDA通过科学验证的新方法(NAM)——例如器官芯片系统、计算建模和先进的体外检测——减少临床前安全性研究中动物试验,以及通过多机构联合 blablabla......具有重要意义。
就在FDA 宣布将逐步取消单克隆抗体和其他药物的动物试验要求后,支持与反对的声音,额.....都有,都有。

更重要的是,2022 年 8 月,FDA 批准了全球首个基于“器官芯片”研究获得临床前数据的新药(NCT04658472)进入临床试验。
官方认证了啊友友们!
于是,敏锐的各大企业纷纷开始大力投资和探索人体类器官、器官芯片及 AI 模拟试验等新模式。MCE 也紧追其上,携手上海交通大学药学院签署战略合作协议,围绕“AI+类器官+药物研发”开展深度合作,共建国家级智能类器官药物研发战略平台。
Section.01
人体“类器官”
人体“类器官”
类器官的首次提出:1997年。
但直到 2009 年,才出现第一个“完全”意义上的类器官模型——由荷兰癌症中心 (NKI) 的 Hans Clevers 团队培育的人造肠类器官 (Intestinal Organoid),类器官研究取得重大突破。再到 2011 年,该团队又进一步成功地利用结直肠癌患者的肿瘤组织构建了结直肠癌类器官模型,首次将类器官模型拓展至肿瘤学研究领域,目前患者来源的类器官 (Patient-derived organoid,PDO) 模型在肿瘤领域研究十分火热。在 2019 年,类器官登上了全球顶级学术期刊 Science 的封面,被评选为年度重大突破 (图 2)[1]
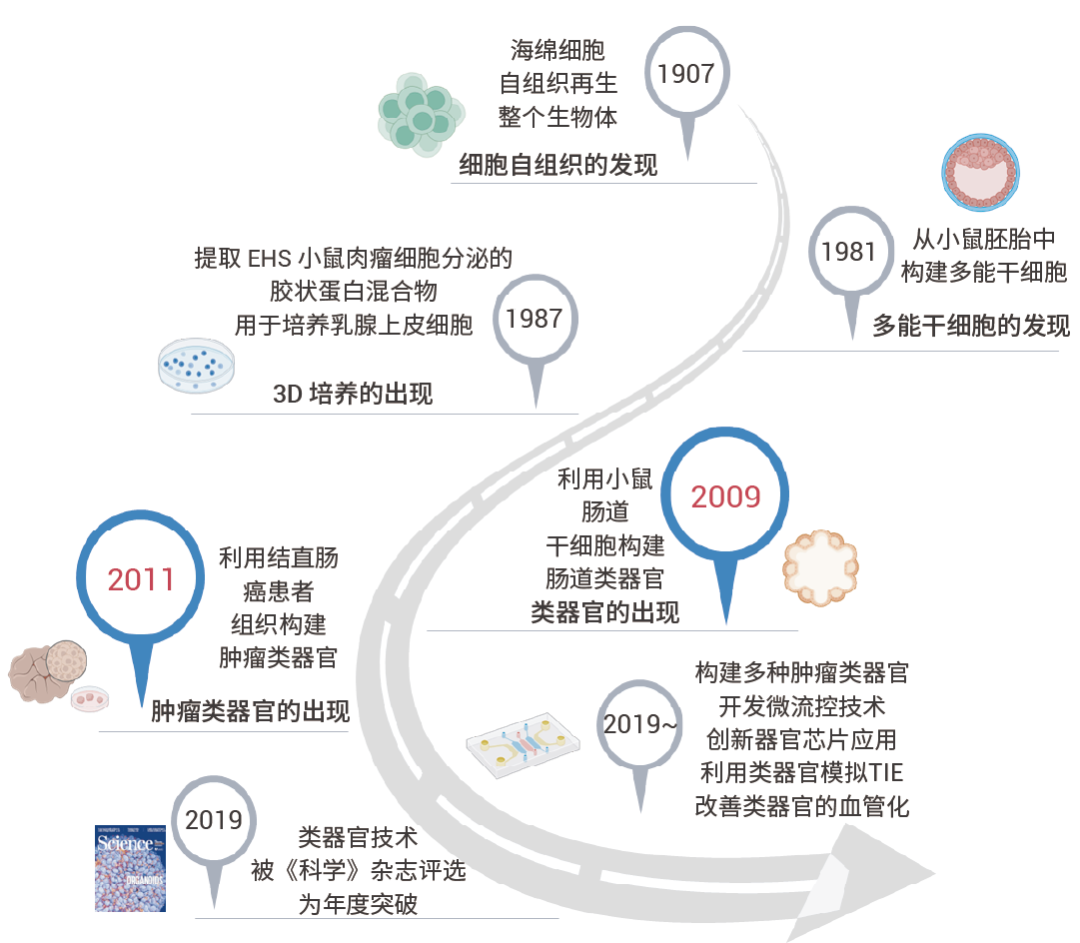 图 2. 类器官研究的发展历程[1]。
图 2. 类器官研究的发展历程[1]。类器官是模拟天然组织结构和功能的自组织细胞培养物(例如肝脏类器官、肠道类器官),可以由成体组织中的干细胞或多能干细胞生成。作为传统二维培养和动物模型之间的桥梁,具有诸多优势,既能提供实验可操作性,又能捕捉生物的复杂性 (如下表 所示)[2]。
类器官培养与二维细胞培养及动物研究的比较[2]。
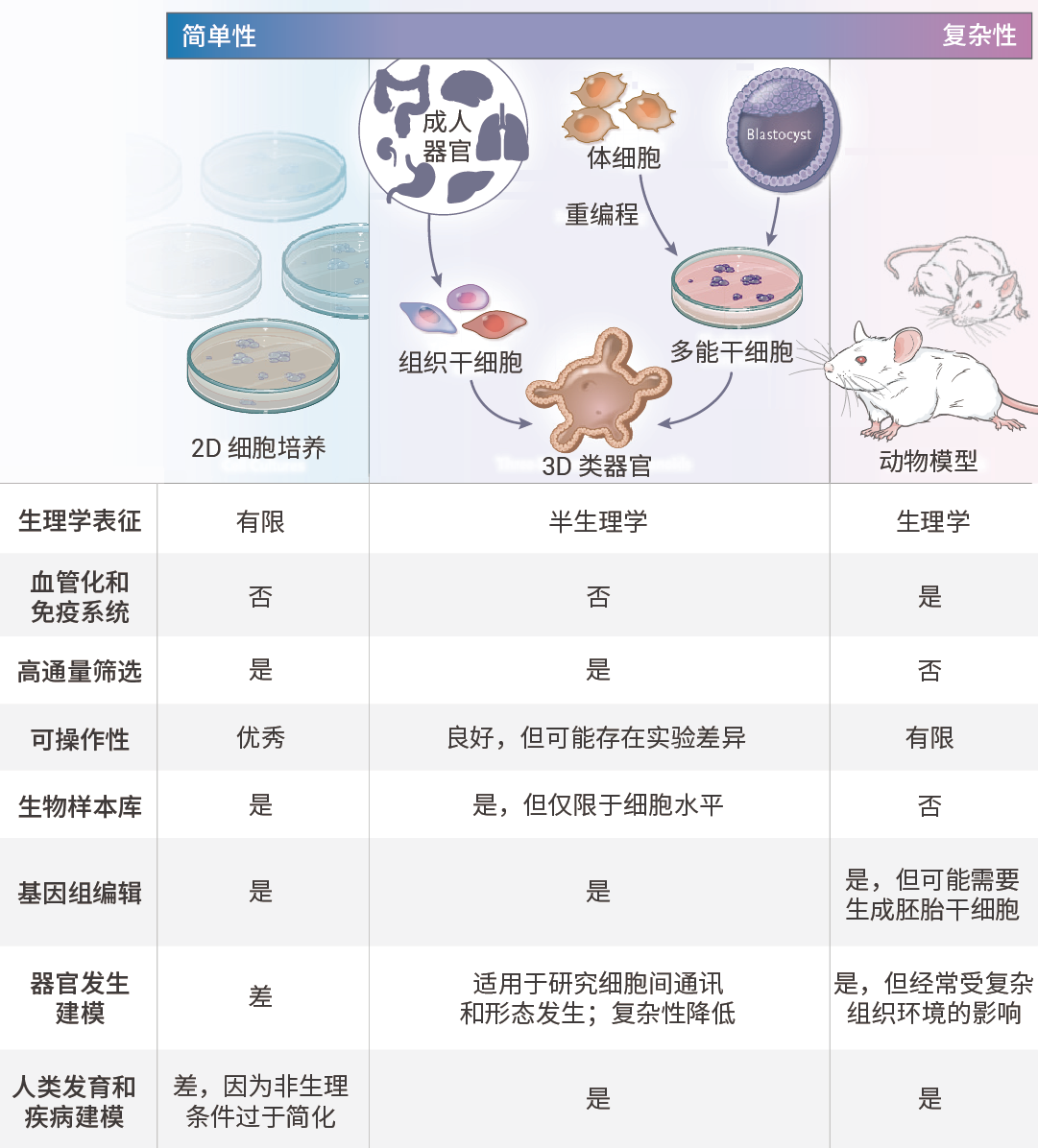
通常来讲,人类类器官可从正常或恶性原代组织中生成,最常用的方法是 R-spondin 方法,该方法是生成小肠类器官的基本设计原则。或者,体细胞可以重编程为诱导多能干细胞,通过定向分化,可用作所有三个胚层的类器官来源[2]。
目前,类器官技术已与基因组编辑、单细胞基因组学、活体成像和微流体技术等技术良好地融合,应用于疾病建模、筛选抗癌药物、识别药物毒性、基因测试和细胞疗法等诸多领域。不仅为发育过程和疾病发病机制提供了新的见解,也加速了疾病诊断和治疗方法的研究进程。
关于类器官的模型构建小 M 在往期推文已进行过实操案例的解读,此处不在赘述。但是!类器官的实操也要多多留心,科研人表示:翻车的代价,莫要挨边!
类器官培养指南
样本:选择、保存、清洗[3][4]
- 组织来源:新鲜样本 (手术或活检)>冻存组织,但若必须冻存,记得使用冻存液 (别让细胞变成“冰棍”)。
- 运输介质:用专用的试剂保存组织细胞的活性,避免样本在运输途中坏死。
- 保存时间:4℃ 保存不超过 24 h,-80℃ 或液氮长期保存 (但复苏后活性可能打折扣)。
- 培养基/PBS 冲洗:去除血液、粘液和碎片,否则消化时会“一锅糊”,建议冰上操作。
- 抗生素防污染:对于污染风险比较高的样本 (如肠道、肿瘤组织),可加 1% P/S 杀菌。
组织消化
- 预处理:清洗干净的样本剪切成合适的大小准备消化。
- 酶选择:胶原酶 IV (温和)、胰蛋白酶 (较强) 以及商品化的消化液都可以使用!
- 注意观察:每 5 min 观察一次组织的消化情况,避免消化过头。
- 终止消化:使用无血清终止液,避免 FBS 未知成分干扰。
接种培养、传代、冻存、复苏
- 基质胶:提前解冻,冰上操作 (室温凝固)。
- 培养:选择合理细胞密度 (可参考文献进行优化) 培养,专用培养基提供生长、分化物质,类器官长满或成熟后,进行分离、消化、传代——轻柔吹打或短暂消化传代。
- 冻存:传代 2~3 次的类器官活力佳,冻存密度> 2×105/mL。
- 复苏要快:37℃ 水浴快速融化,慢吞吞?细胞会“冻伤”。
类器官检测
- 细胞活性:在药敏实验中经常会用到 3D&类器官 ATP 和活力检测试剂来进行基础活性判断。
- 染色:DAPI 染核,标志物特异性识别,多维度表型鉴定。MCE 最新开学季活3D 细胞培养类,专享 65 折!

Section.02
器官芯片系统
器官芯片系统
言归正传!NCT04658472 是首个使用微生理系统 (MPS,通过微流控技术实现多器官联动) 数据提交的 IND,星星之火可以燎原,器官芯片赛道被“唰唰唰”点燃!
器官芯片(Organs-on-a-Chips,OOC) 是生物工程的小型化系统,内有在微流体芯片内生长的细胞/组织[5]。从命名上就能看出其涉及多学科领域,生物学,材料学,工程学,blabla~~
其得益于微流体和各种设备 (例如微型显微镜、无透镜显微镜) 和监测系统,例如执行器、传感器和生物传感器 (用于实时监测细胞生长和活力以及维持健康和最佳的培养微环境) 的发展[5]。
通常,OOC 由三个主要组成部分组成:(1) 模拟细胞可以附着、生长和相互作用的器官组织的微通道,(2) 在通道 (或孔) 中培养的活细胞,例如干细胞,以及 (3) 仿生环境,维持与器官相关的条件,例如营养物质、氧气水平和液体流动[5]。
各位友友们可以通过下图简单了解下~
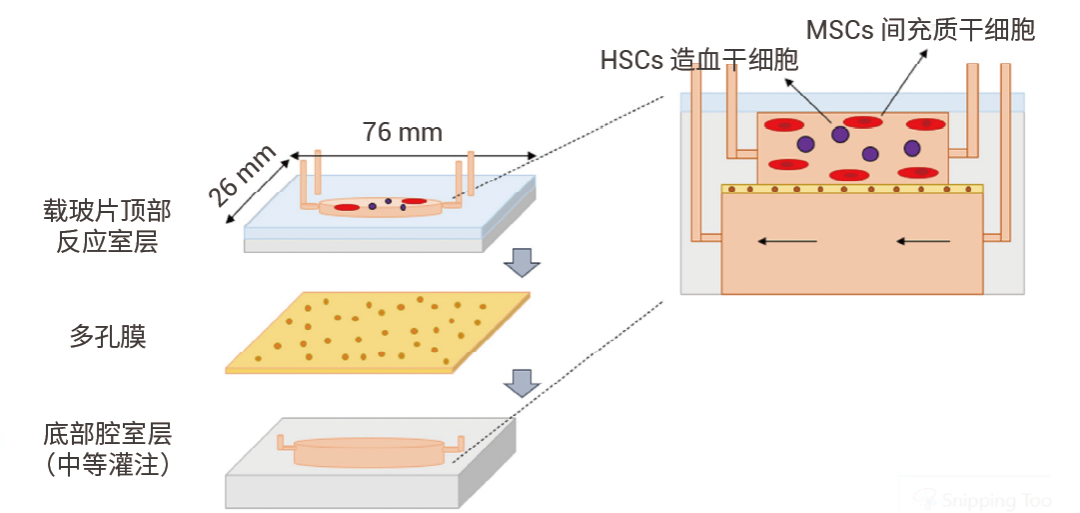 图 3. 无支架骨髓芯片横截面示意图的放大 3D 图[5]。
图 3. 无支架骨髓芯片横截面示意图的放大 3D 图[5]。包括用于显微镜实时观察的玻璃层和容纳上部细胞培养微室的三个 PDMS 层,与下部培养基灌注分离,中间多孔膜。
相比类器官,器官芯片装置则更进一步,在生物工程芯片上整合了微流体、机械力和多细胞共培养,模拟体内环境。例如,人体肝脏芯片可以在灌注条件下将肝细胞与非实质细胞共培养,表现出类似肝脏的代谢和反应。这些平台保留了动物所缺乏的人类特异性生物学特性,从而能够检测仅在人体组织中表现出来的效应。
当然,OOC 的设计多种多样。研究人员和工程师已经设计和制造了具有精确结构和专用微流体通道的微流体装置。设计的选择取决于支持细胞/组织生长和功能的培养需求。通常还会集成微泵和微阀等控制系统,用于控制通道内的压力和流体流动[5]。
OOC 技术的优点[5]
01
OOC 技术减少并最终避免了动物试验。平台可以为人体模型重新创建高度可重复的环境,无需进行动物试验。它们可实现高通量筛选和测试,降低任务成本和时间,同时提高效率。
02
OOC 可用于个性化测试。现在可以通过将人自己的细胞集成到 OOC 设备中来重新创建微环境。这样可以实时监测各种药物的反应、有效性及其毒性,以及检测各种生物标志物。
03
OOC 也可用于医学测试。由于 OOC 平台体积小且自动化,因此可用于床旁诊断,例如在医院或移动诊所,从而实现分散测试。
04
OOC 可以在同一芯片上集成多种检测,并且可以同时执行各种并行测试,而无需依赖复杂的仪器 (并行测试)。
05
此外,OOC 还可用于药物递送和毒性测试。各种人类疾病都可以在 OOC 和靶向药物递送系统上建模,可以通过使用各种运输机制 (例如纳米颗粒) 进行评估,并在评估药物的疗效和毒性的同时重建类人细胞和生理屏障。
目前已有各种器官芯片技术,如:Brain-on-a-chip、Bone-on-a-chip、Kidney-on-a-chip、Lung-on-a-chip、Pancreas-on-a-chip、Heart-on-a-chip、Stomach-on-a-chip 等,以及开发的人体芯片 (Human-on-a-chip) ——涉及创建可刺激人体器官功能的微流体装置[5]。
人体芯片 (Human-on-a-chip)
人体芯片装置的开发技术就比较复杂,其涉及将多器官(2 至 10 个器官) 整合到芯片上。例如,它需要复杂的微流体通道、庞大的装置和精密的处理系统 (如果实现自动化)。当然,它们需要在多个腔室中培养可能来自不同器官的不同细胞类型,这些腔室通过循环培养基连接,以模拟血液循环系统并研究多器官的生理学[4]。其不仅可以预测药物对目标器官的影响,还可以使用芯片体系统,深入了解药物递送对其他器官的副作用。
还记得前面提过的 NCT04658472 临床试验么?其前期的部分支持数据就来自于人体芯片模型。
2022 年 4 月,John W Rumsey 等人在 Advanced Therapeutics 期刊发布题为“Classical Complement Pathway Inhibition in a “Human-On-A-Chip” Model of Autoimmune Demyelinating Neuropathies”的文献[6]。
 图 4. 一种新型体外人体芯片系统[6]。
图 4. 一种新型体外人体芯片系统[6]。该系统由人诱导多能干细胞 (iPSC) 衍生的运动神经元和人施万细胞组成,这些细胞在微电极阵列 (MEA) 上培养,微电极阵列上装有通道,用于引导轴突生长到电极上。作者用抗 GM1 多克隆 IgG 和纯化的人补体蛋白处理该系统,以建立并表征 EAN 的首个 HoaC 疾病模型。随后,用 MMN 和 CIDP 患者的血清处理该 HoaC 系统,建立了两种罕见的外周脱髓鞘神经病模型。最后,用 TNT005 (一种抑制经典补体途径关键蛋白酶 C1s 的鼠单克隆抗体 (mAb))处理 MMN 和 CIDP 系统,以挽救疾病效应。
研究首次构建了用于研究获得性炎性脱髓鞘性神经病的运动神经元传导速度的罕见疾病——慢性炎症性脱髓鞘性多发性神经病 (CIDP) 和多灶性运动神经病 (MMN)——的表型人体芯片 (HoaC) 电传导模型。HoaC 模型使用微电极阵列,在用患者血清处理的电极上定向轴突生长,结果显示运动神经元动作电位频率和传导速度降低,TNT005 处理后挽救了血清诱导的补体沉积和功能缺陷[6]。
该模型生成的数据为 NCT04658472 的临床前试验中测试 C1s 抑制效果提供了支持,并通过 FDA 批准,进入临床试验。
Section.03
先进的计算机模拟
FDA 新发布的路线图鼓励开发者利用计算机建模和人工智能 (AI) 来预测药物的行为[7]。主要的计算机模拟工具包括:
- 基于生理学的药代动力学 (PBPK) 建模:PBPK 模型是利用物种特异性生理学对药物 ADME (吸收、分布、代谢、排泄) 进行数学模拟。
- 机器学习和人工智能预测模型:机器学习算法可以根据药物序列特征、结构基序和已知的临床结果进行训练。目前开发的机器学习模型可以分析抗体可变区的氨基酸序列,以预测单克隆抗体可能具有高还是低的免疫原性。
- 定量系统药理学(QSP) 和生物通路建模:QSP 模型结合了计算生物学和药理学,模拟药物如何与复杂的人体生物网络相互作用。例如,自身免疫性疾病的 QSP 模型可以模拟抗体如何调节炎症通路,从而有助于预测有效剂量范围和潜在的毒性后果 (例如免疫系统过度抑制)。这些模型可以通过提供一个虚拟人体来测试“假设”情景,从而减少对动物疾病模型的依赖。
- 生物信息学和计算机模拟脱靶筛选:利用人类蛋白质数据库和人工智能,可以筛选产品序列中是否存在任何非预期靶点(例如与人体组织的交叉反应)。计算机模拟工具可以分析药物是否可能与人体蛋白质组中的相似表位结合,从而突出潜在的安全隐患,而这些隐患传统上需要通过动物组织交叉反应研究或广泛的受体结合组来检查。
总体而言,计算机模拟自然医学模型 (NAM) 可以通过数据和建模预测与人类相关的结果,从而成为动物研究的有力补充或替代。
|
产品推荐 |
|
类器官的“豪华地基”,培养必备! |
|
运输样本的“保鲜盒”,细胞不馊不烂! |
|
温和消化,拒绝“暴力拆解”! |
|
细胞“冬眠舱”,复苏后活力满满! |
|
从基质胶里“捞”类器官,不伤细胞! |
|
ATP 发光法 3D 细胞活力检测试剂盒 (HY-K6017) 一测就知道细胞活不活,拒绝“假数据”! |
|
专为肺癌类器官定制,“一站式”搞定! |

[1] XIAO Yi, et al. Research progress and future perspectives of tumor organoid[J]. China Oncology, 2024, 34(8): 763-776
[2] Li M, et al. Organoids - Preclinical Models of Human Disease. N Engl J Med. 2019 Feb 7;380(6):569-579.
[3] Sato T, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5
[4] Jacob F, et al.A Patient-Derived Glioblastoma Organoid Model and Biobank Recapitulates Inter- and Intra-tumoral Heterogeneity. Cell. 2020 Jan 9;180(1):188-204.e22.
[5] Obeid PJ, et al. Organ-On-A-Chip Devices: Technology Progress and Challenges. Chembiochem. 2024 Dec 2;25(23):e202400580.
[6] Rumsey JW, et al. Classical Complement Pathway Inhibition in a "Human-On-A-Chip" Model of Autoimmune Demyelinating Neuropathies. Adv Ther (Weinh). 2022 Jun;5(6):2200030.
[7] Roadmap to Reducing Animal Testing in Preclinical Safety Studies.



