Rosiglitazone(BRL 49653)作为PPARγ通路激动剂的作用机制及科研应用
2025-11-18 来源:本站 点击次数:68
Rosiglitazone(BRL 49653,AbMole,M1894)是一种噻唑烷二酮类化合物,Rosiglitazone作为过氧化物酶体增殖物激活受体γ(PPARγ)的高亲和力激动剂在科研中备受关注。PPARγ是核受体超家族中的一名关键成员,其本质上是一个依赖配体激活的转录因子,它在调控基因表达(尤其是涉及能量代谢和细胞分化的基因)方面起到重要的调节作用。而Rosiglitazone可直接结合PPARγ配体结合域,通过调控下游靶基因的表达发挥生物学效应[1, 2]。在分子层面,Rosiglitazone(CAS No.:122320-73-4)可调节NF-κB等炎症信号,以及葡萄糖转运和脂肪合成等代谢相关的通路。例如Rosiglitazone可降低p65磷酸化水平并上调IκBα表达,这种抗炎作用在PPARγ被敲除后消失,证实其核心机制依赖于PPARγ的激活。此外,最新发现Rosiglitazone还能作为视黄醇X受体α(RXRα)的配体,通过RXRα依赖性途径调控基因转录[3]。在细胞实验中,Rosiglitazone(BRL 49653)表现出多效性:(1)抑制细胞增殖,Rosiglitazone可通过剂量和时间依赖性的方式阻滞细胞周期并诱导凋亡,显著降低5637细胞和T24细胞的迁移能力[4];(2)调节线粒体功能,Rosiglitazone可保护线粒体,促进线粒体中的氧化磷酸化,增加细胞内ATP的水平,该作用可被PPARγ拮抗剂GW9662(AbMole,M2748)逆转[5];(3)调控巨噬细胞极化,Rosiglitazone可抑制M1型巨噬细胞但促进M2型巨噬细胞的极化,以及促进小胶质细胞的吞噬功能,这种增强作用与PPARγ/CD36轴激活密切相关[6];(4)诱导细胞分化:在脂肪细胞分化实验中,Rosiglitazone可显著促进3T3-L1前脂肪细胞的脂质积累并分化为脂肪细胞[7]。在动物实验中,Rosiglitazone能减轻小鼠脑出血模型的神经损伤,通过PPARγ/JNK/STAT3轴抑制细胞凋亡[8]。Rosiglitazone在小鼠肺纤维化模型中,可通过抑制p38 MAPK磷酸化缓解纤维化进程[9]。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
范例详解
Adv Sci (Weinh). 2023 May;10(15):e2207224.
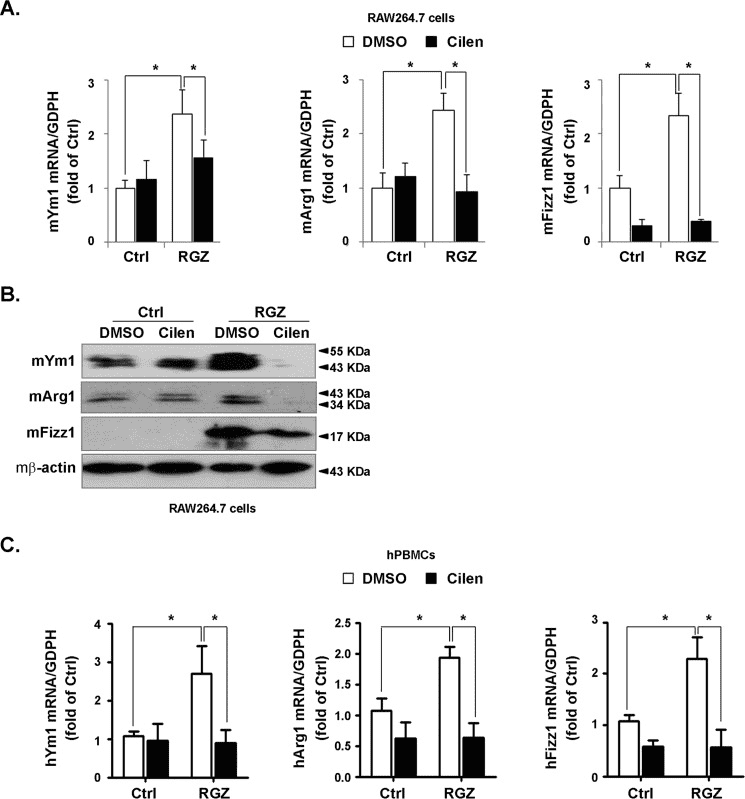
重庆医科大学的实验人员在上述论文中探讨了缺氧如何通过调控巨噬细胞极化和破骨细胞生成,驱动骨修复材料诱导的异位骨形成(heterotopic ossification, HO)。核心发现是:缺氧环境通过激活缺氧诱导因子-1α(HIF-1α),促进巨噬细胞向M2型极化并积累脂质,进而融合形成破骨细胞;而破骨细胞分泌的因子(如CTHRC1、S1P)可进一步诱导间充质干细胞的成骨分化,最终导致异位骨形成。这一机制为骨修复材料的设计提供了新思路。Rosiglitazone(BRL 49653,AbMole,M1894)作为M2型巨噬细胞激活剂,在本文中起到了阳性对照的作用,以证实巨噬细胞极化在上述模型中的作用。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。

AbMole是ChemBridge中国区官方指定合作伙伴。

 *本文所述产品仅供科研使用。
*本文所述产品仅供科研使用。
参考文献及鸣谢
[1] C. Hu, H. L. Keen, K. T. Lu, et al., Retinol-binding protein 7 is an endothelium-specific PPARgamma cofactor mediating an antioxidant response through adiponectin, JCI insight 2(6) (2017) e91738.
[2] Q. Mu, Q. He, H. Zhou, et al., Rosiglitazone Promotes Microglial Distribution via Activation of PPARgamma and CD36 in the ICH Rat Model, Neuro endocrinology letters 45(2) (2024) 96-106.
[3] F. Huang, Y. Li, J. Chen, et al., Rosiglitazone binds to RXRalpha to induce RXRalpha tetramerization and NB4 cell differentiation, Biochemical and biophysical research communications 530(1) (2020) 160-166.
[4] X. Xu, J. Wang, H. Jiang, et al., Rosiglitazone induces apoptosis on human bladder cancer 5637 and T24 cell lines, International journal of clinical and experimental pathology 10(10) (2017) 10197-10204.
[5] J. M. Ortiz-Rodriguez, C. Balao da Silva, J. Masot, et al., Rosiglitazone in the thawing medium improves mitochondrial function in stallion spermatozoa through regulating Akt phosphorylation and reduction of caspase 3, PloS one 14(7) (2019) e0211994.
[6] Q. Mu, L. Wang, H. Hang, et al., Rosiglitazone pretreatment influences thrombin-induced phagocytosis by rat microglia via activating PPARgamma and CD36, Neuroscience letters 651 (2017) 159-164.
[7] Y. Wang, Z. Yang, Y. Li, et al., Impact of Rosiglitazone on Subdermal Adipose Tissue Growth and Lipid Droplet Formation: An In Vitro and In Vivo Study, Aesthetic plastic surgery (2025).
[8] C. Chao, Y. Li, Q. Li, et al., Inhibitory effect and mechanism of Rosiglitazone on M1 type polarization of central microglia in intracerebral hemorrhage mice based on JNK/STAT3 signaling pathway, Brain and behavior 13(12) (2023) e3275.
[9] H. Zhang, L. You, M. Zhao, Rosiglitazone attenuates paraquat-induced lung fibrosis in rats in a PPAR gamma-dependent manner, European journal of pharmacology 851 (2019) 133-143.
范例详解
Adv Sci (Weinh). 2023 May;10(15):e2207224.
重庆医科大学的实验人员在上述论文中探讨了缺氧如何通过调控巨噬细胞极化和破骨细胞生成,驱动骨修复材料诱导的异位骨形成(heterotopic ossification, HO)。核心发现是:缺氧环境通过激活缺氧诱导因子-1α(HIF-1α),促进巨噬细胞向M2型极化并积累脂质,进而融合形成破骨细胞;而破骨细胞分泌的因子(如CTHRC1、S1P)可进一步诱导间充质干细胞的成骨分化,最终导致异位骨形成。这一机制为骨修复材料的设计提供了新思路。Rosiglitazone(BRL 49653,AbMole,M1894)作为M2型巨噬细胞激活剂,在本文中起到了阳性对照的作用,以证实巨噬细胞极化在上述模型中的作用。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。


Cilengitide partially inhibited rosiglitazone-induced M2 polarization.
AbMole是ChemBridge中国区官方指定合作伙伴。

 *本文所述产品仅供科研使用。
*本文所述产品仅供科研使用。参考文献及鸣谢
[1] C. Hu, H. L. Keen, K. T. Lu, et al., Retinol-binding protein 7 is an endothelium-specific PPARgamma cofactor mediating an antioxidant response through adiponectin, JCI insight 2(6) (2017) e91738.
[2] Q. Mu, Q. He, H. Zhou, et al., Rosiglitazone Promotes Microglial Distribution via Activation of PPARgamma and CD36 in the ICH Rat Model, Neuro endocrinology letters 45(2) (2024) 96-106.
[3] F. Huang, Y. Li, J. Chen, et al., Rosiglitazone binds to RXRalpha to induce RXRalpha tetramerization and NB4 cell differentiation, Biochemical and biophysical research communications 530(1) (2020) 160-166.
[4] X. Xu, J. Wang, H. Jiang, et al., Rosiglitazone induces apoptosis on human bladder cancer 5637 and T24 cell lines, International journal of clinical and experimental pathology 10(10) (2017) 10197-10204.
[5] J. M. Ortiz-Rodriguez, C. Balao da Silva, J. Masot, et al., Rosiglitazone in the thawing medium improves mitochondrial function in stallion spermatozoa through regulating Akt phosphorylation and reduction of caspase 3, PloS one 14(7) (2019) e0211994.
[6] Q. Mu, L. Wang, H. Hang, et al., Rosiglitazone pretreatment influences thrombin-induced phagocytosis by rat microglia via activating PPARgamma and CD36, Neuroscience letters 651 (2017) 159-164.
[7] Y. Wang, Z. Yang, Y. Li, et al., Impact of Rosiglitazone on Subdermal Adipose Tissue Growth and Lipid Droplet Formation: An In Vitro and In Vivo Study, Aesthetic plastic surgery (2025).
[8] C. Chao, Y. Li, Q. Li, et al., Inhibitory effect and mechanism of Rosiglitazone on M1 type polarization of central microglia in intracerebral hemorrhage mice based on JNK/STAT3 signaling pathway, Brain and behavior 13(12) (2023) e3275.
[9] H. Zhang, L. You, M. Zhao, Rosiglitazone attenuates paraquat-induced lung fibrosis in rats in a PPAR gamma-dependent manner, European journal of pharmacology 851 (2019) 133-143.
相关文章
更多 >

