全新细胞死亡方式Mitoxyperilysis的机制及其在疾病治疗中的价值
2025-12-08 来源:本站 点击次数:46Cell发文!揭示了一种由先天免疫信号和代谢紊乱诱导的全新细胞死亡方式,并将其命名为——Mitoxyperiosis......
亮点抢先看:
1. 重磅发现:先天免疫和代谢信号协同作用通过线粒体氧化损伤诱导细胞死亡。
2.机制探究:(1) 线粒体-质膜长时间接触导致局部膜氧化损伤。(2) mTOR抑制剂可缩短接触时间并恢复膜完整性。
3.肿瘤治疗:治疗性激活先天免疫和代谢协同作用可缩小肿瘤体积。
Section.01
Cell:全新细胞死亡方式——
Mitoxyperilysis
2025 年 11 月 28 日,题为"Innate immune and metabolic signals induce mitochondria-dependent membrane lysis via mitoxyperiosis." 的研究型论文登上 Cell 期刊。该研究使用了1009298-09-2 (HY-10422,MCE)、CZ415 (HY-100222,MCE)、Dactolisib (HY-50673,MCE)、CK-666 (HY-16926,MCE) 等 MCE 产品。

文献报道了一种由先天免疫信号和代谢紊乱诱导的全新细胞死亡方式,并将其命名为——Mitoxyperiosis:特征是线粒体与质膜的长时间接触,导致局部膜氧化损伤和破裂,进而导致膜溶解、细胞死亡,这一过程受 mTOR 调节。
该机制独立于 Caspase 活性,也不同于先前报道的细胞焦亡、PANoptosis、坏死性凋亡、铁死亡和氧化应激。
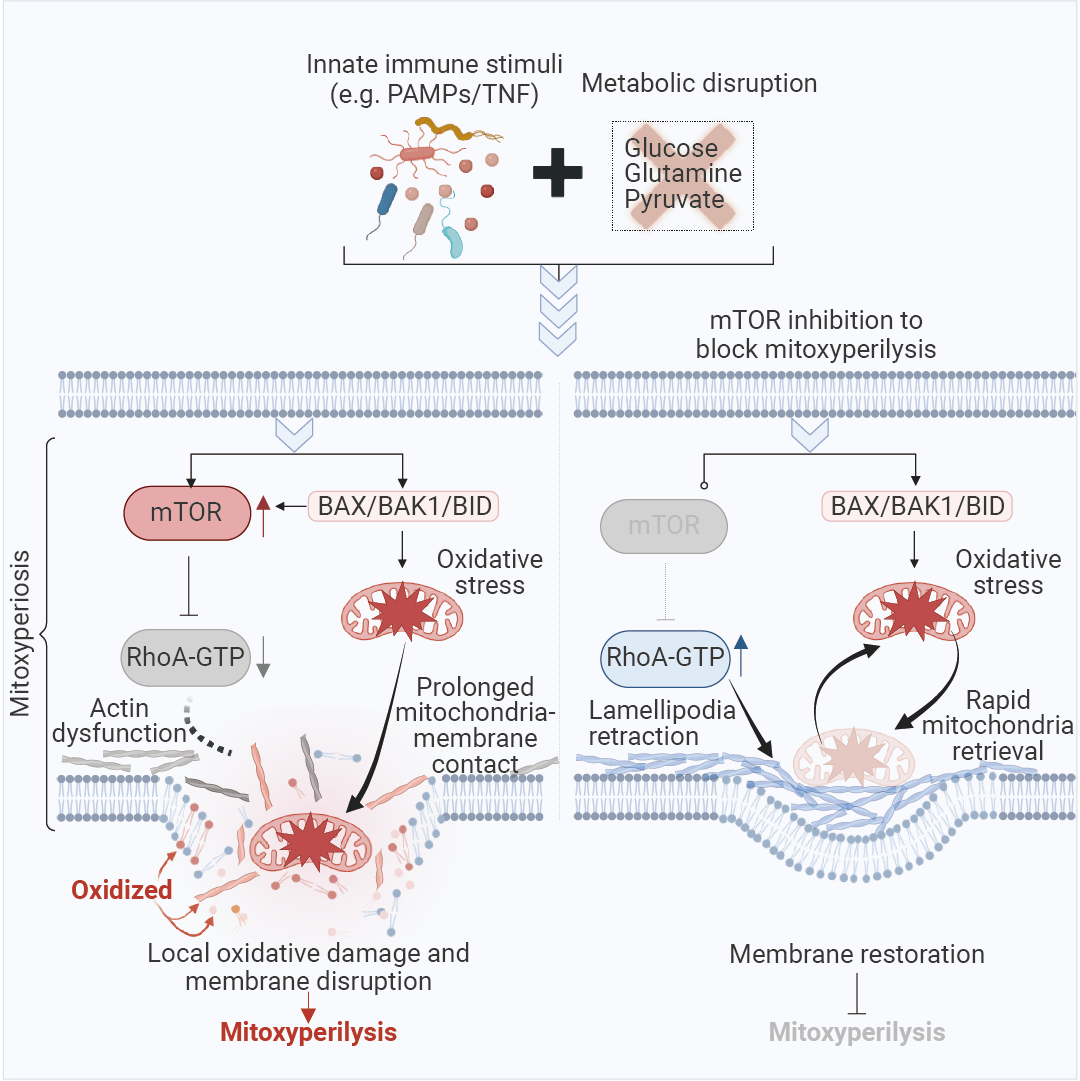 图 1. 先天免疫和代谢信号通过线粒体膜氧化溶解诱导线粒体依赖性膜溶解[1]。
图 1. 先天免疫和代谢信号通过线粒体膜氧化溶解诱导线粒体依赖性膜溶解[1]。IIAMD:诱导独特的炎症细胞死亡
在病理状态下,先天免疫激活通常伴随着营养物质的缺乏,从而导致代谢紊乱。
为了探究其潜在机制,作者用先天免疫刺激物 (PAM3、poly[I:C]、LPS 和 R848) 处理处于碳饥饿 (CS) 状态下的骨髓源性巨噬细胞 (BMDMs),以模拟疾病中所见的炎症诱导的代谢紊乱相关细胞死亡 (IIAMD) 的协同作用。
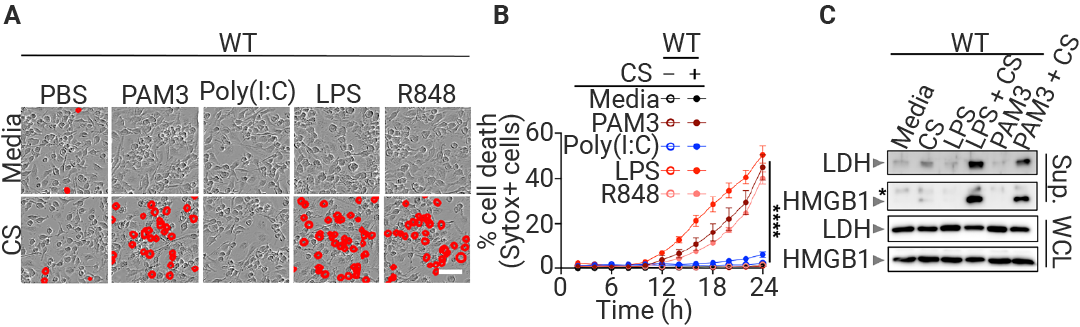 图 2. IIAMD 协同作用诱导炎症细胞死亡和炎症小体激活[1]。
图 2. IIAMD 协同作用诱导炎症细胞死亡和炎症小体激活[1]。野生型 (WT) BMDM 细胞在正常培养基 (Media) 或碳饥饿培养基 (CS) 中用 PBS 或免疫刺激物处理。图中显示了 24 小时后的代表性图像 (A) 和细胞死亡的定量结果 (B)。图中还显示了上清液 (sup.) 和全细胞裂解液 (WCL) (C) 中的 LDH 和 HMGB1 水平。*非特异性条带。
如图所示,BMDMs 单独处于碳饥饿或仅受到先天免疫激活时,对细胞溶解性死亡具有抗性。
(细胞:我挺好的)
但将碳饥饿与 PAM3、LPS 或 R848 联合使用 (不包括 poly[I:C]),则会诱导强烈的细胞溶解性死亡 (图 1A 和 1B)。同时,发现细胞膜破裂的标志物——乳酸脱氢酶 (LDH) 和高迁移率族蛋白 B1 (HMGB1) 的释放 (图 1C)。
(母鸡啊~嘎了咱就是说)
更重要的是:细胞对协同 1AMD 作出的死亡反应并不依赖于细胞焦亡、细胞凋亡、细胞坏死性凋亡、PAN 凋亡或铁死亡。
Mitoxyperilysis 特征:谷胱甘肽耗竭 → 氧化应激
采用代谢组学方法来表征 Mitoxyperilysis 的代谢特征。
与正常培养基、CS 或 LPS 处理相比,用 LPS 加 CS 处理的细胞具有明显的代谢谱特征 (图 3A)。且 LPS + CS 组的谷胱甘肽 (GSH) 代谢降低 (图 3G)。
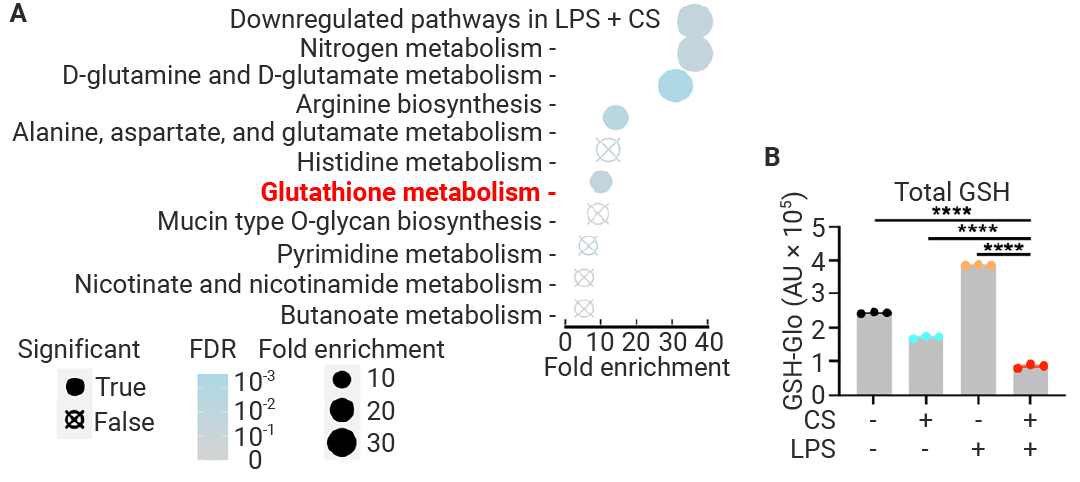 图 3. GSH 耗竭和氧化应激是 IIAMD 的关键特征[1]。
图 3. GSH 耗竭和氧化应激是 IIAMD 的关键特征[1]。(A) 在 MetaboAnalyst 5.0 的富集分析模块中进行的通路富集分析,结果显示在 LPS + CS 处理后共同且显著下调的代谢物。FDR < 0.05 视为具有统计学显著性。(B) 采用 GSH-Glo 测定全谷胱甘肽 (GSH) 水平:在加入以及不加入 CS 和 LPS 刺激的 BMDMs 中,于刺激后 9 小时从全细胞裂解液 (WCL) 检测获得。
咱就是说,GSH 是一种抗氧化剂,能够对抗活性氧 (ROS) 并防止氧化损伤。GSH 水平降低,那氧化应激......?
使用 CellROX DeepRed (CellROX-DR) 荧光探针对活细胞进行成像显示,在细胞膜损伤和细胞死亡发生之前,细胞内氧化应激水平逐渐升高 (图 4)。大多数变为碘化丙啶 (PI) 阳性 (表明其已发生细胞死亡) 的细胞也含有 CellROX-DR,表明细胞在发生死亡时存在氧化应激。
 图 4. 对 IIAMD 作出反应的细胞死亡发生氧化应激[1]。
图 4. 对 IIAMD 作出反应的细胞死亡发生氧化应激[1]。BMDMs 在有或无 LPS 或 CS 刺激条件下的活细胞荧光成像 (随时间变化)。CellROX-DR (蓝色) 用于指示细胞氧化应激,碘化丙啶 (PI;红色) 用于指示细胞死亡。时间轴以刺激开始的时间为基准。
Mitoxyperilysis 特征:线粒体与质膜持续接触 → 细胞裂解
作者进一步进行了共聚焦活细胞成像 (图 5)。在 LPS + CS 的作用下,细胞内代表氧化应激的 CellROX-DR 阳性斑点长时间稳定地定位于靠近质膜的位置 (>20 min) 。在斑点与质膜接触的部位,质膜最初发生退化,最终破裂,使不透膜的 Sytox 染料得以进入并染色细胞核。
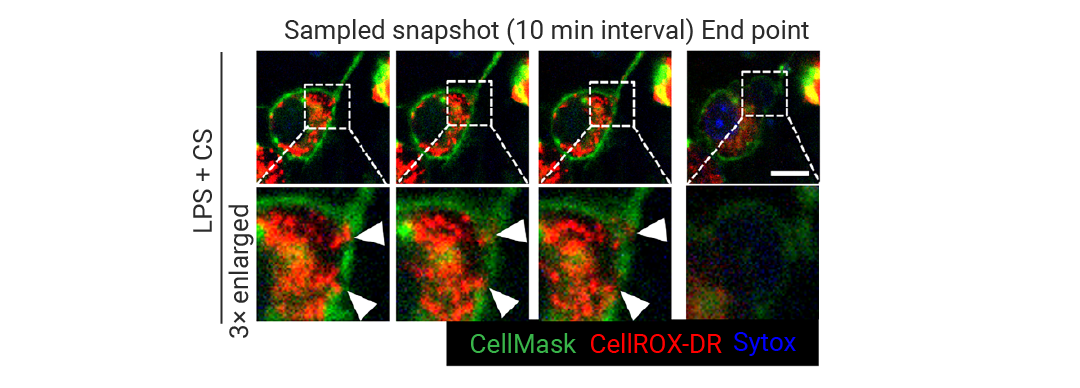 图 5. IIAMD导致线粒体滞留在质膜上[1]。
图 5. IIAMD导致线粒体滞留在质膜上[1]。BMDMs 在 CS 培养基中接受 LPS (200 EU/mL) 刺激的活细胞共聚焦显微成像。CellMask (绿色) 用于指示细胞膜,CellROX Deep Red (CellROX-DR,红色) 用于指示氧化应激,Sytox Orange (蓝色) 用于指示细胞膜受损后进入细胞的 DNA (另见视频 S1)。成像开始于刺激后 14 小时,所展示的图像之间间隔 10 分钟。白色箭头标注了线粒体与细胞膜接触的位置以及随后发生的膜破裂。
以及,经验证,这种氧化应激发生在线粒体 (图 6A)。并且,这种线粒体与膜的长时间接触是 IIAMD 诱导的细胞死亡所特有的。在每个破裂部位发生膜破裂之前,脂质过氧化逐渐增加 (图 6)。
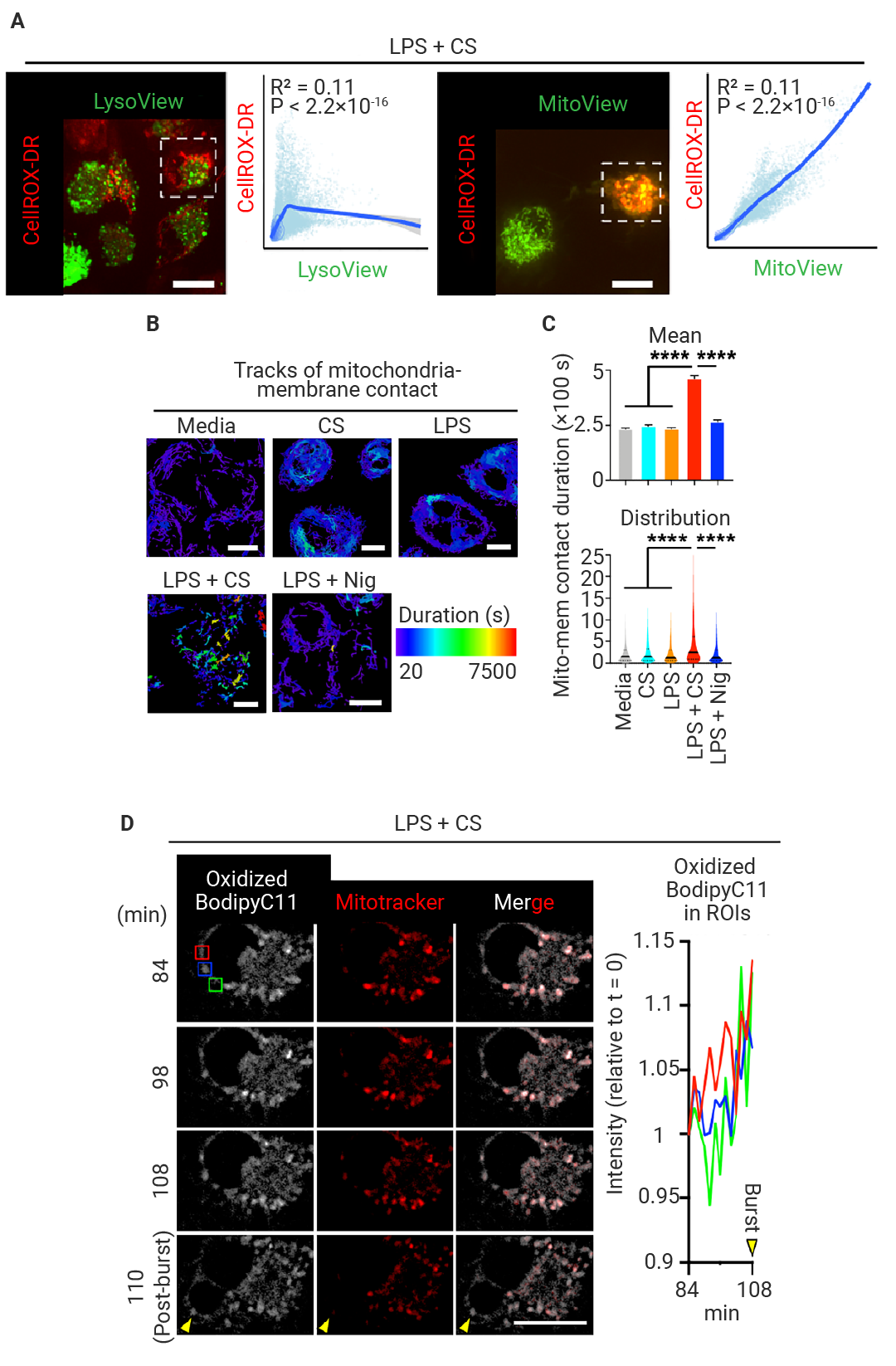 图 6. 线粒体滞留在质膜上,促进局部膜氧化损伤,并通过线粒体氧化损伤途径导致细胞死亡[1]。
图 6. 线粒体滞留在质膜上,促进局部膜氧化损伤,并通过线粒体氧化损伤途径导致细胞死亡[1]。(A) 处于 CS 培养基并加入 LPS 的 BMDMs,在 14 小时使用所示探针进行染色的活细胞成像。图中同时展示了选框细胞的像素强度曲线,以及对应荧光信号之间的皮尔森相关性分析与 Loess 回归曲线。(B-C) 在所有测试条件下,线粒体均积极与膜结合,但当细胞仅用培养基、CS 或 LPS处理时,大多数结合是短暂的 (<4 min) (B 和 C)。相比之下,LPS 加 CS 诱导的结合时间显著延长,一些线粒体与膜的结合时间延长 (>20 min) (B 和 C)。(D) 在细胞膜变形发生之前,线粒体持续定位于细胞周边靠近膜破裂的部位 (Mitotracker 通道)。周边脂质过氧化灶也与线粒体共定位 (Oxidized BodipyC11 和 Merge 通道)。
作者称其之为“线粒体向细胞周边传递活性氧”的过程,在膜局部造成氧化损伤的累积。随后,这一过程导致局部膜破裂和细胞溶解,即“线粒体向细胞周边传递活性氧导致的细胞溶解” (Mitoxyperilysis)。
Section.02
Mitoxyperilysis机制:
mTOR 激活、氧化应激独立作用
关键上游因子:BAX, BAK1 和 BID
作者发现,在 IIAMD 期间线粒体收到了损伤。于是开展了对 BH3 结构域蛋白 (在破坏线粒体方面发挥重要作用) 的探究。
构建了具有 Bax,Bakl 和 Bid 单基因、双基因或三基因缺陷的永生化骨髓源性巨噬细胞 (iBMDM) 敲除细胞系。发现 Bax-/-Bakl-/-Bid-/- 细胞免受 IIAMD 诱导的细胞死亡和炎性小体激活。且 Bax-/-Bakl-/-Bid-/- 细胞的氧化应激水平明显低于对照细胞。表明 BAX、BAK1 和 BID 是线粒体损伤和氧化应激驱动 IIAMD 诱导的炎症性细胞死亡的关键上游调节因子。
BAX、BAK1 和 BID 依赖性线粒体损伤及氧化应激驱动线粒体氧化溶解性死亡。
mTOR 会在 IIAMD 诱导下促进细胞死亡
为了解调节线粒体损伤与质膜接触的机制,作者筛选了一个包含 2050 种小分子的库,得到了三种对 LPS 和 CS 有保护作用的 mTOR 激酶抑制剂,均能够剂量依赖性地抑制线粒体氧化裂解(图 7)。
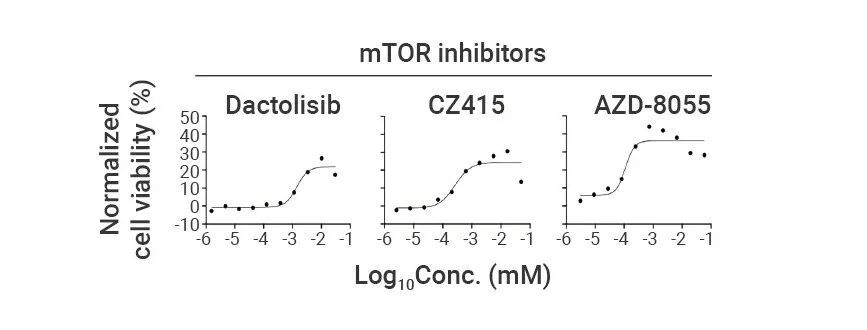 图7. 三种 mTOR 抑制剂 (Torin-1、CZ415(HY-100222,MCE)、AZD-8055(10289298-02,HY-10422,MCE)) 在 IIAMD 模型中均表现出剂量依赖性的保护作用,显著抑制细胞死亡[1]。
图7. 三种 mTOR 抑制剂 (Torin-1、CZ415(HY-100222,MCE)、AZD-8055(10289298-02,HY-10422,MCE)) 在 IIAMD 模型中均表现出剂量依赖性的保护作用,显著抑制细胞死亡[1]。RNA 测序显示, mTOR 通路是 LPS + CS 处理后上调最显著的通路之一。同时,线粒体损伤与质膜接触的触发因素会激活 mTORC1 和 mTORC2。
此外,在 mTOR 抑制期间,总谷胱甘肽水平仍保持较低 (图 8A)。且 mTOR 抑制未能恢复 IIAMD 诱导的线粒体呼吸功能受损 (图 8B-C)。用 LPS 加 CS 处理的细胞在 mTOR 抑制后仍维持高水平的氧化应激,但长时间保持 PI 不通透 (图 8D)。
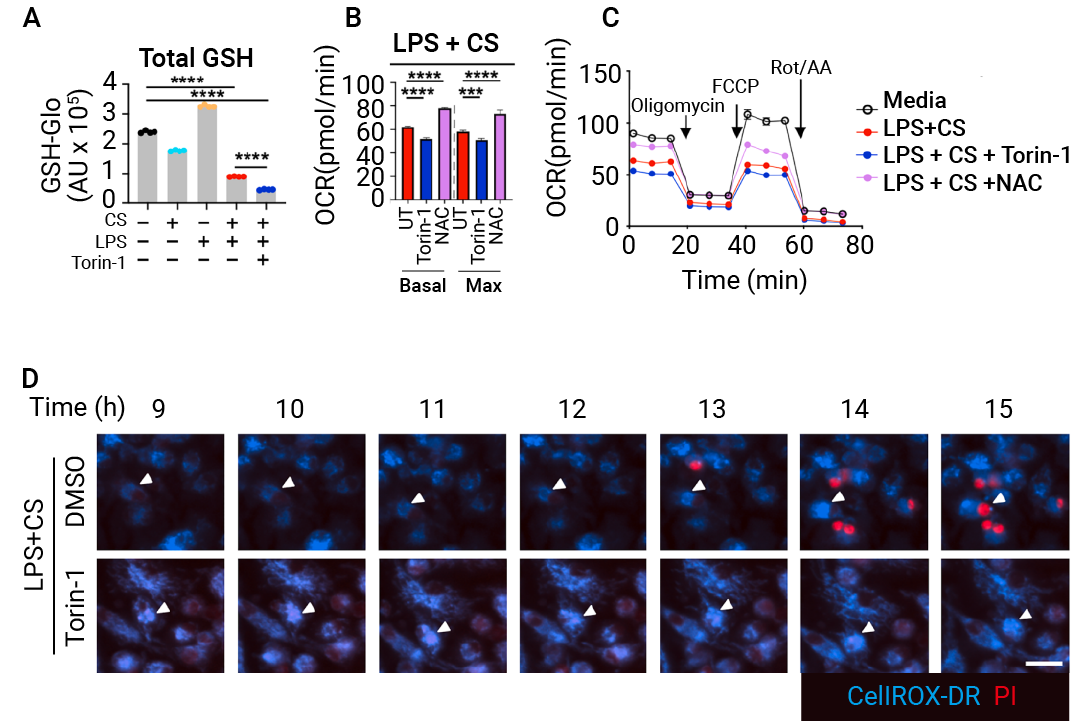 图 8. mTOR 驱动线粒体氧化应激,以应对 IIAMD[1]。
图 8. mTOR 驱动线粒体氧化应激,以应对 IIAMD[1]。(A) 在所示条件下刺激 BMDMs 12 小时后,从全细胞裂解液 (WCL)中检测氧化应激水平 (以全谷胱甘肽 GSH 含量衡量)。(B-C) 在所示条件下刺激 BMDMs 12 小时后,利用 Seahorse 测得的氧耗率 (OCR)。其中,(B) 显示基础及最大 OCR,(C) 显示 OCR 动态变化。(D) BMDMs 在 LPS + CS 条件下 ± Torin-1 的活细胞成像 (拍摄于所示时间点)。CellROX-DR (蓝色) 指示细胞氧化应激,PI (红色) 指示细胞死亡。白色箭头标示氧化应激增强的代表性细胞。时间轴相对于刺激开始时间。
这些结果表明,在线粒体氧化损伤中, mTOR 激活和氧化应激是独立事件, mTOR 在线粒体功能障碍后促进细胞死亡。
mTOR 可抑制细胞骨架活性,延长线粒体与质膜接触
为了进一步探究 mTOR 调节线粒体膜接触的机制,作者进行了活细胞成像。在 IAMD 处理且 mTOR 功能正常的细胞中观察到的线粒体膜接触时间延长。IIAMD 使细胞膜力学和伪足形成显著减少 (图 9C-D)。而用 mTOR 抑制剂 Torin-1 处理的细胞频繁形成片状伪足 (图 9A),透射电镜证实了这一现象 (图 9B)。由于片状伪足在靠近线粒体膜接触部位频繁形成,膜相关线粒体从质膜处移开,导致接触时间缩短。
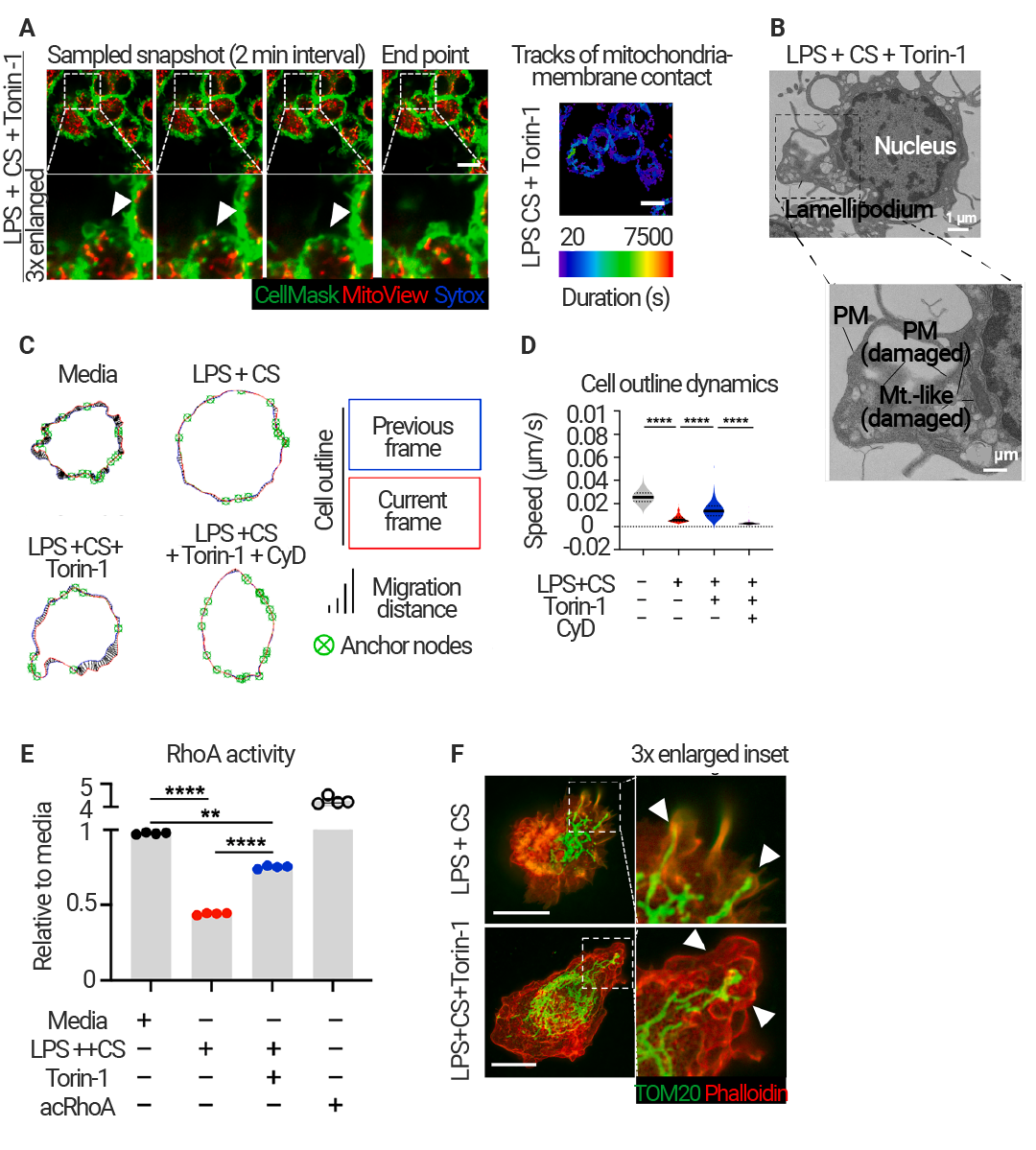 图 9. mTOR 通过抑制细胞骨架活性,促进线粒体在质膜上的持续滞留,从而驱动线粒体周细胞溶解[1]。
图 9. mTOR 通过抑制细胞骨架活性,促进线粒体在质膜上的持续滞留,从而驱动线粒体周细胞溶解[1]。(A) 处于 CS 培养基并加入 LPS 及 Torin-1 刺激的 BMDMs 的活细胞成像。CellMask (绿色,标记细胞膜);MitoView (红色,标记线粒体);Sytox DR (蓝色,用于标记细胞膜受损后进入细胞的 DNA) (另见视频 S9)。成像开始于刺激后 14 小时,所示图像之间间隔 2 分钟。用于绘制细胞膜相关线粒体定位的轨迹,并根据线粒体与细胞膜接触的持续时间以颜色区分。白色箭头标示周边区域的线粒体共定位与伪足 (lamellipodium) 回缩现象。(B) 来自经 LPS + CS + Torin-1 处理 16 小时的 BMDMs 的代表性透射电镜(TEM)图像。Mt.-like 表示线粒体样结构;PM 表示细胞膜。(C-D) 采用 QuimP 分析细胞轮廓动态。(C) 显示连续两个时间点的代表性细胞轮廓叠加图;(D) 显示在所有时间点中细胞轮廓运动的速度分布 (另见视频 S10)。(E) 在所示条件下刺激 BMDMs 12 小时后检测 RhoA 活性 (RhoA-GTP)。Active RhoA (acRhoA) 作为阳性对照。(F) BMDMs 在 LPS + CS 条件下 ± Torin-1 处理 16 小时后的代表性 tauSTED 成像,显示线粒体 (TOM20;绿色) 和膜褶伪足 (lamellipodium) 中的肌动蛋白 (鬼笔环肽;phalloidin;红色) 。白色箭头标示细胞膜突起结构。
片状伪足的活动和细胞膜的动态变化受 RhoA 及其他控制肌动蛋白聚合的 Rho-GTP 酶的调节。实际上,LPS + CS 处理后 RhoA 的活性降低 (抑制 mTOR 可部分恢复其活性) (图 9E),且线粒体(TOM20染色)呈周边分布,周围几乎没有 F- 肌动蛋白 (Phalloidin 染色),而 Torin-1 则诱导形成富含 F- 肌动蛋白褶皱的板状伪足,以包裹突出的线粒体 (图 9F)。
Section.03
Mitoxyperilysis:
癌症治疗新思路
接下来,作者试图在体内应用治疗策略。在 B16 黑色素瘤异位肿瘤模型中,给荷瘤小鼠进行瘤内 (i.t.) 注射低剂量 LPS 并结合禁食处理 (图 10A)。结果显示,肿瘤体积显著缩小 (图 10B),坏死增加 (图 10C-D)。而在给荷瘤小鼠禁食和腹腔注射之前用 Torin-1 进行处理。mTOR 抑制导致肿瘤大小没有显著变化,肿瘤坏死减少 (图 10B-D)。
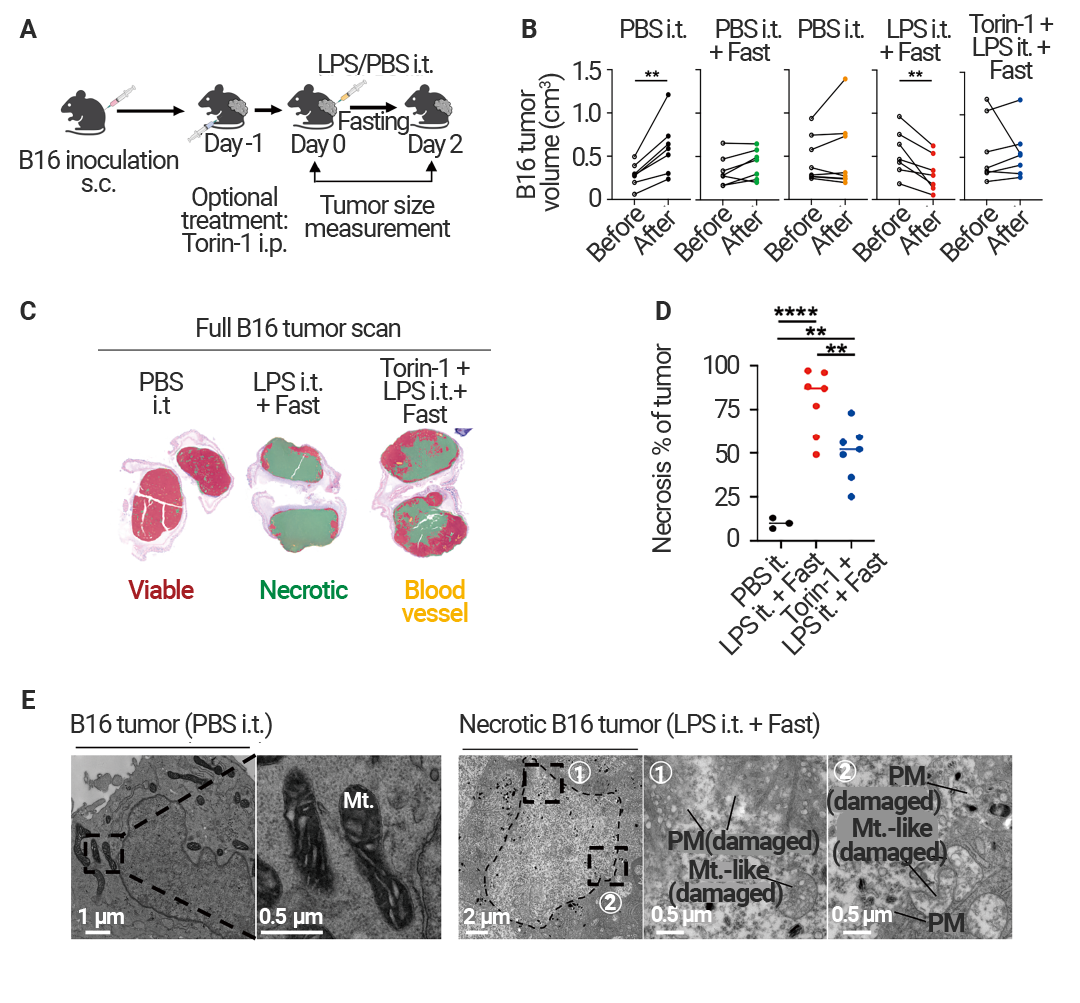 图 10. IIAMD 协同可诱导 mTOR 介导的肿瘤坏死和缩小[1]。
图 10. IIAMD 协同可诱导 mTOR 介导的肿瘤坏死和缩小[1]。(A) 治疗策略示意图。s.c. 表示皮下给药;i.p. 表示腹腔注射;i.t. 表示肿瘤内注射。(B) 在 PBS 或 LPS 进行肿瘤内注射 (i.t.),并结合或不结合禁食与 Torin-1 预处理条件下,小鼠 B16 肿瘤大小的变化。(C-D) 指定实验组的肿瘤组织苏木精-伊红 (H&E) 染色图像,其中 (C) 标注了可存活区域与坏死区域,(D) 为其量化结果。(E) 对照组与处理组 (坏死区域) B16 肿瘤组织的代表性透射电镜 (TEM) 图像。Mt. 表示线粒体;Mt.-like 表示线粒体样结构;PM 表示细胞膜。
此外,肿瘤中的 RhoA 活性显著降低,加入 Torin-1 处理后 RhoA 活性部分恢复。坏死肿瘤中靠近质膜处存在受损的线粒体样细胞器 (图 10E),这支持了线粒体近膜损伤在体内肿瘤细胞死亡中的作用。
这些数据表明,线粒体损伤可作为治疗手段被激活以减轻肿瘤负荷。
Section.04
小结
这一机制的发现不仅扩展了细胞死亡研究的边界,也提示了其潜在的疾病治疗价值,尤其是在免疫激活和代谢紊乱共存的肿瘤微环境中。未来通过调控线粒体氧化应激或 mTOR 活性,可能为肿瘤与炎症相关疾病提供新的干预思路。不过,目前仍需更多研究来评估其安全性、选择性和临床可行性。
|
产品推荐 |
|
Dactolisib (BEZ235) 是一种具有口服活性的、双重的 pan-class I PI3K 和 mTOR 抑制剂。 |
|
CZ415 是一种有效的高选择性 mTOR 抑制剂,pIC50 为 8.07。 |
|
CK-666 是一种细胞渗透性的与肌动蛋白相关的蛋白质 Arp2/3 复合物的抑制剂 (IC50=12 μM),它结合 Arp2/3 复合物,稳定复合物的非活性状态,阻止 Arp2 和 Arp3 亚单位移动进入激活的丝状构象。 |
|
AZD-8055 是一种有效、选择性、具有口服活性和 ATP 竞争性的 mTOR 抑制剂,IC50 为 0.8 nM。AZD-8055 抑制 mTORC1 和 mTORC2。 |
|
SM-164 是一种可渗透细胞的 Smac 类似物,SM-164 用作 XIAP 的强效拮抗剂。 |

[1] Wang Y, Lu J, Carisey AF, et al. Innate immune and metabolic signals induce mitochondria-dependent membrane lysis via mitoxyperiosis. Cell. Published online November 28, 2025.



