中乔新舟HFL1人胚肺成纤维细胞、无血清细胞冻存液等应用文献精选
2026-01-27 来源:本站 点击次数:89
中乔新舟产品11月份发表文献精选,最高影响因子16
1.题目: 通过由Niemann-Pick C1-Like 1(NPC1L1)介导的营养感知驱动通路,肿瘤特异性递送纳米药物
Tumor-Specific Delivery of Nanomedicines via a Nutrient Sensing-Driven Pathway Mediated by Niemann-Pick C1-Like 1
DOI:10.1021/acsnano.5c10653
发表时间:2025-11-9
发表期刊:ACS Nano
影响因子:16
作者单位: 南方医科大学
文章摘要:
在细胞层面,外源纳米颗粒(NPs)通常表现出膜结合与内化过程的解耦,主要的溶酶体捕获通路导致递送效率受限。实现NPs的主动细胞摄取与非溶酶体细胞内运输的同时性,一直是一项重大挑战。作者利用尼曼-皮克C1样1(NPC1L1)介导的营养感知通路,开发了肿瘤特异性递送策略。作为肠道和肝脏胆固醇运输的跨膜蛋白,NPC1L1在包括肺癌和肝癌在内的多种肿瘤中异位过度表达。因此,作者设计了胆固醇表面显示胆固醇NPs(CSD-NPs),它们通过非溶酶体途径选择性且快速地内吞到肿瘤细胞,这得益于NPC1L1介导的营养感知和表面显示胆固醇的信号传导。在分子机制明确后,CSD策略被用于重建商业抗癌Doxil纳米配方,并制造肿瘤特异性基因递送纳米载体。CSD-NPs在低剂量下表现出增强的抗肿瘤活性,化疗和基因治疗的抑制率约为90%,且生存期显著延长。总之,报道的胆固醇表面显示策略为开发具有先进治疗功能的纳米药物提供了有前景的平台。
部分结果展示:
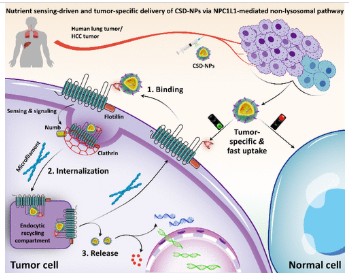
中乔新舟生物的产品HFL1人胚肺成纤维细胞(货号:ZQ0380 )参与了该项研究。、
2. 题目: 二元焦磷遁扩增自组装前药纳米医学增强免疫原性并抑制卵巢癌的腹部转移
Binary pyroptosis-amplified self-assembling prodrug nanomedicine enhances immunogenicity and inhibits abdominal metastasis in ovarian cancer
DOI:10.1016/j.apsb.2025.10.042
发表时间:2025-11-1
发表期刊:Acta Pharmaceutica Sinica B
影响因子:14.6
作者单位: 南方医科大学
文章摘要:
卵巢癌因其高度易发生腹部转移、复发以及免疫抑制性肿瘤微环境的存在,仍是一大治疗难题。为克服这些障碍,作者开发了自组装纳米平台(OSN),将近红外半导体聚合物与草沙铂(IV)前药整合。这一多功能设计使得光热疗法(PTT)、光动力疗法(PDT)和化疗在单一纳米颗粒内协同,有效增强免疫原性细胞死亡(ICD)和系统性抗肿瘤免疫。激光照射时,OSN生成局部高热和活性氧。这些效应协同增强了草沙利铂的活化和肿瘤穿透,同时通过半胱天冬酶1介导和半胱天冬酶3依赖的双重途径触发缓溶。这种强健的灼食反应增强了损伤相关分子模式(如ATP、HMGB1)和促炎细胞因子(如IL-18、IL-1β)的释放,从而重塑免疫抑制微环境,促进树突状细胞成熟,并促进细胞毒性T细胞浸润。在小鼠卵巢癌模型中,OSN实现了超过90%的肿瘤抑制率,显著优于单药治疗。值得注意的是,该纳米平台建立了长期免疫记忆,有效降低肿瘤复发风险。通过同时针对免疫屏障和多模态机制转移进展,OSN代表了一种具有高度临床可迁移性的范式策略,用于治疗侵袭性卵巢恶性肿瘤。
部分结果展示:
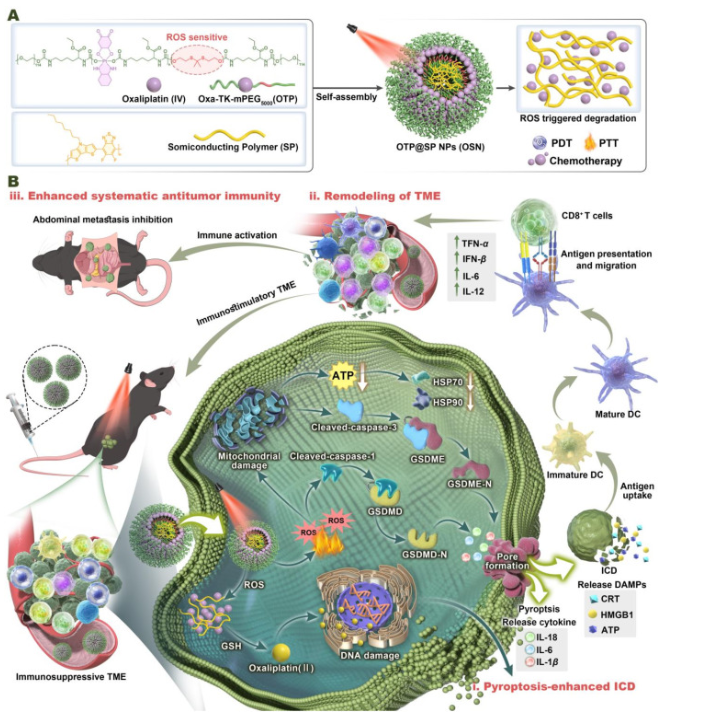
方案1.装载奥沙利铂(IV)多前前药(OTP)的半导体聚合物(SP)纳米颗粒的设计及治疗机制的示意图,用于光疗和化疗免疫疗法。
中乔新舟生物的产品无血清细胞冻存液(货号:CSP042 )参与了该项研究。

3. 题目:冷暴露诱导的β羟丁酸盐促进棕色脂肪线粒体脂滴接触,从而缓解脂肪功能障碍和肝脂肪变
Cold exposure-induced β-hydroxybutyrate promotes brown fat mitochondrial lipid droplet contact to ameliorate fatty dysfunction and hepatic steatosis
DOI:10.1016/j.apsb.2025.11.014
发表时间:2025-11-13
发表期刊:Acta Pharmaceutica Sinica B
影响因子: 14.6
作者单位: 哈尔滨医科大学
文章摘要:
寒冷暴露会激活棕色脂肪组织(BAT),以缓解代谢紊乱。然而,BAT中线粒体脂滴接触(MLC)的调控机制及其与这些益处的关联尚不明确。本研究中,作者鉴定肝源β羟丁酸(BHB)作为驱动BAT中MLC形成的关键介质。在机制上,BHB直接靶向RAB10的GLY-67残基,增强其与PLIN5的相互作用,形成RAB10–PLIN5复合物,从而促进MLC的生成。该相互作用通过SPIDER和生物素标记的拉下检测法得到验证。在功能上,BHB治疗减少脂肪毒性并改善饮食诱导的肥胖小鼠的代谢健康。这些发现确立了BHB作为BAT MLC与全身代谢益处之间的关键纽带,凸显了RAB10–PLIN5复合物作为肥胖和肝脂变的治疗靶点。此外,这项工作强调了寒冷诱导代谢适应在抗击代谢疾病中的更广泛重要性。
部分结果展示:
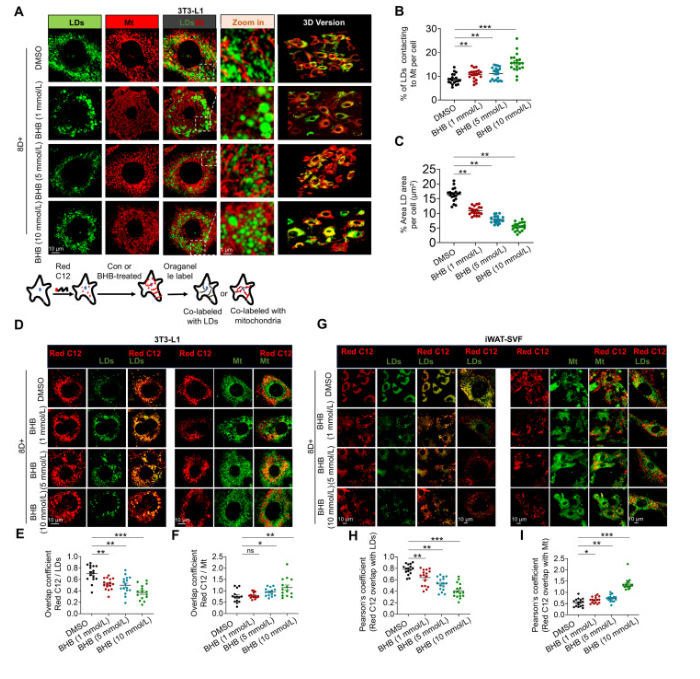
图3.BHB促进棕色脂肪细胞中的线粒体脂滴接触。
(D) FAs由C12检测,线粒体用Mitotracker Green染色,脂滴则用BODIPY染色,成熟棕色脂肪细胞由3T3-L1细胞诱导。
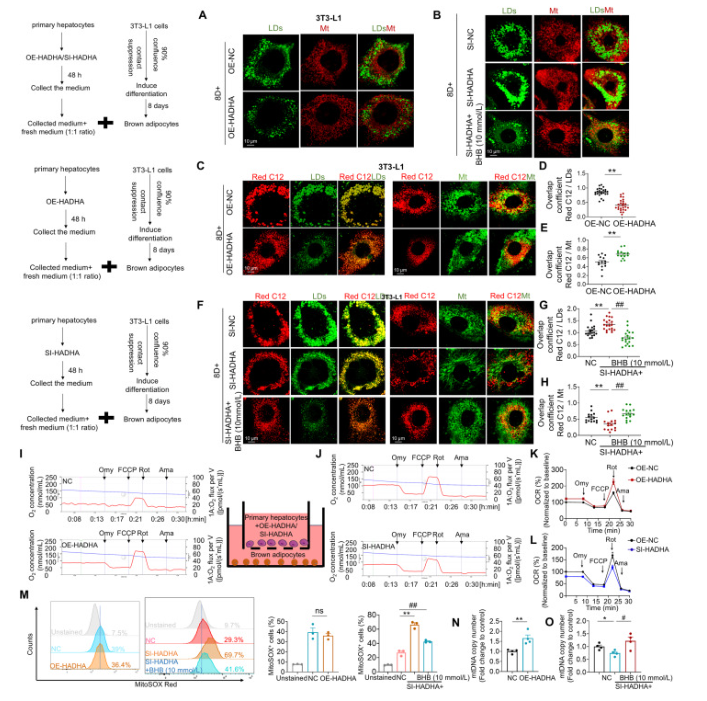 图4。肝细胞中的HADHA调控BHB,促进BH向BAT中LD向线粒体的脂肪酸转移。
图4。肝细胞中的HADHA调控BHB,促进BH向BAT中LD向线粒体的脂肪酸转移。
(A)在HADHA对原级肝细胞的过度表达后,收集其培养基,并与从3T3-L1细胞诱导的成熟棕色脂肪细胞共培养48小时。成熟棕色脂肪细胞的线粒体通过Mitotracker红色染色和脂滴通过BODIPY染色可视化。每组中 n = 13。(b)在HADHA敲低原级肝细胞后,收集其培养基,并与3T3-L1细胞诱导的成熟棕色脂肪细胞共培养48小时。成熟棕色脂肪细胞的线粒体通过Mitotracker红染色和脂滴通过BODIPY染色可见。每组中 n = 20。(C–E)在原级肝细胞中HADHA过度表达后,其培养基被收集并与3T3-L1细胞诱导的成熟棕色脂肪细胞共培养,C12检测到棕色脂肪细胞FA,线粒体用Mitotracker Green染色,脂滴用BODIPY染色。FA定位于线粒体或FA定位于LDs的统计数据。
中乔新舟生物的产品3T3-L1小鼠胚胎成纤维细胞(货号:ZQ0089 )参与了该项研究。

4. 题目:II型肺泡上皮细胞通过外泌体lncRNA rmrp释放,促进肺泡巨噬细胞中败血症诱导的免疫抑制
Type II Alveolar Epithelial Cells Promote Sepsis-Induced Immunosuppression in Alveolar Macrophages via Exosomal lncRNA Rmrp Release
DOI:10.1002/advs.202500376
发表时间: 2025-11-03
发表期刊:Advanced Science
影响因子:14.1
作者单位: 华南大学
文章摘要:
继发性肺炎是败血症诱导免疫抑制(SII)的常见并发症,主要由于糖酵解活性受损,导致肺泡巨噬细胞(AM)功能障碍。然而,其底层分子机制仍不明确。本研究发现,线粒体RNA加工内核酸酶(Rmrp)中的外泌体RNA成分,源自II型肺泡上皮细胞(AEC-IIs),在盲肠连接穿刺(CLP)败血症后,驱动AMs的糖解缺陷和免疫耐受。针对性地耗尽AEC-II或AMs中的Rmrp,缓解了由铜绿假单胞菌感染引起的SII和继发性肺炎,发生在CLP后48小时。从机制上看,Rmrp与RNA结合蛋白锌指蛋白36(ZFP36)相互作用并抑制其泛素化和降解。这导致ZFP36上调,进而加速6-磷果糖-2-激酶/果糖-2,6-双磷酸酶3(Pfkfb3)mRNA的衰变,通过结合其富含AU的3'未翻译区域元素。Pfkfb3 mRNA的降解导致糖酵解受损,并在败血症后抑制AMs的免疫反应。此外,研究发现外泌体RMRP水平与AM免疫耐受性及败血症患者的预后相关。这些发现凸显了AEC-II衍生的外泌体Rmrp在SII和继发性肺炎发病机制中的关键作用。重要的是,研究表明外泌体RMRP可能作为临床环境中预测和管理SII的生物标志物。
部分结果展示: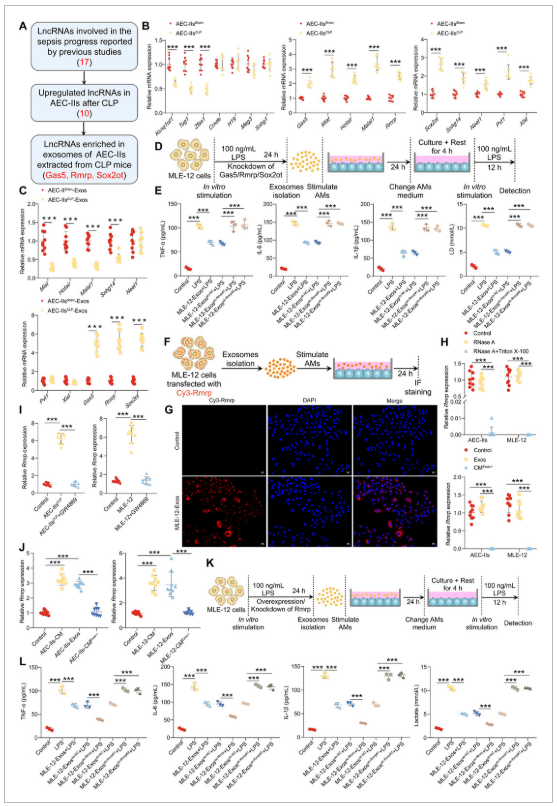 图2 AEC-II来源的外泌体Rmrp在败血症后抑制AMs的免疫反应和糖酵解。
图2 AEC-II来源的外泌体Rmrp在败血症后抑制AMs的免疫反应和糖酵解。
A)流程图,概述了调控AMs糖酵解和免疫反应的AEC-II衍生外泌体中候选lncRNA的筛选过程。B)对来自假或CLP小鼠的AEC-II中lncRNA表达进行逆转录定量PCR(RT-qPCR)分析(n=9/组)。E) 接受MLE-12细胞来源外泌体并随后用LPS刺激的AMs上清液中TNF-α、IL-6、IL-1β及乳酸水平的ELISA(n=3/组)。G)结合MLE-12细胞中Cy3标记外泌体孵育的AMs代表性荧光图像。尺度条:25微米高时,对用RNase A或Triton X-100处理的AEC-II或MLE-12细胞中CM中的Rmrp进行RT-qPCR分析(上方面板),以及AEC-II或MLE-12细胞(下组)CM或外泌体中的Rmrp表达(n=9/组)。I) 对AMs与AEC-II(左)或MLE-12细胞(右)共培养的AMs中Rmrp进行RT-qPCR分析(n=9/组)。J) 用CM或来自AEC-II细胞(左)或MLE-12细胞(右)的外泌体处理AMs的Rmrp RT-qPCR分析(n = 9/组)。L) 在与MLE-12细胞来源外泌体共培养及后续LPS刺激后,AMs上清液中TNF-α、IL-6、IL-1β及乳酸水平的ELISA(n=3/组)。数据以均值±标准差(SD)呈现。
中乔新舟生物的产品MLE-12小鼠肺泡上皮细胞(货号:ZQ0470 )参与了该项研究。
5. 题目:一种靶向的sirtuin-1基因激活四面体DNA通过SIRT1-FOXO3-BNIP3轴恢复成纤维细胞中的线粒吞噬,从而减弱膀胱纤维化
A Sirtuin-1-Targeted Gene-Activating Tetrahedral DNA Attenuates Bladder Fibrosis by Restoring Mitophagy in Fibroblasts via the SIRT1-FOXO3-BNIP3 Axis
DOI:10.1002/advs.202519527
发表时间:2025-11-23
发表期刊:Advanced Science
影响因子: 14.1
作者单位: 四川大学
文章摘要:
膀胱纤维化代表了全球范围内普遍的健康挑战,伴随着沉重的社会经济负担。迄今为止,尚无有效的治疗干预措施能够阻止或逆转其进展。基于小激活RNA(saRNA)的疗法因其高靶点特异性和强效疗效,近年来受到越来越多的关注。然而,saRNA的临床翻译仍受结构不稳定性、核酸酶敏感性和细胞内化效率低下等固有限制所阻碍。本研究整合了单细胞和整体转录组分析,显示SIRT1是唯一在纤维化膀胱组织和活化成纤维细胞中均显著下调的sirtuin家族成员。为此,设计了一种由saRNA功能化、靶向SIRT1激活的四面体DNA,称为TSA。TSA展现出卓越的生物相容性,显著减轻膀胱功能障碍和膀胱排气阻滞模型中的纤维化重塑。机制上,TSA给药能强健地恢复SIRT1表达,促进FOXO3A去乙酰化并减轻其对BNIP3的转录抑制。这一级联反应导致PINK1-PARKIN介导的线粒体吞噬被激活,抑制线粒体活性氧的积累,最终抑制成纤维细胞的激活和胶原蛋白沉积。这些令人信服的发现凸显了TSA作为治疗膀胱纤维化的有前景策略的潜力,并对临床应用具有广泛意义。
部分结果展示: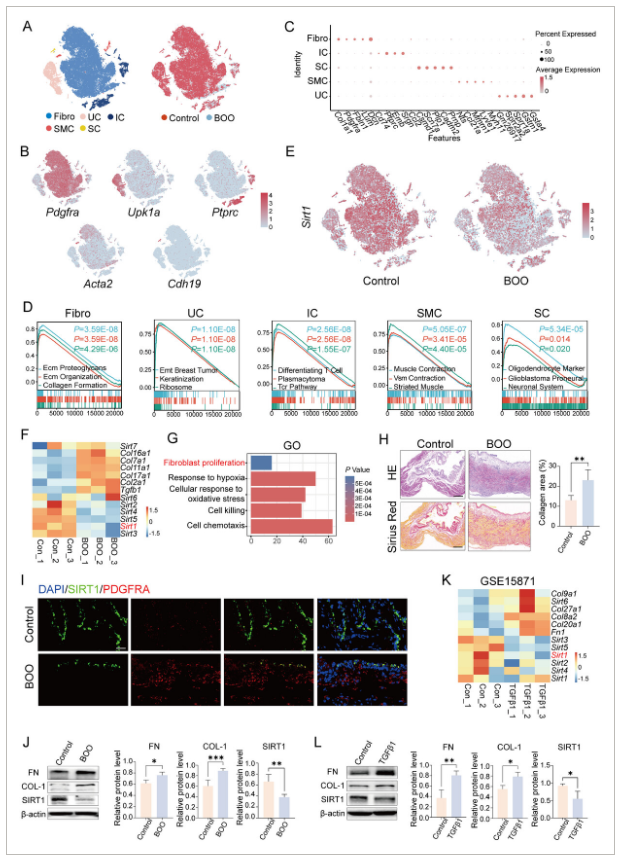 图1 SIRT1在纤维化膀胱组织和活化成纤维细胞中被下调。
图1 SIRT1在纤维化膀胱组织和活化成纤维细胞中被下调。
L)验证TGF-β1处理后培养小鼠膀胱成纤维细胞中SIRT1抑制作用。
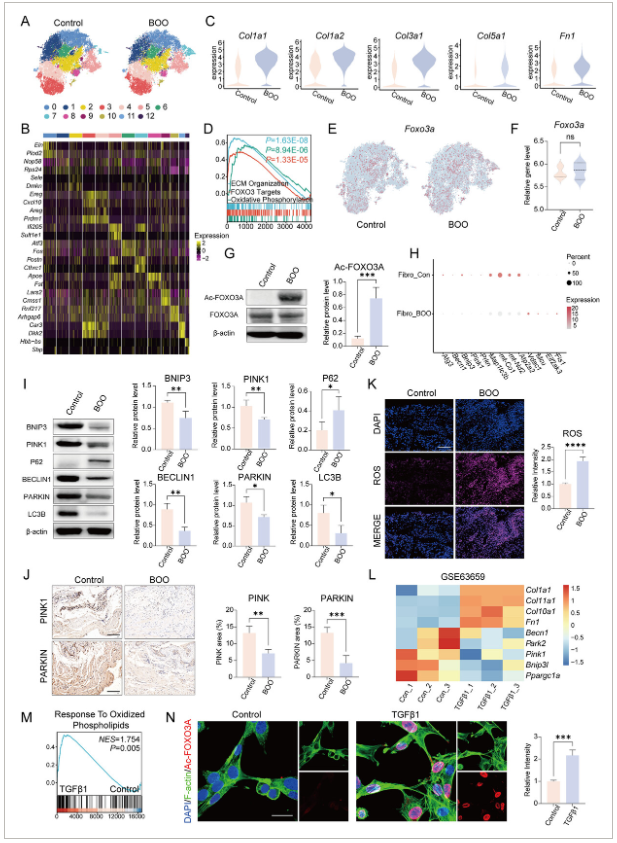 图2 SIRT1-FOXO3A-BNIP3轴失活通过线粒体吸收受损和氧化应激增强促进膀胱纤维化。
图2 SIRT1-FOXO3A-BNIP3轴失活通过线粒体吸收受损和氧化应激增强促进膀胱纤维化。
N) 免疫荧光验证确认,TGF-β1处理后小鼠膀胱成纤维细胞中的FOXO3A乙酰化增加(尺度条=25微米)。
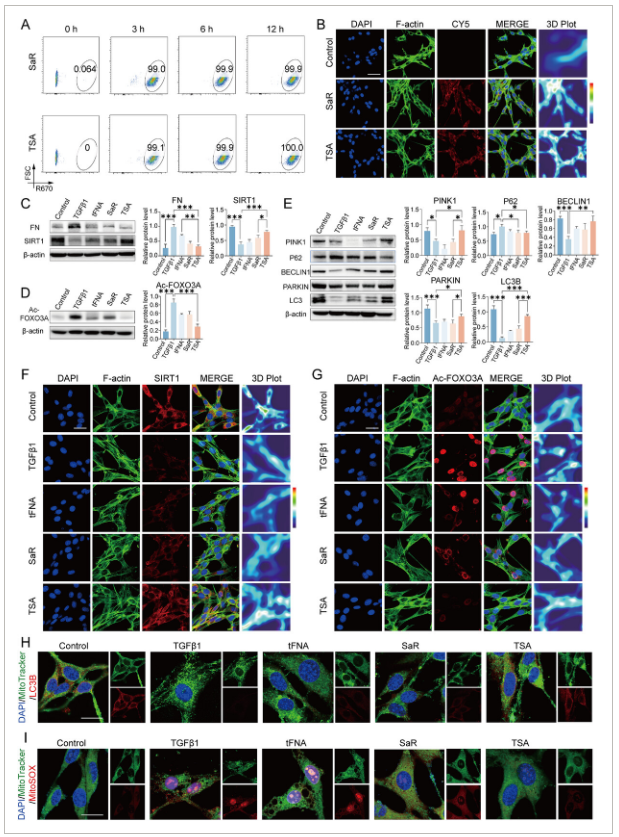 图4 TSA激活SIRT1-FOXO3A-BNIP3轴可减弱成纤维细胞活化和氧化应激。
图4 TSA激活SIRT1-FOXO3A-BNIP3轴可减弱成纤维细胞活化和氧化应激。
A)在治疗后3、6和12小时评估小鼠膀胱成纤维细胞中Cy5标记的SaR和TSA复合物的细胞摄取效率。(E) 培养小鼠膀胱成纤维细胞中关键线粒体调节因子(PINK1、BECLIN1、PARKIN、LC3)。(G)FOXO3A乙酰化的代表性免疫染色和热分析(尺度条=25微米)。
中乔新舟生物的产品原代小鼠膀胱成纤维细胞(货号:PRI-MOU-00118 )和原代小鼠膀胱成纤维细胞完全培养基(货号:PCM-M-118)参与了该项研究。


1.题目: 通过由Niemann-Pick C1-Like 1(NPC1L1)介导的营养感知驱动通路,肿瘤特异性递送纳米药物
Tumor-Specific Delivery of Nanomedicines via a Nutrient Sensing-Driven Pathway Mediated by Niemann-Pick C1-Like 1
DOI:10.1021/acsnano.5c10653
发表时间:2025-11-9
发表期刊:ACS Nano
影响因子:16
作者单位: 南方医科大学
文章摘要:
在细胞层面,外源纳米颗粒(NPs)通常表现出膜结合与内化过程的解耦,主要的溶酶体捕获通路导致递送效率受限。实现NPs的主动细胞摄取与非溶酶体细胞内运输的同时性,一直是一项重大挑战。作者利用尼曼-皮克C1样1(NPC1L1)介导的营养感知通路,开发了肿瘤特异性递送策略。作为肠道和肝脏胆固醇运输的跨膜蛋白,NPC1L1在包括肺癌和肝癌在内的多种肿瘤中异位过度表达。因此,作者设计了胆固醇表面显示胆固醇NPs(CSD-NPs),它们通过非溶酶体途径选择性且快速地内吞到肿瘤细胞,这得益于NPC1L1介导的营养感知和表面显示胆固醇的信号传导。在分子机制明确后,CSD策略被用于重建商业抗癌Doxil纳米配方,并制造肿瘤特异性基因递送纳米载体。CSD-NPs在低剂量下表现出增强的抗肿瘤活性,化疗和基因治疗的抑制率约为90%,且生存期显著延长。总之,报道的胆固醇表面显示策略为开发具有先进治疗功能的纳米药物提供了有前景的平台。
部分结果展示:

中乔新舟生物的产品HFL1人胚肺成纤维细胞(货号:ZQ0380 )参与了该项研究。、

2. 题目: 二元焦磷遁扩增自组装前药纳米医学增强免疫原性并抑制卵巢癌的腹部转移
Binary pyroptosis-amplified self-assembling prodrug nanomedicine enhances immunogenicity and inhibits abdominal metastasis in ovarian cancer
DOI:10.1016/j.apsb.2025.10.042
发表时间:2025-11-1
发表期刊:Acta Pharmaceutica Sinica B
影响因子:14.6
作者单位: 南方医科大学
文章摘要:
卵巢癌因其高度易发生腹部转移、复发以及免疫抑制性肿瘤微环境的存在,仍是一大治疗难题。为克服这些障碍,作者开发了自组装纳米平台(OSN),将近红外半导体聚合物与草沙铂(IV)前药整合。这一多功能设计使得光热疗法(PTT)、光动力疗法(PDT)和化疗在单一纳米颗粒内协同,有效增强免疫原性细胞死亡(ICD)和系统性抗肿瘤免疫。激光照射时,OSN生成局部高热和活性氧。这些效应协同增强了草沙利铂的活化和肿瘤穿透,同时通过半胱天冬酶1介导和半胱天冬酶3依赖的双重途径触发缓溶。这种强健的灼食反应增强了损伤相关分子模式(如ATP、HMGB1)和促炎细胞因子(如IL-18、IL-1β)的释放,从而重塑免疫抑制微环境,促进树突状细胞成熟,并促进细胞毒性T细胞浸润。在小鼠卵巢癌模型中,OSN实现了超过90%的肿瘤抑制率,显著优于单药治疗。值得注意的是,该纳米平台建立了长期免疫记忆,有效降低肿瘤复发风险。通过同时针对免疫屏障和多模态机制转移进展,OSN代表了一种具有高度临床可迁移性的范式策略,用于治疗侵袭性卵巢恶性肿瘤。
部分结果展示:

方案1.装载奥沙利铂(IV)多前前药(OTP)的半导体聚合物(SP)纳米颗粒的设计及治疗机制的示意图,用于光疗和化疗免疫疗法。
中乔新舟生物的产品无血清细胞冻存液(货号:CSP042 )参与了该项研究。

3. 题目:冷暴露诱导的β羟丁酸盐促进棕色脂肪线粒体脂滴接触,从而缓解脂肪功能障碍和肝脂肪变
Cold exposure-induced β-hydroxybutyrate promotes brown fat mitochondrial lipid droplet contact to ameliorate fatty dysfunction and hepatic steatosis
DOI:10.1016/j.apsb.2025.11.014
发表时间:2025-11-13
发表期刊:Acta Pharmaceutica Sinica B
影响因子: 14.6
作者单位: 哈尔滨医科大学
文章摘要:
寒冷暴露会激活棕色脂肪组织(BAT),以缓解代谢紊乱。然而,BAT中线粒体脂滴接触(MLC)的调控机制及其与这些益处的关联尚不明确。本研究中,作者鉴定肝源β羟丁酸(BHB)作为驱动BAT中MLC形成的关键介质。在机制上,BHB直接靶向RAB10的GLY-67残基,增强其与PLIN5的相互作用,形成RAB10–PLIN5复合物,从而促进MLC的生成。该相互作用通过SPIDER和生物素标记的拉下检测法得到验证。在功能上,BHB治疗减少脂肪毒性并改善饮食诱导的肥胖小鼠的代谢健康。这些发现确立了BHB作为BAT MLC与全身代谢益处之间的关键纽带,凸显了RAB10–PLIN5复合物作为肥胖和肝脂变的治疗靶点。此外,这项工作强调了寒冷诱导代谢适应在抗击代谢疾病中的更广泛重要性。
部分结果展示:

图3.BHB促进棕色脂肪细胞中的线粒体脂滴接触。
(D) FAs由C12检测,线粒体用Mitotracker Green染色,脂滴则用BODIPY染色,成熟棕色脂肪细胞由3T3-L1细胞诱导。

(A)在HADHA对原级肝细胞的过度表达后,收集其培养基,并与从3T3-L1细胞诱导的成熟棕色脂肪细胞共培养48小时。成熟棕色脂肪细胞的线粒体通过Mitotracker红色染色和脂滴通过BODIPY染色可视化。每组中 n = 13。(b)在HADHA敲低原级肝细胞后,收集其培养基,并与3T3-L1细胞诱导的成熟棕色脂肪细胞共培养48小时。成熟棕色脂肪细胞的线粒体通过Mitotracker红染色和脂滴通过BODIPY染色可见。每组中 n = 20。(C–E)在原级肝细胞中HADHA过度表达后,其培养基被收集并与3T3-L1细胞诱导的成熟棕色脂肪细胞共培养,C12检测到棕色脂肪细胞FA,线粒体用Mitotracker Green染色,脂滴用BODIPY染色。FA定位于线粒体或FA定位于LDs的统计数据。
中乔新舟生物的产品3T3-L1小鼠胚胎成纤维细胞(货号:ZQ0089 )参与了该项研究。

4. 题目:II型肺泡上皮细胞通过外泌体lncRNA rmrp释放,促进肺泡巨噬细胞中败血症诱导的免疫抑制
Type II Alveolar Epithelial Cells Promote Sepsis-Induced Immunosuppression in Alveolar Macrophages via Exosomal lncRNA Rmrp Release
DOI:10.1002/advs.202500376
发表时间: 2025-11-03
发表期刊:Advanced Science
影响因子:14.1
作者单位: 华南大学
文章摘要:
继发性肺炎是败血症诱导免疫抑制(SII)的常见并发症,主要由于糖酵解活性受损,导致肺泡巨噬细胞(AM)功能障碍。然而,其底层分子机制仍不明确。本研究发现,线粒体RNA加工内核酸酶(Rmrp)中的外泌体RNA成分,源自II型肺泡上皮细胞(AEC-IIs),在盲肠连接穿刺(CLP)败血症后,驱动AMs的糖解缺陷和免疫耐受。针对性地耗尽AEC-II或AMs中的Rmrp,缓解了由铜绿假单胞菌感染引起的SII和继发性肺炎,发生在CLP后48小时。从机制上看,Rmrp与RNA结合蛋白锌指蛋白36(ZFP36)相互作用并抑制其泛素化和降解。这导致ZFP36上调,进而加速6-磷果糖-2-激酶/果糖-2,6-双磷酸酶3(Pfkfb3)mRNA的衰变,通过结合其富含AU的3'未翻译区域元素。Pfkfb3 mRNA的降解导致糖酵解受损,并在败血症后抑制AMs的免疫反应。此外,研究发现外泌体RMRP水平与AM免疫耐受性及败血症患者的预后相关。这些发现凸显了AEC-II衍生的外泌体Rmrp在SII和继发性肺炎发病机制中的关键作用。重要的是,研究表明外泌体RMRP可能作为临床环境中预测和管理SII的生物标志物。
部分结果展示:

A)流程图,概述了调控AMs糖酵解和免疫反应的AEC-II衍生外泌体中候选lncRNA的筛选过程。B)对来自假或CLP小鼠的AEC-II中lncRNA表达进行逆转录定量PCR(RT-qPCR)分析(n=9/组)。E) 接受MLE-12细胞来源外泌体并随后用LPS刺激的AMs上清液中TNF-α、IL-6、IL-1β及乳酸水平的ELISA(n=3/组)。G)结合MLE-12细胞中Cy3标记外泌体孵育的AMs代表性荧光图像。尺度条:25微米高时,对用RNase A或Triton X-100处理的AEC-II或MLE-12细胞中CM中的Rmrp进行RT-qPCR分析(上方面板),以及AEC-II或MLE-12细胞(下组)CM或外泌体中的Rmrp表达(n=9/组)。I) 对AMs与AEC-II(左)或MLE-12细胞(右)共培养的AMs中Rmrp进行RT-qPCR分析(n=9/组)。J) 用CM或来自AEC-II细胞(左)或MLE-12细胞(右)的外泌体处理AMs的Rmrp RT-qPCR分析(n = 9/组)。L) 在与MLE-12细胞来源外泌体共培养及后续LPS刺激后,AMs上清液中TNF-α、IL-6、IL-1β及乳酸水平的ELISA(n=3/组)。数据以均值±标准差(SD)呈现。
中乔新舟生物的产品MLE-12小鼠肺泡上皮细胞(货号:ZQ0470 )参与了该项研究。

5. 题目:一种靶向的sirtuin-1基因激活四面体DNA通过SIRT1-FOXO3-BNIP3轴恢复成纤维细胞中的线粒吞噬,从而减弱膀胱纤维化
A Sirtuin-1-Targeted Gene-Activating Tetrahedral DNA Attenuates Bladder Fibrosis by Restoring Mitophagy in Fibroblasts via the SIRT1-FOXO3-BNIP3 Axis
DOI:10.1002/advs.202519527
发表时间:2025-11-23
发表期刊:Advanced Science
影响因子: 14.1
作者单位: 四川大学
文章摘要:
膀胱纤维化代表了全球范围内普遍的健康挑战,伴随着沉重的社会经济负担。迄今为止,尚无有效的治疗干预措施能够阻止或逆转其进展。基于小激活RNA(saRNA)的疗法因其高靶点特异性和强效疗效,近年来受到越来越多的关注。然而,saRNA的临床翻译仍受结构不稳定性、核酸酶敏感性和细胞内化效率低下等固有限制所阻碍。本研究整合了单细胞和整体转录组分析,显示SIRT1是唯一在纤维化膀胱组织和活化成纤维细胞中均显著下调的sirtuin家族成员。为此,设计了一种由saRNA功能化、靶向SIRT1激活的四面体DNA,称为TSA。TSA展现出卓越的生物相容性,显著减轻膀胱功能障碍和膀胱排气阻滞模型中的纤维化重塑。机制上,TSA给药能强健地恢复SIRT1表达,促进FOXO3A去乙酰化并减轻其对BNIP3的转录抑制。这一级联反应导致PINK1-PARKIN介导的线粒体吞噬被激活,抑制线粒体活性氧的积累,最终抑制成纤维细胞的激活和胶原蛋白沉积。这些令人信服的发现凸显了TSA作为治疗膀胱纤维化的有前景策略的潜力,并对临床应用具有广泛意义。
部分结果展示:

L)验证TGF-β1处理后培养小鼠膀胱成纤维细胞中SIRT1抑制作用。

N) 免疫荧光验证确认,TGF-β1处理后小鼠膀胱成纤维细胞中的FOXO3A乙酰化增加(尺度条=25微米)。

A)在治疗后3、6和12小时评估小鼠膀胱成纤维细胞中Cy5标记的SaR和TSA复合物的细胞摄取效率。(E) 培养小鼠膀胱成纤维细胞中关键线粒体调节因子(PINK1、BECLIN1、PARKIN、LC3)。(G)FOXO3A乙酰化的代表性免疫染色和热分析(尺度条=25微米)。
中乔新舟生物的产品原代小鼠膀胱成纤维细胞(货号:PRI-MOU-00118 )和原代小鼠膀胱成纤维细胞完全培养基(货号:PCM-M-118)参与了该项研究。



相关文章
更多 >

