五种常见的细胞增殖检测技术原理及实验流程分享
2023-12-05 来源: 点击次数:2601
细胞增殖实验常用方法包括细胞计数法、MTT法、BrdU染色法、CCK-8法、克隆形成法,这些实验通常需借助显微镜和分光光度计完成。以上方法需频繁拿出细胞,那么有什么新方法可以弥补这种不足呢?本文将介绍一种新的方法-使用活细胞成像系统,置于培养箱内实时动态成像,监测细胞的增殖情况。我们分析了新方法对比常用方法的优势,同时列举了几篇活细胞成像系统应用在细胞增殖方向的发表在《Nature communications》、《Science translational medicine》、《Cell Reports》期刊的高分文章,该方法获得了高校老师的认可,且在细胞增殖实验中被推广使用,证实了新方法的可靠性。
细胞增殖是生物体生长、发育、繁殖和遗传的基础,细胞以分裂的方式进行增殖。
细胞增殖能力是细胞活性的直接表现。
细胞增殖检测技术广泛应用于分子生物学、肿瘤生物学、药理和药代动力学等研究领域。 常见的细胞增殖检测方法有以下5种。
1.细胞计数法
细胞增殖表现为细胞数目的增多,通过计数板和细胞计数仪得出细胞数目,绘制生长曲线。
操作方法:一般过程为接种细胞,分组培养7天,逐日检测细胞数量,根据细胞数量绘制成图,即为细胞生长曲线。
不足:操作繁琐,需频繁将细胞拿出培养箱,不适合数量较多或特定亚群的细胞计数。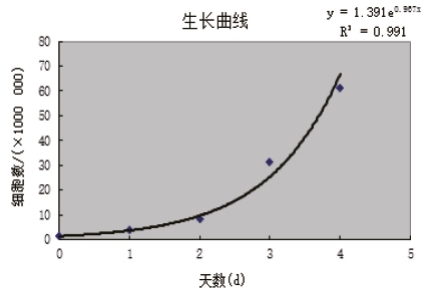
2.MTT法
活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。
简易流程:
2.1、接种细胞:制备细胞悬液,将细胞接种到多孔板中。
2.2、培养细胞:培养3-5天(可根据试验目的和要求决定培养时间)。
2.3、呈色:培养3-5天后,每孔加MTT溶液。继续孵育,加DMSO,使结晶物充分融解。
2.4、比色:在 490nm波长下检测吸光值,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
不足:工作量大,且溶解甲瓒的有机溶剂有毒性,对细胞造成损伤。
3. BrdU染色法
BrdU(5-溴脱氧尿嘧啶核苷)可代替胸腺嘧啶选择性整合到复制细胞中新合成的DNA中(细胞周期S期)。通过检测BrdU的掺入,从而判断细胞的增殖能力。
简易实验流程如下:
3.1、对细胞进行接种,根据不同条件进行药物处理。
3.2、制备适量BrdU培养基,孵育。除去培养液,用PBS洗涤。
3.3、加入多聚甲醛常温固定,PBS冲洗。
3.4、加入含 Triton X-100的PBS,在冰上将细胞膜穿刺,加入预冷的PBS冲洗。
3.5、加1抗即抗小鼠BrdU单抗(工作浓度1:50),阴性对照加PBS或血清。
3.6、按ABC法进行检测,苏木素或伊红衬染,在显微镜或活细胞成像系统下拍照。
不足:破坏细胞结构,准确性较低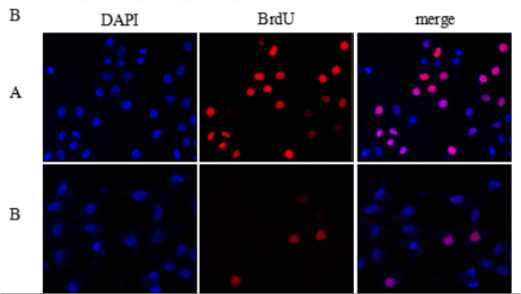
4. CCK-8法
CCK-8试剂中含有WST–8,可以被线粒体内的一些脱氢酶还原生成橙黄色的Formazan。用酶标仪在450nm波长处测定其光吸收值,可间接反映活细胞数量。
4.1、将处理过的细胞胰酶消化后计数,接种1000个细胞至96孔板,每孔100 μL培养基,将培养板置于培养箱中培养0 h、24h、48h和72h。
4.2、每孔加入10 μL CCK-8溶液,用加了相应量细胞培养液和CCK-8溶液但没有加入细胞的孔作为空白对照。
4.3、在细胞培养箱内继续孵育0.5h,用酶标仪在450nm测定吸光度。
不足:CCK-8价格较贵,且试剂颜色为淡红色,与含酚红的培养基颜色接近,操作过程中容易多加或漏加。
5. 克隆形成法
细胞在体外增殖,形成集落,集落的大小和数量反应该细胞独立生存能力和增殖能力,从而反映细胞增殖的情况。
实验流程:
5.1、接种细胞于六孔板中,轻轻混匀后放入培养箱中培养。
5.2、培养过夜后,根据实验目的加入药物或其他处理。
5.3、每隔一定时间更换一次培养基,培养2周后,去除培养基,加入PBS洗一次。
5.4、加入多聚甲醛或者乙醇固定,去除培养基,加入结晶紫染色液,常温染色。
5.5、加入PBS洗3次,将六孔板放入烘箱中烘干,对克隆细胞进行计数和拍照。
不足:培养时间长,操作繁琐,频繁取出观察,影响细胞生长环境。
综上所述,传统的细胞增殖检测方法,操作繁琐,需频繁将细胞拿出培养箱,且个别试剂会对细胞结构造成影响。耗时、耗力、实验成功率不能保证,最终影响实验效率。
那么,有什么新工具可以弥补这些不足,助力细胞增殖实验呢?持续关注奎克泰生物,下篇文章将继续为您科普细胞增殖知识~
细胞增殖是生物体生长、发育、繁殖和遗传的基础,细胞以分裂的方式进行增殖。
细胞增殖能力是细胞活性的直接表现。

1.细胞计数法
细胞增殖表现为细胞数目的增多,通过计数板和细胞计数仪得出细胞数目,绘制生长曲线。
操作方法:一般过程为接种细胞,分组培养7天,逐日检测细胞数量,根据细胞数量绘制成图,即为细胞生长曲线。
不足:操作繁琐,需频繁将细胞拿出培养箱,不适合数量较多或特定亚群的细胞计数。

活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。
简易流程:
2.1、接种细胞:制备细胞悬液,将细胞接种到多孔板中。
2.2、培养细胞:培养3-5天(可根据试验目的和要求决定培养时间)。
2.3、呈色:培养3-5天后,每孔加MTT溶液。继续孵育,加DMSO,使结晶物充分融解。
2.4、比色:在 490nm波长下检测吸光值,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
不足:工作量大,且溶解甲瓒的有机溶剂有毒性,对细胞造成损伤。
3. BrdU染色法
BrdU(5-溴脱氧尿嘧啶核苷)可代替胸腺嘧啶选择性整合到复制细胞中新合成的DNA中(细胞周期S期)。通过检测BrdU的掺入,从而判断细胞的增殖能力。
简易实验流程如下:
3.1、对细胞进行接种,根据不同条件进行药物处理。
3.2、制备适量BrdU培养基,孵育。除去培养液,用PBS洗涤。
3.3、加入多聚甲醛常温固定,PBS冲洗。
3.4、加入含 Triton X-100的PBS,在冰上将细胞膜穿刺,加入预冷的PBS冲洗。
3.5、加1抗即抗小鼠BrdU单抗(工作浓度1:50),阴性对照加PBS或血清。
3.6、按ABC法进行检测,苏木素或伊红衬染,在显微镜或活细胞成像系统下拍照。
不足:破坏细胞结构,准确性较低

4. CCK-8法
CCK-8试剂中含有WST–8,可以被线粒体内的一些脱氢酶还原生成橙黄色的Formazan。用酶标仪在450nm波长处测定其光吸收值,可间接反映活细胞数量。
4.1、将处理过的细胞胰酶消化后计数,接种1000个细胞至96孔板,每孔100 μL培养基,将培养板置于培养箱中培养0 h、24h、48h和72h。
4.2、每孔加入10 μL CCK-8溶液,用加了相应量细胞培养液和CCK-8溶液但没有加入细胞的孔作为空白对照。
4.3、在细胞培养箱内继续孵育0.5h,用酶标仪在450nm测定吸光度。
不足:CCK-8价格较贵,且试剂颜色为淡红色,与含酚红的培养基颜色接近,操作过程中容易多加或漏加。
5. 克隆形成法
细胞在体外增殖,形成集落,集落的大小和数量反应该细胞独立生存能力和增殖能力,从而反映细胞增殖的情况。
实验流程:
5.1、接种细胞于六孔板中,轻轻混匀后放入培养箱中培养。
5.2、培养过夜后,根据实验目的加入药物或其他处理。
5.3、每隔一定时间更换一次培养基,培养2周后,去除培养基,加入PBS洗一次。
5.4、加入多聚甲醛或者乙醇固定,去除培养基,加入结晶紫染色液,常温染色。
5.5、加入PBS洗3次,将六孔板放入烘箱中烘干,对克隆细胞进行计数和拍照。
不足:培养时间长,操作繁琐,频繁取出观察,影响细胞生长环境。
综上所述,传统的细胞增殖检测方法,操作繁琐,需频繁将细胞拿出培养箱,且个别试剂会对细胞结构造成影响。耗时、耗力、实验成功率不能保证,最终影响实验效率。
那么,有什么新工具可以弥补这些不足,助力细胞增殖实验呢?持续关注奎克泰生物,下篇文章将继续为您科普细胞增殖知识~
相关文章
更多 >

