一种快速的分类外周血PBMC细胞亚群的方法
2021-11-09 来源:默克 点击次数:8381
默克生命科学带你走进 PBMC免疫细胞,免疫细胞在免疫调节、抗感染、抗肿瘤等方面,具有重要的应用潜力。 PBMC是基础研究和临床实验室中广泛使用的细胞。
早在2000年国际肿瘤生物治疗及基因治疗年会中便提出,免疫细胞疗法是现代科技中最有希望彻底清除癌细胞的肿瘤治疗方法。而免疫细胞在免疫调节、抗感染、抗肿瘤等方面,具有重要的应用潜力。
外周血单个核细胞(PBMC)
免疫系统的重要组成部分,在机体防御机制中起着不可或缺的作用,也是免疫实验中经常会用到的细胞,从血液中分离得到,常应用于临床诊断、免疫治疗和免疫监测研究中。它是由具有单个圆形细胞核的血细胞组成,如单核细胞和淋巴细胞,淋巴细胞群由T细胞、B细胞和自然杀伤(NK)细胞组成。
分析。
如何分离PBMC?并进行定量分析?
PBMC是基础研究和临床实验室中广泛使用的细胞。这里介绍一种快速、简单、可靠的方法从血液中分离PBMC,并用三种方法测定PBMC总浓度。
Ficoll®密度梯度离心法
PBMC分离的常用方法1–3,也叫做平衡密度梯度离心法:使用超速离心机对小分子物质溶液,长时间离心达到沉降平衡,在离心管内从液面到底部出现一定的密度梯度。
若在该溶液里加入少量大分子溶液,则溶液内比溶剂密度大的部分就产生大分子沉降,比溶剂密度小的部分就会上浮,最后在重力和浮力平衡的位置,集聚形成大分子带状物。不同大小的细胞会分散在不同的层(图1)。
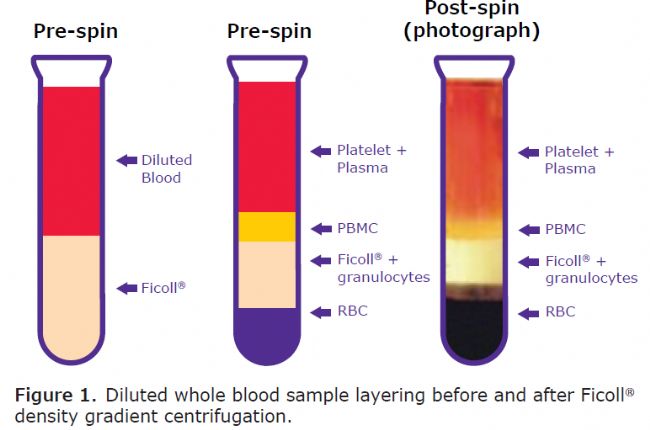
底层包含Ficoll®聚集的红细胞。紧靠这一层的是一个弥漫层,主要包含粒细胞和未结合的Ficoll®。由于密度稍低,淋巴细胞(包括单核PBMC部分)沉积在Ficoll®和最上层血浆/血小板层之间的界面上。将PBMC从界面上取出,使用PBS或细胞培养基洗涤,去除残留的Ficoll。分离好的细胞就可以进入下一步的分析和培养过程。
Scepter™ 细胞计数器定量分析
Scepter™ 细胞计数器基于电阻法的库尔特原理,采用手持式设计,操作简单、结果更为准确。基于库尔特原理可以在亚微米和亚皮克分子筛分辨率级别上区分细胞直径和体积。
通过配备的40μm孔径的传感器Scepter™能够精确的计数范围更广泛的细胞类型,包括直径<6μm的小细胞,如PBMC和红细胞(RBC)4,在PBMC的细胞分群中可以得到非常好的结果。
材料和方法,敲黑板
本方案采用50mL离心管中加入15mL Ficoll®可以较好的处理10 mL脱纤或抗凝剂*处理的外周血(或外周血灰黄层细胞),更小体积的离心管如15mL也可以使用,但更大体积的Ficoll®有助于更高效的去除红细胞,提高PBMC产量。
* 建议使用采集后24h的新鲜分离的血液样本以确保分离细胞保持较高的活性,
* 抗凝剂包括:肝素、EDTA、柠檬酸、柠檬酸葡萄糖(ACD)和柠檬酸磷酸葡萄糖(CPD)。
PBMC的Ficoll®密度梯度分离步骤
1. 将10毫升血液从采集瓶转移到50毫升离心管中。
2. 添加等量的PBS(1X EmbryoMax®PBS,BSS-1006-A)并通过反复吹打混合样品
注:稀释血液可降低红细胞聚集程度,并释放RBC结合的PBMC。如果未稀释,PBMC可能与红细胞共沉淀,降低产量。
3. 向第二个50毫升试管中加入15毫升Ficoll®。
4. 通过缓慢移液并以最小的力小心地将稀释后的血液分层到Ficoll®上。
注:将稀释后的血液轻轻移液到分离介质上,使试管保持一定角度,以添加到Ficoll®中。为了获得良好的分离,在离心前保持血液和Ficoll®层的分离至关重要
5. 在不使用制动器的情况下,在18–24°C温度下以400 g x 30 min的速度离心。
注:较高温度(37°C)会促进红细胞聚集并降低产量,而较低温度(4°C)会抑制聚集,降低纯度。我们建议在18–24°C下进行离心。
6. 小心地从离心机上拆下管子,以免干扰分层。
7. 抽出上部的质膜层,小心不要干扰到下部的PBMC界面。
8. 将PBMC层转移到新的50 mL试管中。回收的体积应约为10–12 mL。
注意:尽量收集整个PMBC层,同时避免相邻的Ficoll(R)介质和质膜层。否则将分别导致粒细胞或血小板和血浆蛋白的污染。
9. 使用~3体积的PBS在18–24°C下以100 g x 10 min的速度离心清洗PBMC部分。
10. 倒出上清液。将细胞重悬在5毫升PBS中。将PBS加注至50 mL,然后重复清洗步骤。
11. 可选:重复清洗步骤一次
12. 清除上清液并将细胞颗粒重新悬浮在适当体积的PBS(或培养基)中。
注:每毫升血液健康血液中可以获得0.5至3 x 106个PBMC细胞。对于10毫升血液,在5毫升PBS中重新悬浮颗粒进行初始计数。在此步骤后添加Rosetteep®人类总淋巴细胞浓缩鸡尾酒(StemCell Technologies目录号15223),可大大提高PBMC群的纯化。
13.使用Scepter™ 细胞计数器和Guava easyCyte™ 流式细胞仪。
14.样品可能需要进一步稀释,以便使用Scepter™进行准确计数,40μm孔径传感器的工作浓度范围=5 x 104–1.5 x 106。
三种方法测定PBMC总浓度
Scepter™ 细胞计数
Scepter™ 细胞计数器使用40μm的传感器,需要吸入75μL细胞悬浮液吸入传感器。Scepter™ 细胞计数器检测通过传感器孔径的每个细胞,计算细胞浓度,并在屏幕上显示基于细胞大小的直方图,并计算出不同淋巴细胞和单核细胞群体的个数,并通过体积大小进行分群。
Guava™ 细胞计数
每10μL PBMC样品在190μL PBS中稀释。然后在Guava easyCyte ™流式细胞仪上 测定淋巴细胞和单核细胞组分的浓度。
细胞表面染色和亚群测定
对于每个样品,将100000个PBMC重新悬浮在100μL PBS+0.1%BSA中。为了区分PBMC中存在的离散细胞亚群,使用以下荧光标记抗体组合对样本进行染色:抗CD3-PE(T细胞)、抗CD19-Alexa-Fluor®488(B细胞)、抗CD16/CD56-APC(NK细胞)和抗CD14-PECy7(单核细胞)(eBioscience)。样品在室温下培养20分钟,用PBS清洗,并在采集前在200μL PBS中再悬浮。在Guava easyCyte™ HT流式细胞仪上分析样品(3000个细胞/样品孔)。
结果
使用Ficoll®进行密度梯度离心,可将全血特征性地分离为4层:最上层的血浆层含有血小板、一层很薄的PBMC带、弥漫性Ficoll®层含有粒细胞和聚集的红细胞颗粒。PBMC可进一步细分为两个主要群体:淋巴细胞和单核细胞。
用荧光抗体标记物对每个样本的小份样本进行染色,以确定PBMC的特征表型。淋巴细胞亚群可进一步细分为T细胞(CD3+)、B细胞(CD19+)和NK细胞(CD16/56+)。根据CD14的差异表达,单核细胞可以与总淋巴细胞区分开来。使用流式细胞仪和权杖对样品进行稀释和分析™ 用于测定PBMC总浓度的细胞计数器。

Figure 2.
Representative data comparing PBMC samples acquired on the flow cytometer and Scepter™ cell counter. Dot plots show debris
从图2中的散点图中,每个样本中发现了几个主要群体:
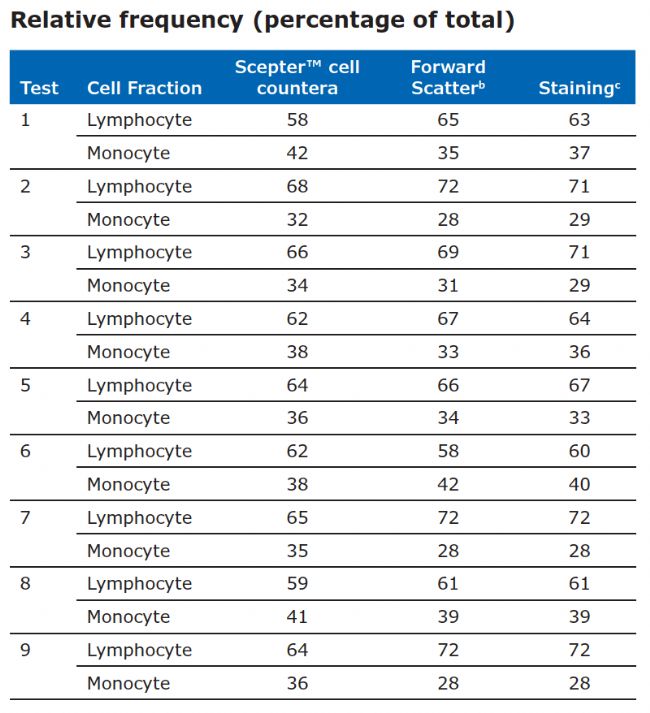
Table 1. Lymphocyte and monocyte subset frequencies from nine individual PBMC samples. Aliquots from each sample were analyzed using the Guava easyCyte™ and Scepter™ instruments.
a Values were derived from the diameter histogram plot.
b Values were derived from the forward scatter histogram plot based on total events measured on guava easyCyte™ platform.
c Staining frequencies derived as follows:
%Lymphocytes = (%CD3+ T cells) + (%CD16/56+ NK cells) + (%CD19+ B cells)
%Monocytes = %CD14+ cells
在9个样本中,淋巴细胞和单核细胞的平均细胞直径分别为7.23±0.30μm和10.02±0.20μm。所得值与先前报道的大小范围一致。5此外,PBMC总浓度通过三种方法测定:
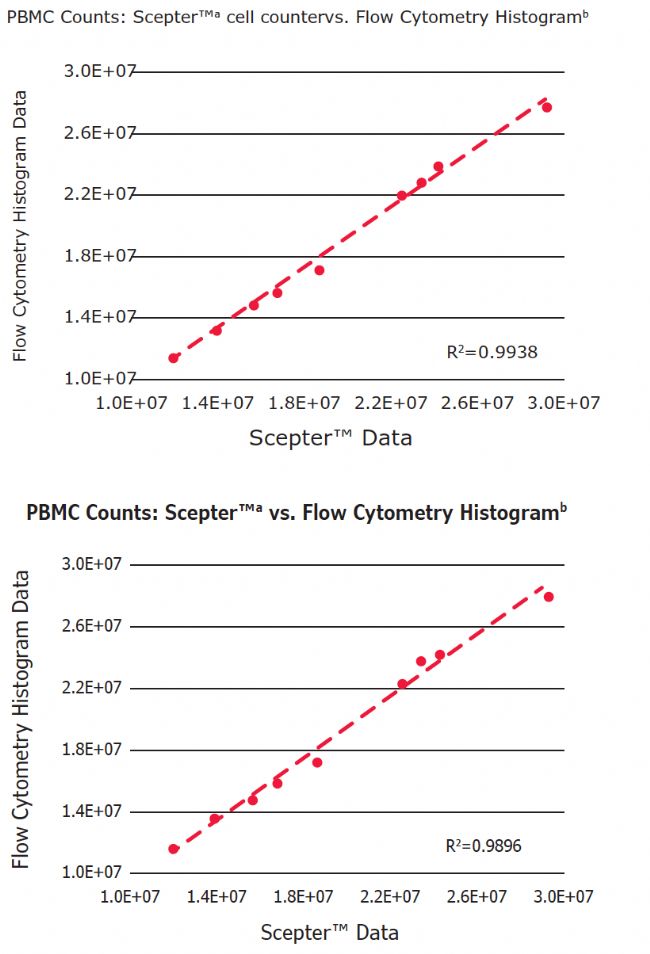
Figure 3. Correlation of PBMC concentrations measured using three different methods of analysis: flow cytometric cell counting, Scepter™ cell counting, and flow cytometry analysis of fluorescently labeled cells.
a Values were derived from the diameter histogram plot
b Values were derived from the forward scatter histogram plot based on total events
c Population counts derived as follows: %Lymphocytes = (%CD3+ T cells) + (%CD16/56+ NK cells) + (%CD19+ B cells); %Monocytes = %CD14+ cells
总结:PBMC是基础研究和临床实验室中广泛使用的细胞。
通过离心法从血液中分离PBMC最关键第一步。在下游分析中Scepter™可以准确的对不同类群的细胞进行有效的分群和计数,其结果和流式直测以及抗体染色的结果有很好的一致性。
参考文献
General
密度梯度离心还可以用在分离叶绿体、病毒纯化、质膜、细胞器等。
如需详细操作内容,点击link(https://www.sigmaaldrich.cn/CN/zh/technical-documents/protocol/cell-culture-and-cell-culture-analysis/primary-cell-culture/ficoll-400)
早在2000年国际肿瘤生物治疗及基因治疗年会中便提出,免疫细胞疗法是现代科技中最有希望彻底清除癌细胞的肿瘤治疗方法。而免疫细胞在免疫调节、抗感染、抗肿瘤等方面,具有重要的应用潜力。
外周血单个核细胞(PBMC)
免疫系统的重要组成部分,在机体防御机制中起着不可或缺的作用,也是免疫实验中经常会用到的细胞,从血液中分离得到,常应用于临床诊断、免疫治疗和免疫监测研究中。它是由具有单个圆形细胞核的血细胞组成,如单核细胞和淋巴细胞,淋巴细胞群由T细胞、B细胞和自然杀伤(NK)细胞组成。
分析。
如何分离PBMC?并进行定量分析?
PBMC是基础研究和临床实验室中广泛使用的细胞。这里介绍一种快速、简单、可靠的方法从血液中分离PBMC,并用三种方法测定PBMC总浓度。
Ficoll®密度梯度离心法
PBMC分离的常用方法1–3,也叫做平衡密度梯度离心法:使用超速离心机对小分子物质溶液,长时间离心达到沉降平衡,在离心管内从液面到底部出现一定的密度梯度。
若在该溶液里加入少量大分子溶液,则溶液内比溶剂密度大的部分就产生大分子沉降,比溶剂密度小的部分就会上浮,最后在重力和浮力平衡的位置,集聚形成大分子带状物。不同大小的细胞会分散在不同的层(图1)。

底层包含Ficoll®聚集的红细胞。紧靠这一层的是一个弥漫层,主要包含粒细胞和未结合的Ficoll®。由于密度稍低,淋巴细胞(包括单核PBMC部分)沉积在Ficoll®和最上层血浆/血小板层之间的界面上。将PBMC从界面上取出,使用PBS或细胞培养基洗涤,去除残留的Ficoll。分离好的细胞就可以进入下一步的分析和培养过程。
Scepter™ 细胞计数器定量分析
Scepter™ 细胞计数器基于电阻法的库尔特原理,采用手持式设计,操作简单、结果更为准确。基于库尔特原理可以在亚微米和亚皮克分子筛分辨率级别上区分细胞直径和体积。
通过配备的40μm孔径的传感器Scepter™能够精确的计数范围更广泛的细胞类型,包括直径<6μm的小细胞,如PBMC和红细胞(RBC)4,在PBMC的细胞分群中可以得到非常好的结果。
材料和方法,敲黑板
本方案采用50mL离心管中加入15mL Ficoll®可以较好的处理10 mL脱纤或抗凝剂*处理的外周血(或外周血灰黄层细胞),更小体积的离心管如15mL也可以使用,但更大体积的Ficoll®有助于更高效的去除红细胞,提高PBMC产量。
* 建议使用采集后24h的新鲜分离的血液样本以确保分离细胞保持较高的活性,
* 抗凝剂包括:肝素、EDTA、柠檬酸、柠檬酸葡萄糖(ACD)和柠檬酸磷酸葡萄糖(CPD)。
PBMC的Ficoll®密度梯度分离步骤
1. 将10毫升血液从采集瓶转移到50毫升离心管中。
2. 添加等量的PBS(1X EmbryoMax®PBS,BSS-1006-A)并通过反复吹打混合样品
注:稀释血液可降低红细胞聚集程度,并释放RBC结合的PBMC。如果未稀释,PBMC可能与红细胞共沉淀,降低产量。
3. 向第二个50毫升试管中加入15毫升Ficoll®。
4. 通过缓慢移液并以最小的力小心地将稀释后的血液分层到Ficoll®上。
注:将稀释后的血液轻轻移液到分离介质上,使试管保持一定角度,以添加到Ficoll®中。为了获得良好的分离,在离心前保持血液和Ficoll®层的分离至关重要
5. 在不使用制动器的情况下,在18–24°C温度下以400 g x 30 min的速度离心。
注:较高温度(37°C)会促进红细胞聚集并降低产量,而较低温度(4°C)会抑制聚集,降低纯度。我们建议在18–24°C下进行离心。
6. 小心地从离心机上拆下管子,以免干扰分层。
7. 抽出上部的质膜层,小心不要干扰到下部的PBMC界面。
8. 将PBMC层转移到新的50 mL试管中。回收的体积应约为10–12 mL。
注意:尽量收集整个PMBC层,同时避免相邻的Ficoll(R)介质和质膜层。否则将分别导致粒细胞或血小板和血浆蛋白的污染。
9. 使用~3体积的PBS在18–24°C下以100 g x 10 min的速度离心清洗PBMC部分。
10. 倒出上清液。将细胞重悬在5毫升PBS中。将PBS加注至50 mL,然后重复清洗步骤。
11. 可选:重复清洗步骤一次
12. 清除上清液并将细胞颗粒重新悬浮在适当体积的PBS(或培养基)中。
注:每毫升血液健康血液中可以获得0.5至3 x 106个PBMC细胞。对于10毫升血液,在5毫升PBS中重新悬浮颗粒进行初始计数。在此步骤后添加Rosetteep®人类总淋巴细胞浓缩鸡尾酒(StemCell Technologies目录号15223),可大大提高PBMC群的纯化。
13.使用Scepter™ 细胞计数器和Guava easyCyte™ 流式细胞仪。
14.样品可能需要进一步稀释,以便使用Scepter™进行准确计数,40μm孔径传感器的工作浓度范围=5 x 104–1.5 x 106。
三种方法测定PBMC总浓度
Scepter™ 细胞计数
Scepter™ 细胞计数器使用40μm的传感器,需要吸入75μL细胞悬浮液吸入传感器。Scepter™ 细胞计数器检测通过传感器孔径的每个细胞,计算细胞浓度,并在屏幕上显示基于细胞大小的直方图,并计算出不同淋巴细胞和单核细胞群体的个数,并通过体积大小进行分群。
Guava™ 细胞计数
每10μL PBMC样品在190μL PBS中稀释。然后在Guava easyCyte ™流式细胞仪上 测定淋巴细胞和单核细胞组分的浓度。
细胞表面染色和亚群测定
对于每个样品,将100000个PBMC重新悬浮在100μL PBS+0.1%BSA中。为了区分PBMC中存在的离散细胞亚群,使用以下荧光标记抗体组合对样本进行染色:抗CD3-PE(T细胞)、抗CD19-Alexa-Fluor®488(B细胞)、抗CD16/CD56-APC(NK细胞)和抗CD14-PECy7(单核细胞)(eBioscience)。样品在室温下培养20分钟,用PBS清洗,并在采集前在200μL PBS中再悬浮。在Guava easyCyte™ HT流式细胞仪上分析样品(3000个细胞/样品孔)。
结果
使用Ficoll®进行密度梯度离心,可将全血特征性地分离为4层:最上层的血浆层含有血小板、一层很薄的PBMC带、弥漫性Ficoll®层含有粒细胞和聚集的红细胞颗粒。PBMC可进一步细分为两个主要群体:淋巴细胞和单核细胞。
用荧光抗体标记物对每个样本的小份样本进行染色,以确定PBMC的特征表型。淋巴细胞亚群可进一步细分为T细胞(CD3+)、B细胞(CD19+)和NK细胞(CD16/56+)。根据CD14的差异表达,单核细胞可以与总淋巴细胞区分开来。使用流式细胞仪和权杖对样品进行稀释和分析™ 用于测定PBMC总浓度的细胞计数器。

Figure 2.
Representative data comparing PBMC samples acquired on the flow cytometer and Scepter™ cell counter. Dot plots show debris
从图2中的散点图中,每个样本中发现了几个主要群体:
- 碎片和红细胞(黑色)
- 淋巴细胞亚群(由T细胞(红色)
- B细胞(Aqua)
- NK细胞(绿色)
- 单核细胞亚群(蓝色)

Table 1. Lymphocyte and monocyte subset frequencies from nine individual PBMC samples. Aliquots from each sample were analyzed using the Guava easyCyte™ and Scepter™ instruments.
a Values were derived from the diameter histogram plot.
b Values were derived from the forward scatter histogram plot based on total events measured on guava easyCyte™ platform.
c Staining frequencies derived as follows:
%Lymphocytes = (%CD3+ T cells) + (%CD16/56+ NK cells) + (%CD19+ B cells)
%Monocytes = %CD14+ cells
在9个样本中,淋巴细胞和单核细胞的平均细胞直径分别为7.23±0.30μm和10.02±0.20μm。所得值与先前报道的大小范围一致。5此外,PBMC总浓度通过三种方法测定:
- Scepter™ 直径图
- 流式细胞仪前向散射
- 抗体染色(图3)

Figure 3. Correlation of PBMC concentrations measured using three different methods of analysis: flow cytometric cell counting, Scepter™ cell counting, and flow cytometry analysis of fluorescently labeled cells.
a Values were derived from the diameter histogram plot
b Values were derived from the forward scatter histogram plot based on total events
c Population counts derived as follows: %Lymphocytes = (%CD3+ T cells) + (%CD16/56+ NK cells) + (%CD19+ B cells); %Monocytes = %CD14+ cells
总结:PBMC是基础研究和临床实验室中广泛使用的细胞。
通过离心法从血液中分离PBMC最关键第一步。在下游分析中Scepter™可以准确的对不同类群的细胞进行有效的分群和计数,其结果和流式直测以及抗体染色的结果有很好的一致性。
参考文献
- Boyum, A. (1968) Isolation of mononuclear cells and granulocytes from human blood. Scand. J. Clin. Lab. Invest. 21:77-89.
- Harris, R. and Ukaijiofo, E. (1970) Tissue typing using a routine one-step lymphocyte separation technique. British J. Haemotol. 18:229- 35.
- Bain, B. and Pshyk, K. (1972) Enhanced reactivity in mixed leukocyte cultures after separation of mononuclear cells on Ficoll-Hypaque. Transplantation Proceedings. 4:161-63.
- Smith, J., and Ongena, K. The New Scepter™ 2.0 Cell Counter. Cellutions 2011 Vol. 1: p 19-22).
- Daniels, V.G., Wheater, P.R., & Burkitt, H.G. (1979). Functional histology: A text and colour atlas. Edinburgh: Churchill Livingstone. ISBN 0-443- 01657-7.
General
- Prager, E., et al. (2001) Induction of Hyporesponsiveness and Impaired T Lymphocyte Activation by the CD31 Receptor: Ligand Pathway in T-Cells. J. Immunol. 166: 2364-2371.
- Smith, J., et al. The New Scepter™ 2.0 Cell Counter Enables the Analysis of a Wider Range of Cell Sizes and Types With High Precision. EMD Millipore Cellutions 2011 Vol. 1: p 19-22.
密度梯度离心还可以用在分离叶绿体、病毒纯化、质膜、细胞器等。
如需详细操作内容,点击link(https://www.sigmaaldrich.cn/CN/zh/technical-documents/protocol/cell-culture-and-cell-culture-analysis/primary-cell-culture/ficoll-400)
相关文章
更多 >

