m5C MeRIP-seq等揭示m5C修饰在癌症耐药中的关键调控机制中的应用
2025-04-24 来源:本站 点击次数:58
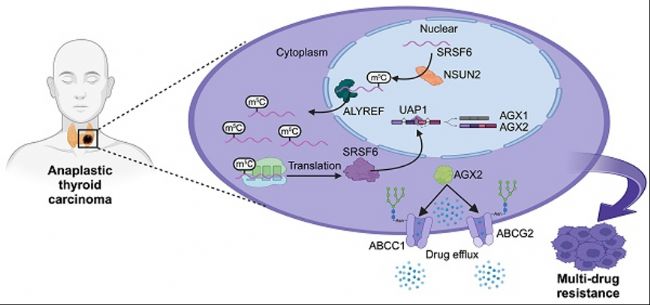
甲状腺未分化癌(Anaplastic Thyroid Cancer, ATC)是一种极具侵袭性的甲状腺癌,通常在初诊时就已出现局部晚期浸润或远处转移,错过了最佳手术时机。因此,系统化疗和靶向治疗对于改善ATC患者的预后至关重要。然而,ATC对传统治疗表现出显著的耐药性,这使得研究其耐药机制并发现新的治疗靶点成为当务之急。近年来,RNA修饰(尤其是m5C修饰)在肿瘤发生和耐药性中的作用逐渐受到关注,但其在ATC中的具体机制尚不清楚。
近日,天津医科大学肿瘤医院郑向前教授团队以甲状腺未分化癌(ATC)为研究对象,利用m5C MeRIP-seq等技术揭示了NSUN2介导的m5C修饰在ATC耐药性中的作用机制,阐明了NSUN2/SRSF6/UAP1信号轴在ATC多药耐药性(Multidrug Resistance, MDR)中的关键作用,并提出通过小分子NSUN2抑制剂克服耐药性的新策略。这一发现不仅为ATC的治疗提供了新的靶点,也为理解RNA修饰在肿瘤耐药性中的作用提供了重要依据。相关研究成果以《NSUN2-mediated m5C modification drives alternative splicing reprogramming and promotes multidrug resistance in anaplastic thyroid cancer through the NSUN2/SRSF6/UAP1 signaling axis》为题发表于《Theranostics》杂志。

标题:NSUN2-mediated m5C modification drives alternative splicing reprogramming and promotes multidrug resistance in anaplastic thyroid cancer through the NSUN2/SRSF6/UAP1 signaling axis(NSUN2介导的m5C修饰通过NSUN2/SRSF6/UAP1信号轴驱动可变剪切重编程并促进甲状腺未分化癌的多药耐药性)
发表时间:2025-1-27
发表期刊:Theranostics
影响因子:IF 12.4/Q1
技术平台:MeRIP-seq、scRNA-seq、bulk RNA-seq(易基因金牌技术)
本研究通过对ATC样本的bulk转录组(bulk RNA-seq)和单细胞RNA测序(scRNA-seq)数据进行全面分析,以筛选与多药耐药性(MDR)相关的m5C修饰基因。随后进行IC50实验、流式细胞术分析,并利用Nsun2基因敲除的自发性甲状腺癌(spontaneous tumorigenic ATC)小鼠模型,证明了NSUN2在ATC中促进MDR的作用。为了探究NSUN2介导的耐药机制,研究构建了NSUN2基因敲除的ATC细胞系,并进行转录组学、蛋白质组学和MeRIP-seq分析。此外还通过RNA-seq测序和可变剪切(alternative splicing,AS)分析,研究NSUN2敲除后的整体变化。进一步通过糖蛋白染色、变性免疫沉淀泛素化、核质分离和PCR等方法,探讨了NSUN2/SRSF6/UAP1轴的潜在机制。最后在体外和体内评估了小分子NSUN2抑制剂与抗癌药物的协同效应。
研究结果表明,NSUN2表达与ATC中的MDR显著相关。NSUN2作为m5C的“writer”,ALYREF作为“reader”,它们共同作用于SRSF6 mRNA,诱导可变剪切重编程,并将UAP1基因的剪接形式从AGX1转向AGX2。结果表明,AGX2增强了ABC转运蛋白的N-糖基化,通过抑制泛素化介导的降解以稳定这些蛋白。NSUN2抑制剂通过降低NSUN2酶活性并减少下游靶标表达,为克服ATC中的MDR提供了一种新的、有前景的治疗策略。
本研究揭示了NSUN2/SRSF6/UAP1信号轴在ATC的MDR中的关键作用,并确定了NSUN2作为化疗和靶向治疗的协同靶点。
研究方法
生物信息学分析:通过分析ATC样本的bulk RNA-seq测序数据,筛选与MDR相关的m5C修饰基因。
细胞实验和分子机制研究:利用CRISPR/Cas9技术构建NSUN2基因敲除(knockout)的ATC细胞系,通过RNA-seq、蛋白质组学和MeRIP-seq分析等技术研究NSUN2的功能。
动物模型:构建Nsun2基因敲除的自发性甲状腺癌小鼠模型,评估NSUN2体内对MDR影响。
药物敏感性分析:通过IC50实验和流式细胞术检测NSUN2抑制剂与抗癌药物的联合效应。
研究结果
(1)生物信息学分析揭示ATC中NSUN2和多药耐药性(MDR)之间的相关性
通过分析Cancer Therapeutics Response Portal(CTRP)数据库中的药物敏感性数据,发现NSUN2的表达与多种抗癌药物(包括化疗药物和酪氨酸激酶抑制剂)的IC50值呈正相关。
利用GEO数据库中的ATC转录组数据,将患者分为高NSUN2表达组和低NSUN2表达组,发现高NSUN2表达与细胞分裂、有丝分裂、细胞周期等化疗靶向过程相关。
scRNA-seq测序分析显示,NSUN2在ATC细胞中的表达与多种化疗药物和TKI的耐药性相关。
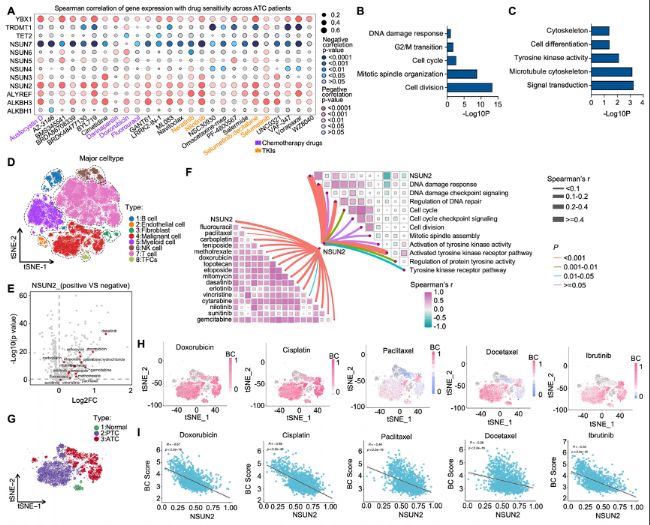
图1:生物信息学分析揭示NSUN2与ATC中多药耐药性(MDR)的相关性。
A)来自CTRP数据库的ATC患者基因表达与药物敏感性的Spearman相关性分析。
B-C)高NSUN2表达组与低NSUN2表达组之间差异表达基因(DEGs)的富集通路总结。
D)ATC的scRNA-seq数据的tSNE图,展示了鉴定出的细胞clusters(n=10)。
E)散点图显示NSUN2阳性细胞与NSUN2阴性细胞的log2倍变化(log2FC)及其与每种药物预测的IC50曲线下面积(AUC)值的相关性。
F)蝴蝶图展示NSUN2表达、药物敏感性与基因本体(GO)通路分析之间的相关性。
G)ATC的scRNA-seq数据的tSNE图,展示了鉴定出的细胞clusters(n=10)。
H)使用Beyondcell对GEO数据集样本进行的单细胞药物敏感性分析。
I)NSUN2表达与Beyondcell评分之间的相关性。
(2)ATC中NSUN2诱导的MDR取决于其甲基转移酶活性
在ATC细胞系中敲低或敲除NSUN2后,细胞对多种药物的敏感性显著增加,表明NSUN2表达与MDR密切相关。
通过构建NSUN2催化活性突变体(C271A),发现只有野生型NSUN2能够恢复m5C修饰活性和药物耐受性,表明NSUN2的甲基转移酶活性是其诱导MDR的关键。

B)通过点杂交实验检测NSUN2基因敲除对Cal-62细胞mRNA转录组中m5C水平的影响。
C)通过比色法m5C定量实验确认NSUN2基因敲除后Cal-62细胞中m5C水平的变化。
D-F)通过细胞生长抑制实验评估NSUN2基因敲除对Cal-62细胞对多柔比星(doxorubicin)、顺铂(cisplatin)和仑伐替尼(lenvatinib)敏感性的影响。
G)通过Western blot分析检测Cal-62细胞经不同处理后NSUN2蛋白的相对表达量。
H)通过点杂交实验检测经载体处理后Cal-62细胞mRNA转录组中m5C丰度。
I)通过比色法m5C定量实验确认经处理后Cal-62细胞中m5C水平变化。
J-L)通过细胞生长抑制实验评估经不同载体转染的Cal-62细胞的IC50值。
M)自发性ATC小鼠模型的构建方案,包括靶向策略(左)和繁殖方案(右)。
N)小鼠基因分型结果,其中TPO-cre的DNA凝胶条带大小为130/324bp,BrafV600E为185/307bp,Trp53flox/flox为290/370bp,Nsun2flox/flox为151/212bp。
O)在基因工程小鼠中多柔比星、顺铂和仑伐替尼的给药方案。mATC(小鼠甲状腺未分化癌)。
P)散点图显示各组小鼠的最终肿瘤重量。
Q)散点图显示各组小鼠的最终肿瘤体积。
R)显示各组ATC小鼠的生存曲线。
(3)在ATC中,NSUN2介导的m5C修饰通过靶向SRSF6驱动可变剪切重编程
蛋白质组学分析显示,NSUN2敲除后,与RNA剪接相关的蛋白表达发生显著变化,其中SRSF6蛋白表达显著下调,而其mRNA水平不变。
MeRIP-seq和qPCR结果表明,NSUN2通过m5C修饰调节SRSF6 mRNA的核质转运,进而影响其蛋白表达。
通过突变SRSF6 mRNA上的m5C修饰位点,发现这些位点对SRSF6的核质转运至关重要。

B)Cal-62细胞中NSUN2基因敲除后TMT-MS数据的GO富集分析。
C)Cal-62细胞中NSUN2基因敲除后差异剪接基因的百分比剪接包含(ΔPSI)的火山图。
D)Cal-62细胞中NSUN2基因敲除后显著ΔPSI变化的小提琴图。
E)Cal-62细胞中NSUN2基因敲除后SF3A/B、U2AF核心复合体和hnRNP家族中DEG热图。
F)Cal-62细胞中NSUN2基因敲除后TMT-MS数据中SRSF6蛋白水平的统计分析。
G)Cal-62细胞中NSUN2基因敲除后指示蛋白的Western blot分析。
H)Cal-62细胞中NSUN2基因敲除后SRSF6基因座周围的MeRIP-seq数据的IGV轨迹图。
I)Cal-62细胞中NSUN2基因敲除后SRSF6 mRNA中m5C富集的MeRIP-qPCR检测。
J)经指示载体处理的Cal-62细胞中SRSF6 mRNA中m5C富集的MeRIP-qPCR分析。
K)NSUN2基因敲除后Cal-62细胞中SRSF6 mRNA的核质分布qRT-PCR分析。
L)经指示载体处理的Cal-62细胞中SRSF6 mRNA的核质分布。
M)经指示载体处理的Cal-62细胞中指示蛋白的Western blot分析。
N)SRSF6中的典型m5C结合位点。顶部为m5C结合位点的motif序列;底部为SRSF6中鉴定的m5C位点。
O)经指示载体处理的Cal-62细胞中SRSF6 mRNA中m5C富集的MeRIP-qPCR定量。
P)经指示载体处理的Cal-62细胞中SRSF6 mRNA的核质分布。
(4)NSUN2通过增强ABC转运蛋白的N-糖基化促进ATC中的MDR
转录组分析和KEGG通路分析显示,NSUN2参与N-糖链生物合成过程。
通过糖蛋白染色和蛋白质印迹分析,发现NSUN2敲除后,ABC转运蛋白(ABCC1和ABCG2)的N-糖基化水平降低,蛋白稳定性下降。
流式细胞术检测显示,NSUN2敲除细胞对药物摄取增加,表明药物外排减少,耐药性降低。

B-C)Cal-62细胞中NSUN2基因敲除后转录数据的基因集富集分析(GSEA)。
D)总蛋白的考马斯亮蓝染色(左),NSUN2基因敲除后Cal-62细胞的糖蛋白染色结果(右)。
E-F)经或未经TM(tunicamycin)、SS(swainsonine)处理的Cal-62细胞中指示蛋白水平的Western blot分析。细胞裂解样本经或未经PNGase F处理。“G”表示N-糖基化,“DG”表示N-糖基化减少。
G)NSUN2基因敲除的Cal-62细胞中指示蛋白水平的Western blot分析。
H)代表性免疫组化(IHC)图像显示35例ATC组织中NSUN2、ABCG2和ABCC1的表达情况。
I-J)采用卡方检验分析NSUN2与ABCG2或ABCC1表达之间的相关性。
K-L)NSUN2与ABCG2或ABCC1的IHC评分的相关性分析。
M-N)使用NetNglyc服务器预测的ABCG2和ABCC1的潜在N-糖基化天冬酰胺位点。
O-P)分别在转染了N557Q、N388Q、N596Q或N71Q、N19Q、N310Q、N(71+310)Q突变质粒的Cal-62细胞中,通过Western blot检测ABCG2和ABCC1的表达情况。
Q-S)NSUN2基因敲除后Cal-62细胞中多柔比星、顺铂和仑伐替尼的细胞内积累情况的流式细胞仪分析。右侧显示平均荧光强度的定量结果。
(5)NSUN2通过N-糖基化增强ABC转运蛋白的稳定性
通过western blot 分析和泛素化实验,发现NSUN2敲除后,ABCC1和ABCG2的泛素化水平增加,表明N-糖基化缺失导致这些蛋白更容易被降解。
使用蛋白酶体抑制剂MG132可以部分恢复ABCC1和ABCG2的蛋白水平,进一步证实了N-糖基化对蛋白稳定性的影响。

B)NSUN2基因敲除的Cal-62细胞经不同浓度的MG132处理后,使用指定抗体进行Western blot分析。
C)经TM和MG132处理的Cal-62细胞中指示蛋白水平的Western blot分析。
D)使用ImageJ软件对ABCC1和ABCG2蛋白水平进行定量分析。
E-F)经TM和MG132处理的Cal-62细胞进行ABCC1或ABCG2免疫沉淀(IP),随后使用抗泛素抗体进行Western blot分析。
G)NSUN2基因敲除且经MG132处理的Cal-62细胞中指示蛋白水平的Western blot分析。
H)使用ImageJ软件对ABCC1和ABCG2蛋白强度进行定量分析。
I-J)NSUN2基因敲除且经MG132处理的Cal-62细胞进行ABCC1或ABCG2免疫沉淀(IP),随后使用抗泛素抗体进行Western blot分析。
K-L)在Cal-62细胞中表达的野生型(WT)或指示的ABCG2/ABCC1突变体经125μg/mL环己酰亚胺(CHX)处理特定时间间隔后,通过Western blot进行分析。
M-N)使用ImageJ软件对ABCG2或ABCC1的蛋白强度定量分析,并以β-Actin水平归一化。
(6)NSUN2通过介导UAP1到SRSF6的可变剪切来促进N-糖基化
UAP1是N-糖基化反应中UDP-GlcNAc合成的关键酶,其有两种亚型(AGX1和AGX2)。
NSUN2敲除后,UAP1的剪接形式从AGX2转变为AGX1,导致N-糖基化活性降低。
通过过表达SRSF6,可以逆转这一剪接变化,恢复N-糖基化水平和药物耐受性。

B)Sashimi图显示NSUN2基因敲除后Cal-62细胞中UAP1剪切事件的变化。
C)对照组与NSUN2基因敲除的Cal-62细胞中UAP1剪切的RT-PCR分析。
D)自发性小鼠ATC肿瘤中UAP1的剪切事件的RT-PCR,有或没有Nsun2基因敲除。
E)经指示载体处理的Cal-62细胞中UAP1剪切事件的RT-PCR(上图)。Western blot分析了SRSF6重建(下图)。
F)检测总蛋白的考马斯亮蓝染色(左)。经指示载体处理的Cal-62细胞糖蛋白染色(右)。
G)经指示载体处理的Cal-62细胞中指示蛋白水平的Western blot分析。
H-J)经指示载体处理的Cal-62细胞中多柔比星、顺铂和仑伐替尼的细胞内积累情况的流式细胞仪分析。右侧显示了平均荧光强度的定量结果。
K-M)指示载体处理Cal-62细胞对多柔比星、顺铂和仑伐替尼敏感影响细胞生长抑制实验。
N-P)指示载体处理Cal-62细胞对多柔比星、顺铂和仑伐替尼反应影响的肿瘤生长曲线。
Q-S)指示载体处理Cal-62细胞对多柔比星、顺铂和仑伐替尼反应影响肿瘤最终重量。
(7)作为m5C的“reader”, ALYREF可以鉴定SRSF6并将其从细胞核转运至细胞质
通过RNA免疫沉淀(RIP)和RNA下拉实验,发现ALYREF能够直接结合m5C修饰的SRSF6 mRNA,并将其从细胞核转运至细胞质。
ALYREF的K171A突变体显著降低对m5C -SRSF6结合能力,表明ALYREF是m5C修饰的“reader”。
ALYREF敲低或过表达可以调控SRSF6的细胞核质转运和蛋白表达,进而影响药物耐受性。
C)热图显示在NSUN2基因敲除或ALYREF、YBX1和SRSF2基因敲低的Cal-62细胞中与多柔比星和顺铂耐药性相关的基因。
D)通过RIP-qPCR检测ALYREF与Cal-62细胞中SRSF6的结合。
E)通过Western blot分析从SRSF6(m5C)下拉实验中获得的指示蛋白。
F)通过RIP-qPCR比较在经指示载体处理的Cal-62细胞中,野生型ALYREF(ALYREF-WT)和K171A突变型ALYREF(ALYREF-K171A)与SRSF6的结合。
G)通过RIP-qPCR评估NSUN2基因敲除后Cal-62细胞中ALYREF与SRSF6 mRNA的结合。
H)通过RIP-qPCR评估经指示载体处理的Cal-62细胞中ALYREF与SRSF6 mRNA的结合。
I)通过qRT-PCR实验评估ALYREF基因敲低的Cal-62细胞中SRSF6 mRNA的核质分布。
J)在过表达ALYREF或ALYREF-K171A突变体的Cal-62细胞中,SRSF6 mRNA的核质分布。
K)经指示载体处理的Cal-62细胞中SRSF6 mRNA的核质分布。
L-N)细胞生长抑制实验评估指示载体处理对Cal-62细胞对多柔比星、顺铂和仑伐替尼反应的影响。
O)通过Western blot分析经指示载体处理的Cal-62细胞中指示蛋白的水平。
P)NSUN2基因敲除的Cal-62细胞中ALYREF的免疫荧光染色(左侧)以及核/质ALYREF分布的定量分析(右侧)。
Q)通过Western blot分析(左侧)以及相应的定量分析(右侧),展示对照组和NSUN2基因敲除的Cal-62细胞中核和质ALYREF的水平,PARP1和TUBULIN分别作为核和质标记。
(8)小分子NSUN2抑制剂增强ATC中多药敏感性
设计并合成小分子NSUN2抑制剂(NSUN2i),能够显著降低ATC细胞中的m5C水平。
NSUN2i处理后,SRSF6的核质转运受阻,UAP1剪接形式改变,N-糖基化水平降低,ABC转运蛋白稳定性下降。
体外实验和动物模型实验均显示,NSUN2i与化疗药物或TKI联合使用可以显著增强药物的抗肿瘤效果。

B)基于RT-qPCR的MeRIP检测NSUN2基因敲除的经或未经NSUN2抑制剂处理的Cal-62细胞中SRSF6 mRNA的m5C富集分析。
C)通过qRT-PCR实验评估NSUN2基因敲除的经或未经NSUN2抑制剂处理的Cal-62细胞中SRSF6 mRNA的核质分布。
D)通过Western blot分析NSUN2基因敲除的经或未经NSUN2抑制剂处理的Cal-62细胞中指示蛋白的水平。
E)RT-PCR显示经或未经NSUN2抑制剂处理的Cal-62细胞和ACT-1细胞中UAP1的剪接事件。
F)检测总蛋白的考马斯亮蓝染色(左),经或未经NSUN2抑制剂处理的Cal-62细胞和ACT-1细胞的糖蛋白染色(右)。
G)通过Western blot分析经或未经NSUN2抑制剂处理的Cal-62细胞和ACT-1细胞中指示蛋白的水平。
H-J)通过流式细胞仪分析经或未经NSUN2抑制剂处理的Cal-62细胞中多柔比星、顺铂和仑伐替尼的细胞内积累情况。右侧显示平均荧光强度的定量结果。
K-M)细胞生长抑制实验评估NSUN2抑制剂与多柔比星、顺铂或仑伐替尼联合使用对Cal-62细胞的影响。
N)展示在基因工程小鼠中NSUN2抑制剂、多柔比星、顺铂和仑伐替尼的给药方案示意图。
O)散点图显示各组小鼠的最终肿瘤重量。
P)散点图显示各组小鼠的最终肿瘤体积。
Q)显示各组ATC小鼠的生存曲线。

讨论和局限性
本研究揭示了NSUN2通过m5C修饰调节SRSF6的细胞核质转运,进而影响UAP1剪切和N-糖基化水平,最终导致ATC耐药性的机制。研究结果表明,NSUN2及其下游靶点是靶向ATC耐药性的潜在治疗靶点。
然而,NSUN2在正常细胞生理中也发挥重要作用,系统性抑制NSUN2可能会带来安全性问题。此外,如何实现NSUN2抑制剂的肿瘤特异性递送仍然是一个挑战。
易小结
本研究通过m5C MeRIP-seq和RNA-seq等分析揭示了NSUN2/SRSF6/UAP1信号轴在ATC耐药性中的作用机制,为开发新的治疗策略提供了理论依据。NSUN2抑制剂与现有抗癌药物的联合使用有望成为克服ATC耐药性的新方法。未来的研究需要进一步评估NSUN2抑制剂的安全性和有效性,并探索其在其他肿瘤类型中的潜在应用。
m5C MeRIP-seq在本研究中的重要作用
本研究的m5C MeRIP-seq(甲基化RNA免疫沉淀测序)主要用于揭示NSUN2在甲状腺未分化癌(ATC)中的作用机制,主要表现在:
(1)鉴定m5C修饰的靶基因:通过MeRIP-seq技术能够系统地分析NSUN2在ATC细胞中对mRNA的m5C修饰情况。研究发现,NSUN2能够特异性地修饰SRSF6 mRNA上的m5C位点。这一发现为后续研究NSUN2如何通过m5C修饰调控基因表达提供了直接证据。
(2)揭示m5C修饰的功能:MeRIP-seq分析显示,NSUN2介导的m5C修饰能够调节SRSF6 mRNA的细胞核质转运。具体来说,m5C修饰增强了SRSF6 mRNA从细胞核向细胞质的转运,从而促进了SRSF6蛋白的表达。这一过程对于ATC细胞的多药耐药性(MDR)至关重要。
(3)探索m5C修饰的调控机制:研究中通过MeRIP-seq结合其他实验手段(如RNA下拉实验和RIP-qPCR),揭示了ALYREF作为m5C修饰的“reader”,能够鉴定并结合m5C修饰的SRSF6 mRNA,并将其从细胞核转运到细胞质。这一发现进一步完善了m5C修饰在基因表达调控中的分子机制。
(4)验证m5C修饰的生物学意义:通过比较NSUN2敲除细胞与野生型细胞的MeRIP-seq数据,研究人员发现NSUN2敲除后SRSF6 mRNA的m5C修饰水平显著下降,同时SRSF6蛋白表达也受到抑制。这表明m5C修饰在维持SRSF6功能和ATC细胞耐药性中发挥着重要作用。
参考文献:
Hou X, Dong Q, Hao J, Liu M, Ning J, Tao M, Wang Z, Guo F, Huang D, Shi X, Gao M, Li D, Zheng X. NSUN2-mediated m5C modification drives alternative splicing reprogramming and promotes multidrug resistance in anaplastic thyroid cancer through the NSUN2/SRSF6/UAP1 signaling axis. Theranostics 2025; 15(7):2757-2777. doi:10.7150/thno.104713.
近日,天津医科大学肿瘤医院郑向前教授团队以甲状腺未分化癌(ATC)为研究对象,利用m5C MeRIP-seq等技术揭示了NSUN2介导的m5C修饰在ATC耐药性中的作用机制,阐明了NSUN2/SRSF6/UAP1信号轴在ATC多药耐药性(Multidrug Resistance, MDR)中的关键作用,并提出通过小分子NSUN2抑制剂克服耐药性的新策略。这一发现不仅为ATC的治疗提供了新的靶点,也为理解RNA修饰在肿瘤耐药性中的作用提供了重要依据。相关研究成果以《NSUN2-mediated m5C modification drives alternative splicing reprogramming and promotes multidrug resistance in anaplastic thyroid cancer through the NSUN2/SRSF6/UAP1 signaling axis》为题发表于《Theranostics》杂志。

标题:NSUN2-mediated m5C modification drives alternative splicing reprogramming and promotes multidrug resistance in anaplastic thyroid cancer through the NSUN2/SRSF6/UAP1 signaling axis(NSUN2介导的m5C修饰通过NSUN2/SRSF6/UAP1信号轴驱动可变剪切重编程并促进甲状腺未分化癌的多药耐药性)
发表时间:2025-1-27
发表期刊:Theranostics
影响因子:IF 12.4/Q1
技术平台:MeRIP-seq、scRNA-seq、bulk RNA-seq(易基因金牌技术)
本研究通过对ATC样本的bulk转录组(bulk RNA-seq)和单细胞RNA测序(scRNA-seq)数据进行全面分析,以筛选与多药耐药性(MDR)相关的m5C修饰基因。随后进行IC50实验、流式细胞术分析,并利用Nsun2基因敲除的自发性甲状腺癌(spontaneous tumorigenic ATC)小鼠模型,证明了NSUN2在ATC中促进MDR的作用。为了探究NSUN2介导的耐药机制,研究构建了NSUN2基因敲除的ATC细胞系,并进行转录组学、蛋白质组学和MeRIP-seq分析。此外还通过RNA-seq测序和可变剪切(alternative splicing,AS)分析,研究NSUN2敲除后的整体变化。进一步通过糖蛋白染色、变性免疫沉淀泛素化、核质分离和PCR等方法,探讨了NSUN2/SRSF6/UAP1轴的潜在机制。最后在体外和体内评估了小分子NSUN2抑制剂与抗癌药物的协同效应。
研究结果表明,NSUN2表达与ATC中的MDR显著相关。NSUN2作为m5C的“writer”,ALYREF作为“reader”,它们共同作用于SRSF6 mRNA,诱导可变剪切重编程,并将UAP1基因的剪接形式从AGX1转向AGX2。结果表明,AGX2增强了ABC转运蛋白的N-糖基化,通过抑制泛素化介导的降解以稳定这些蛋白。NSUN2抑制剂通过降低NSUN2酶活性并减少下游靶标表达,为克服ATC中的MDR提供了一种新的、有前景的治疗策略。
本研究揭示了NSUN2/SRSF6/UAP1信号轴在ATC的MDR中的关键作用,并确定了NSUN2作为化疗和靶向治疗的协同靶点。

研究摘要
研究方法
生物信息学分析:通过分析ATC样本的bulk RNA-seq测序数据,筛选与MDR相关的m5C修饰基因。
细胞实验和分子机制研究:利用CRISPR/Cas9技术构建NSUN2基因敲除(knockout)的ATC细胞系,通过RNA-seq、蛋白质组学和MeRIP-seq分析等技术研究NSUN2的功能。
动物模型:构建Nsun2基因敲除的自发性甲状腺癌小鼠模型,评估NSUN2体内对MDR影响。
药物敏感性分析:通过IC50实验和流式细胞术检测NSUN2抑制剂与抗癌药物的联合效应。
研究结果
(1)生物信息学分析揭示ATC中NSUN2和多药耐药性(MDR)之间的相关性
通过分析Cancer Therapeutics Response Portal(CTRP)数据库中的药物敏感性数据,发现NSUN2的表达与多种抗癌药物(包括化疗药物和酪氨酸激酶抑制剂)的IC50值呈正相关。
利用GEO数据库中的ATC转录组数据,将患者分为高NSUN2表达组和低NSUN2表达组,发现高NSUN2表达与细胞分裂、有丝分裂、细胞周期等化疗靶向过程相关。
scRNA-seq测序分析显示,NSUN2在ATC细胞中的表达与多种化疗药物和TKI的耐药性相关。

图1:生物信息学分析揭示NSUN2与ATC中多药耐药性(MDR)的相关性。
B-C)高NSUN2表达组与低NSUN2表达组之间差异表达基因(DEGs)的富集通路总结。
D)ATC的scRNA-seq数据的tSNE图,展示了鉴定出的细胞clusters(n=10)。
E)散点图显示NSUN2阳性细胞与NSUN2阴性细胞的log2倍变化(log2FC)及其与每种药物预测的IC50曲线下面积(AUC)值的相关性。
F)蝴蝶图展示NSUN2表达、药物敏感性与基因本体(GO)通路分析之间的相关性。
G)ATC的scRNA-seq数据的tSNE图,展示了鉴定出的细胞clusters(n=10)。
H)使用Beyondcell对GEO数据集样本进行的单细胞药物敏感性分析。
I)NSUN2表达与Beyondcell评分之间的相关性。
(2)ATC中NSUN2诱导的MDR取决于其甲基转移酶活性
在ATC细胞系中敲低或敲除NSUN2后,细胞对多种药物的敏感性显著增加,表明NSUN2表达与MDR密切相关。
通过构建NSUN2催化活性突变体(C271A),发现只有野生型NSUN2能够恢复m5C修饰活性和药物耐受性,表明NSUN2的甲基转移酶活性是其诱导MDR的关键。

图2:ATC中由NSUN2诱导的MDR依赖于其甲基转移酶活性。
A)通过Western blot分析检测Cal-62细胞中NSUN2基因敲除后的NSUN2蛋白表达情况。B)通过点杂交实验检测NSUN2基因敲除对Cal-62细胞mRNA转录组中m5C水平的影响。
C)通过比色法m5C定量实验确认NSUN2基因敲除后Cal-62细胞中m5C水平的变化。
D-F)通过细胞生长抑制实验评估NSUN2基因敲除对Cal-62细胞对多柔比星(doxorubicin)、顺铂(cisplatin)和仑伐替尼(lenvatinib)敏感性的影响。
G)通过Western blot分析检测Cal-62细胞经不同处理后NSUN2蛋白的相对表达量。
H)通过点杂交实验检测经载体处理后Cal-62细胞mRNA转录组中m5C丰度。
I)通过比色法m5C定量实验确认经处理后Cal-62细胞中m5C水平变化。
J-L)通过细胞生长抑制实验评估经不同载体转染的Cal-62细胞的IC50值。
M)自发性ATC小鼠模型的构建方案,包括靶向策略(左)和繁殖方案(右)。
N)小鼠基因分型结果,其中TPO-cre的DNA凝胶条带大小为130/324bp,BrafV600E为185/307bp,Trp53flox/flox为290/370bp,Nsun2flox/flox为151/212bp。
O)在基因工程小鼠中多柔比星、顺铂和仑伐替尼的给药方案。mATC(小鼠甲状腺未分化癌)。
P)散点图显示各组小鼠的最终肿瘤重量。
Q)散点图显示各组小鼠的最终肿瘤体积。
R)显示各组ATC小鼠的生存曲线。
(3)在ATC中,NSUN2介导的m5C修饰通过靶向SRSF6驱动可变剪切重编程
蛋白质组学分析显示,NSUN2敲除后,与RNA剪接相关的蛋白表达发生显著变化,其中SRSF6蛋白表达显著下调,而其mRNA水平不变。
MeRIP-seq和qPCR结果表明,NSUN2通过m5C修饰调节SRSF6 mRNA的核质转运,进而影响其蛋白表达。
通过突变SRSF6 mRNA上的m5C修饰位点,发现这些位点对SRSF6的核质转运至关重要。

图3:ATC中,NSUN2介导的m5C修饰通过靶向SRSF6驱动可变剪切重编程。
A)通过TMT-MS检测的Cal-62细胞中NSUN2基因敲除后蛋白水平变化的火山图。B)Cal-62细胞中NSUN2基因敲除后TMT-MS数据的GO富集分析。
C)Cal-62细胞中NSUN2基因敲除后差异剪接基因的百分比剪接包含(ΔPSI)的火山图。
D)Cal-62细胞中NSUN2基因敲除后显著ΔPSI变化的小提琴图。
E)Cal-62细胞中NSUN2基因敲除后SF3A/B、U2AF核心复合体和hnRNP家族中DEG热图。
F)Cal-62细胞中NSUN2基因敲除后TMT-MS数据中SRSF6蛋白水平的统计分析。
G)Cal-62细胞中NSUN2基因敲除后指示蛋白的Western blot分析。
H)Cal-62细胞中NSUN2基因敲除后SRSF6基因座周围的MeRIP-seq数据的IGV轨迹图。
I)Cal-62细胞中NSUN2基因敲除后SRSF6 mRNA中m5C富集的MeRIP-qPCR检测。
J)经指示载体处理的Cal-62细胞中SRSF6 mRNA中m5C富集的MeRIP-qPCR分析。
K)NSUN2基因敲除后Cal-62细胞中SRSF6 mRNA的核质分布qRT-PCR分析。
L)经指示载体处理的Cal-62细胞中SRSF6 mRNA的核质分布。
M)经指示载体处理的Cal-62细胞中指示蛋白的Western blot分析。
N)SRSF6中的典型m5C结合位点。顶部为m5C结合位点的motif序列;底部为SRSF6中鉴定的m5C位点。
O)经指示载体处理的Cal-62细胞中SRSF6 mRNA中m5C富集的MeRIP-qPCR定量。
P)经指示载体处理的Cal-62细胞中SRSF6 mRNA的核质分布。
(4)NSUN2通过增强ABC转运蛋白的N-糖基化促进ATC中的MDR
转录组分析和KEGG通路分析显示,NSUN2参与N-糖链生物合成过程。
通过糖蛋白染色和蛋白质印迹分析,发现NSUN2敲除后,ABC转运蛋白(ABCC1和ABCG2)的N-糖基化水平降低,蛋白稳定性下降。
流式细胞术检测显示,NSUN2敲除细胞对药物摄取增加,表明药物外排减少,耐药性降低。

图4:NSUN2通过增强ABC转运蛋白的N-糖基化促进ATC中的MDR。
A)Cal-62细胞中NSUN2基因敲除后转录数据的GO富集分析。B-C)Cal-62细胞中NSUN2基因敲除后转录数据的基因集富集分析(GSEA)。
D)总蛋白的考马斯亮蓝染色(左),NSUN2基因敲除后Cal-62细胞的糖蛋白染色结果(右)。
E-F)经或未经TM(tunicamycin)、SS(swainsonine)处理的Cal-62细胞中指示蛋白水平的Western blot分析。细胞裂解样本经或未经PNGase F处理。“G”表示N-糖基化,“DG”表示N-糖基化减少。
G)NSUN2基因敲除的Cal-62细胞中指示蛋白水平的Western blot分析。
H)代表性免疫组化(IHC)图像显示35例ATC组织中NSUN2、ABCG2和ABCC1的表达情况。
I-J)采用卡方检验分析NSUN2与ABCG2或ABCC1表达之间的相关性。
K-L)NSUN2与ABCG2或ABCC1的IHC评分的相关性分析。
M-N)使用NetNglyc服务器预测的ABCG2和ABCC1的潜在N-糖基化天冬酰胺位点。
O-P)分别在转染了N557Q、N388Q、N596Q或N71Q、N19Q、N310Q、N(71+310)Q突变质粒的Cal-62细胞中,通过Western blot检测ABCG2和ABCC1的表达情况。
Q-S)NSUN2基因敲除后Cal-62细胞中多柔比星、顺铂和仑伐替尼的细胞内积累情况的流式细胞仪分析。右侧显示平均荧光强度的定量结果。
(5)NSUN2通过N-糖基化增强ABC转运蛋白的稳定性
通过western blot 分析和泛素化实验,发现NSUN2敲除后,ABCC1和ABCG2的泛素化水平增加,表明N-糖基化缺失导致这些蛋白更容易被降解。
使用蛋白酶体抑制剂MG132可以部分恢复ABCC1和ABCG2的蛋白水平,进一步证实了N-糖基化对蛋白稳定性的影响。

图5:NSUN2通过N-糖基化增强ABC转运蛋白的稳定性。
A)Cal-62细胞经TM或不同浓度的MG132处理后,使用指定抗体进行Western blot分析。B)NSUN2基因敲除的Cal-62细胞经不同浓度的MG132处理后,使用指定抗体进行Western blot分析。
C)经TM和MG132处理的Cal-62细胞中指示蛋白水平的Western blot分析。
D)使用ImageJ软件对ABCC1和ABCG2蛋白水平进行定量分析。
E-F)经TM和MG132处理的Cal-62细胞进行ABCC1或ABCG2免疫沉淀(IP),随后使用抗泛素抗体进行Western blot分析。
G)NSUN2基因敲除且经MG132处理的Cal-62细胞中指示蛋白水平的Western blot分析。
H)使用ImageJ软件对ABCC1和ABCG2蛋白强度进行定量分析。
I-J)NSUN2基因敲除且经MG132处理的Cal-62细胞进行ABCC1或ABCG2免疫沉淀(IP),随后使用抗泛素抗体进行Western blot分析。
K-L)在Cal-62细胞中表达的野生型(WT)或指示的ABCG2/ABCC1突变体经125μg/mL环己酰亚胺(CHX)处理特定时间间隔后,通过Western blot进行分析。
M-N)使用ImageJ软件对ABCG2或ABCC1的蛋白强度定量分析,并以β-Actin水平归一化。
(6)NSUN2通过介导UAP1到SRSF6的可变剪切来促进N-糖基化
UAP1是N-糖基化反应中UDP-GlcNAc合成的关键酶,其有两种亚型(AGX1和AGX2)。
NSUN2敲除后,UAP1的剪接形式从AGX2转变为AGX1,导致N-糖基化活性降低。
通过过表达SRSF6,可以逆转这一剪接变化,恢复N-糖基化水平和药物耐受性。

图6:NSUN2通过SRSF6介导UAP1的可变剪切促进N-糖基化。
A)UAP1促进UDP-GlcNAc的生物合成,UDP-GlcNAc是糖基化反应中的关键供体,尤其在N-糖基化和O-GlcNAc修饰中。B)Sashimi图显示NSUN2基因敲除后Cal-62细胞中UAP1剪切事件的变化。
C)对照组与NSUN2基因敲除的Cal-62细胞中UAP1剪切的RT-PCR分析。
D)自发性小鼠ATC肿瘤中UAP1的剪切事件的RT-PCR,有或没有Nsun2基因敲除。
E)经指示载体处理的Cal-62细胞中UAP1剪切事件的RT-PCR(上图)。Western blot分析了SRSF6重建(下图)。
F)检测总蛋白的考马斯亮蓝染色(左)。经指示载体处理的Cal-62细胞糖蛋白染色(右)。
G)经指示载体处理的Cal-62细胞中指示蛋白水平的Western blot分析。
H-J)经指示载体处理的Cal-62细胞中多柔比星、顺铂和仑伐替尼的细胞内积累情况的流式细胞仪分析。右侧显示了平均荧光强度的定量结果。
K-M)指示载体处理Cal-62细胞对多柔比星、顺铂和仑伐替尼敏感影响细胞生长抑制实验。
N-P)指示载体处理Cal-62细胞对多柔比星、顺铂和仑伐替尼反应影响的肿瘤生长曲线。
Q-S)指示载体处理Cal-62细胞对多柔比星、顺铂和仑伐替尼反应影响肿瘤最终重量。
(7)作为m5C的“reader”, ALYREF可以鉴定SRSF6并将其从细胞核转运至细胞质
通过RNA免疫沉淀(RIP)和RNA下拉实验,发现ALYREF能够直接结合m5C修饰的SRSF6 mRNA,并将其从细胞核转运至细胞质。
ALYREF的K171A突变体显著降低对m5C -SRSF6结合能力,表明ALYREF是m5C修饰的“reader”。
ALYREF敲低或过表达可以调控SRSF6的细胞核质转运和蛋白表达,进而影响药物耐受性。

图7:ALYREF作为m5C “reader”,能够鉴定并介导SRSF6从细胞核到细胞质的转运。
A-B)GSEA分析表明ALYREF的表达与化疗耐药性相关。C)热图显示在NSUN2基因敲除或ALYREF、YBX1和SRSF2基因敲低的Cal-62细胞中与多柔比星和顺铂耐药性相关的基因。
D)通过RIP-qPCR检测ALYREF与Cal-62细胞中SRSF6的结合。
E)通过Western blot分析从SRSF6(m5C)下拉实验中获得的指示蛋白。
F)通过RIP-qPCR比较在经指示载体处理的Cal-62细胞中,野生型ALYREF(ALYREF-WT)和K171A突变型ALYREF(ALYREF-K171A)与SRSF6的结合。
G)通过RIP-qPCR评估NSUN2基因敲除后Cal-62细胞中ALYREF与SRSF6 mRNA的结合。
H)通过RIP-qPCR评估经指示载体处理的Cal-62细胞中ALYREF与SRSF6 mRNA的结合。
I)通过qRT-PCR实验评估ALYREF基因敲低的Cal-62细胞中SRSF6 mRNA的核质分布。
J)在过表达ALYREF或ALYREF-K171A突变体的Cal-62细胞中,SRSF6 mRNA的核质分布。
K)经指示载体处理的Cal-62细胞中SRSF6 mRNA的核质分布。
L-N)细胞生长抑制实验评估指示载体处理对Cal-62细胞对多柔比星、顺铂和仑伐替尼反应的影响。
O)通过Western blot分析经指示载体处理的Cal-62细胞中指示蛋白的水平。
P)NSUN2基因敲除的Cal-62细胞中ALYREF的免疫荧光染色(左侧)以及核/质ALYREF分布的定量分析(右侧)。
Q)通过Western blot分析(左侧)以及相应的定量分析(右侧),展示对照组和NSUN2基因敲除的Cal-62细胞中核和质ALYREF的水平,PARP1和TUBULIN分别作为核和质标记。
(8)小分子NSUN2抑制剂增强ATC中多药敏感性
设计并合成小分子NSUN2抑制剂(NSUN2i),能够显著降低ATC细胞中的m5C水平。
NSUN2i处理后,SRSF6的核质转运受阻,UAP1剪接形式改变,N-糖基化水平降低,ABC转运蛋白稳定性下降。
体外实验和动物模型实验均显示,NSUN2i与化疗药物或TKI联合使用可以显著增强药物的抗肿瘤效果。

图8:小分子NSUN2抑制剂增强ATC对多药的敏感性。
A)通过点杂交实验评估NSUN2基因敲除的经或未经NSUN2抑制剂处理的Cal-62细胞中mRNA的m5C水平。B)基于RT-qPCR的MeRIP检测NSUN2基因敲除的经或未经NSUN2抑制剂处理的Cal-62细胞中SRSF6 mRNA的m5C富集分析。
C)通过qRT-PCR实验评估NSUN2基因敲除的经或未经NSUN2抑制剂处理的Cal-62细胞中SRSF6 mRNA的核质分布。
D)通过Western blot分析NSUN2基因敲除的经或未经NSUN2抑制剂处理的Cal-62细胞中指示蛋白的水平。
E)RT-PCR显示经或未经NSUN2抑制剂处理的Cal-62细胞和ACT-1细胞中UAP1的剪接事件。
F)检测总蛋白的考马斯亮蓝染色(左),经或未经NSUN2抑制剂处理的Cal-62细胞和ACT-1细胞的糖蛋白染色(右)。
G)通过Western blot分析经或未经NSUN2抑制剂处理的Cal-62细胞和ACT-1细胞中指示蛋白的水平。
H-J)通过流式细胞仪分析经或未经NSUN2抑制剂处理的Cal-62细胞中多柔比星、顺铂和仑伐替尼的细胞内积累情况。右侧显示平均荧光强度的定量结果。
K-M)细胞生长抑制实验评估NSUN2抑制剂与多柔比星、顺铂或仑伐替尼联合使用对Cal-62细胞的影响。
N)展示在基因工程小鼠中NSUN2抑制剂、多柔比星、顺铂和仑伐替尼的给药方案示意图。
O)散点图显示各组小鼠的最终肿瘤重量。
P)散点图显示各组小鼠的最终肿瘤体积。
Q)显示各组ATC小鼠的生存曲线。

图9:NSUN2在ATC多药耐药中的功能和机制示意图模型。
讨论和局限性
本研究揭示了NSUN2通过m5C修饰调节SRSF6的细胞核质转运,进而影响UAP1剪切和N-糖基化水平,最终导致ATC耐药性的机制。研究结果表明,NSUN2及其下游靶点是靶向ATC耐药性的潜在治疗靶点。
然而,NSUN2在正常细胞生理中也发挥重要作用,系统性抑制NSUN2可能会带来安全性问题。此外,如何实现NSUN2抑制剂的肿瘤特异性递送仍然是一个挑战。
易小结
本研究通过m5C MeRIP-seq和RNA-seq等分析揭示了NSUN2/SRSF6/UAP1信号轴在ATC耐药性中的作用机制,为开发新的治疗策略提供了理论依据。NSUN2抑制剂与现有抗癌药物的联合使用有望成为克服ATC耐药性的新方法。未来的研究需要进一步评估NSUN2抑制剂的安全性和有效性,并探索其在其他肿瘤类型中的潜在应用。
m5C MeRIP-seq在本研究中的重要作用
本研究的m5C MeRIP-seq(甲基化RNA免疫沉淀测序)主要用于揭示NSUN2在甲状腺未分化癌(ATC)中的作用机制,主要表现在:
(1)鉴定m5C修饰的靶基因:通过MeRIP-seq技术能够系统地分析NSUN2在ATC细胞中对mRNA的m5C修饰情况。研究发现,NSUN2能够特异性地修饰SRSF6 mRNA上的m5C位点。这一发现为后续研究NSUN2如何通过m5C修饰调控基因表达提供了直接证据。
(2)揭示m5C修饰的功能:MeRIP-seq分析显示,NSUN2介导的m5C修饰能够调节SRSF6 mRNA的细胞核质转运。具体来说,m5C修饰增强了SRSF6 mRNA从细胞核向细胞质的转运,从而促进了SRSF6蛋白的表达。这一过程对于ATC细胞的多药耐药性(MDR)至关重要。
(3)探索m5C修饰的调控机制:研究中通过MeRIP-seq结合其他实验手段(如RNA下拉实验和RIP-qPCR),揭示了ALYREF作为m5C修饰的“reader”,能够鉴定并结合m5C修饰的SRSF6 mRNA,并将其从细胞核转运到细胞质。这一发现进一步完善了m5C修饰在基因表达调控中的分子机制。
(4)验证m5C修饰的生物学意义:通过比较NSUN2敲除细胞与野生型细胞的MeRIP-seq数据,研究人员发现NSUN2敲除后SRSF6 mRNA的m5C修饰水平显著下降,同时SRSF6蛋白表达也受到抑制。这表明m5C修饰在维持SRSF6功能和ATC细胞耐药性中发挥着重要作用。
参考文献:
Hou X, Dong Q, Hao J, Liu M, Ning J, Tao M, Wang Z, Guo F, Huang D, Shi X, Gao M, Li D, Zheng X. NSUN2-mediated m5C modification drives alternative splicing reprogramming and promotes multidrug resistance in anaplastic thyroid cancer through the NSUN2/SRSF6/UAP1 signaling axis. Theranostics 2025; 15(7):2757-2777. doi:10.7150/thno.104713.
相关文章
更多 >

