IL-33 经 OX40L 促进人肥大细胞诱导 CD4+ T 细胞产生 IL-9
2025-05-12 来源:本站 点击次数:56IL-33-primed human mast cells drive IL-9 production by CD4+ effector T cells in an OX40L-dependent manner
Keywords: IL-33; IL-9; OX40L; Th cell; mast cell.
2 型免疫反应是针对皮肤和粘膜中的主要组织损伤而建立的。在上皮中感应到有害刺激,并诱导释放警报素,如胸腺基质淋巴细胞生成素(TSLP)、白细胞介素-25(IL-25)和 IL-33,这些警报素会启动组织驻留的前哨细胞,并诱导树突状细胞成熟,随后在引流淋巴结中产生辅助型T细胞2(Th2)反应。一旦浸润到受伤组织中,Th2 细胞就会接收到免疫环境提供的确认信号,这些信号不仅加强而且塑造了它们的极化,并导致受损组织内 2 型细胞因子(IL-4、IL-5、IL-9 和 IL-13)的微妙组合。
据报道,在抗原呈递过程中,IL-33活化的树突状细胞(DCs)会促进 Th 细胞中 IL-5、IL-13 和 IL-9 的产生。此外,2 组先天淋巴细胞(ILC2)通过与 Th2 细胞的直接相互作用来促进局部 Th2 反应。除了 ILC2 和树突状细胞外,已知肥大细胞(MCs)也会促进 Th2 反应,但其潜在机制仍知之甚少。
MCs 是先天免疫细胞,在皮肤和粘膜中特别丰富,与 ILC2 一样,由警报素,尤其是 IL-33 启动 。MCs 高度表达 ST2(IL-33受体),并受到 IL-33 的强烈刺激,促进细胞成熟、细胞因子和趋化因子的产生。已知 MCs 会影响适应性免疫反应,并根据免疫情况表现为对 T 细胞反应的激活或抑制作用。
基于此,法国图卢兹的癌症治疗中心及图卢兹第三大学的研究人员在一项研究中探索了 IL-33 对人类 MC 与 Th 细胞的相互作用并对其极化能力的影响。研究发现 IL-33 介导的 MCs 促进了 Th2 细胞反应,并允许产生 IL-9 的 Th 细胞以 OX40L 依赖性方式出现。研究成果发表于 Frontiers in Immunology 期刊题为“IL-33-primed human mast cells drive IL-9 production by CD4+ effector T cells in an OX40L-dependent manner”。
首先,为了分析 IL-33 激活 MCs 的影响及其对 Th 细胞反应的后续影响,研究人员设计了一个共培养系统,以外周血 CD4+ 记忆 T 细胞与 MCs 共培养(图1 A),发现无论是否启动 IL-33,都增加了 CD4+ T 细胞表面的增殖(图1 B)和早期(CD69 和 CD25)或晚期(CD137)激活标志物的表达,表明 MCs 独立于 IL-33向 CD4+ T 细胞提供激活信号。
然后,分析了共培养 6 天后 CD4+ T 细胞产生的典型 Th 细胞细胞因子(IFN-γ、IL-17、IL-4、IL-13 和 IL-9)。结果观察到,未激活的 MCs 增加了产生这些细胞因子的 CD4+ T 细胞的百分比,表明 MCs 的存在促进了 T 细胞细胞因子的产生(图1 C)。用 IL-33(MCIL-33)激活的 MCs 显著增加了 IL-9+(在较小程度上还有 IL-13+)CD4+ T 细胞的百分比,降低了 IL-17+ T 细胞的百分比,而不影响 IFN-γ+ 或 IL-4+ T 细胞的比例(图1 C)。此外,在 MCIL-33 存在下,IL-9+ 细胞的数量增加(图1 D)。这些结果表明,IL-33 增强了 MCs 驱动 Th 细胞产生 IL-13 和 IL-9 的能力。
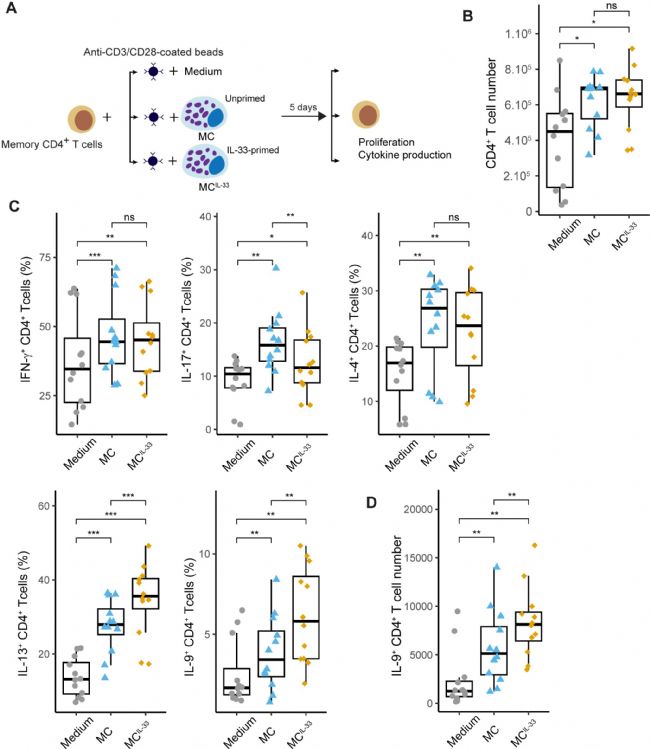 图1 IL-33 激活的 MC 驱动活化的 CD4+ Th 细胞产生 IL-9 。
图1 IL-33 激活的 MC 驱动活化的 CD4+ Th 细胞产生 IL-9 。
由于 IL-33 赋予 MCs 促进 Th 细胞产生 IL-9 的能力,因此接下来试图阐明这种现象的潜在机制。研究人员探讨了 IL-33 刺激后 MCs 中上调的基因是否可能在 MCs 和活化的记忆 CD4+ T 细胞之间的相互作用中发挥作用。基于RNAseq 数据和公开数据集检索,发现 IL-33 在 MCs 中上调了参与 T 细胞共刺激的几种分子的表达,如 CD80、CD58、ICAM1 和 TNF 超家族(TNFSF)分子 CD70(TNFSF7)、OX40L(TNFSF4)和 CD137L(TNFSF9)(图2 A、B)。在这些分子中,实验专注于 OX40L,因为它被证明与 Th2 驱动有关。
流式细胞术证实,IL-33 诱导 MC 表面的 OX40L 表达(图2 C、D)。由于其他 2 型反应警报素可能启动 MCs,并且据报道,在人 CD11c+ DCs 中,OX40L 表达响应 TSLP 而不是 IL-33,因此,分析了 TSLP 和 IL-25 启动 MC 的影响,发现这些警报素不会诱导 MC 表面的 OX40L 表达。为了测试 OX40/OX40L 共刺激对 Th 细胞极化的影响,使用抗-OX40L 阻断单克隆抗体 oxelumab。添加 oxelumab 显著损害了 MC 增加 IL-9 + Th 细胞百分比的能力(图2 E、F)。还注意到在 oxelumab 的存在下降低了 IL-13 + Th 细胞比例的趋势。这些结果表明,在共培养系统中,需要 OX40 刺激来促进 Th 细胞产生 IL-9(在较小程度上是 IL-13)。
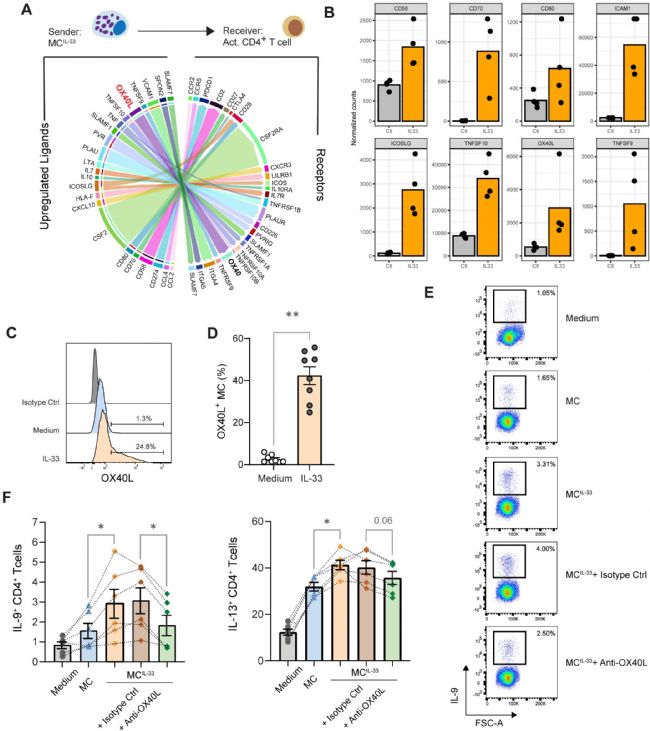 图2 MCs 中 IL-33 诱导的 OX40L 促进 Th 细胞中 IL-9 的产生。
图2 MCs 中 IL-33 诱导的 OX40L 促进 Th 细胞中 IL-9 的产生。
以往研究表明,干扰素-γ(IFN-γ)在 MCs(MHC-II类分子和共刺激分子)中诱导抗原呈递细胞(APC)表型,因此实验测试了 IL-33 是否也作用于 MCs 在同源相互作用时极化 Th 细胞的能力。用 IFN-γ 刺激 MCs 48 小时来诱导 MCs 的 APC 表型,并分析 IL-33 启动对其表型(CD54、HLA II 类分子和 OX40L 表达)的影响。结果表明,IL-33 与 IFN-γ 协同诱导 MHC II 类分子和 CD54,但 IFN-γ 不影响 MC 表面的 OX40L 表达。
IFN-γ刺激的 MCs 用细菌超抗原混合物脉冲,以激活大部分多克隆记忆 CD4+ T 细胞群,并与 CD4+ 记忆 T 细胞共培养 6 天(图3 A)。实验观察到,SAg-脉冲 MC 有效地刺激了多克隆 T 细胞增殖,并且 IL-33 启动不会改变 MCs 刺激 CD4+ T 细胞增殖的能力(图3 B),表明 IL-33 不会改变 MCs 激活效应性T细胞(Teff)细胞的潜力。
为了检测共培养时是否确实发生了 MCIL-33-Th 细胞同源相互作用以及 OX40L 是否参与免疫突触(IS),在共培养后 2 小时通过共聚焦激光扫描显微镜分析了 IS 的形成。共培养 2 小时后,发现大约 10% 的 IFN-γ刺激的 MCIL-33 与记忆 CD4+ T 细胞偶联,表明 MCIL-33-CD4+ T 细胞同源相互作用确实发生。分析偶联物在细胞间接触区域的 OX40L 和 OX40 富集情况,观察到大约一半的偶联物在 IS 处显示 OX40L 富集,这表明 Th 细胞 OX40 在与 MCs 的同源相互作用时参与共刺激(图3 C-E)。
最后,分析了 Th 细胞在共培养第 6 天产生的细胞因子(图3 F)。IL-33 介导的 MCs能够增加 IL-9+ 和 IL-13+ Th 细胞的比例以及降低 IL-17+ Th 细胞的百分比(图3 F)。阻断抗-OX40L mAb 的添加表明 IL-9 + Th 细胞分化需要 OX40-OX40L 相互作用(图3 G、H)。这些结果表明,用 IFN-γ 预处理的 MCIL-33 能够以同源方式刺激记忆 CD4+ T 细胞,并通过 OX40L 表达促进 IL-9+ Th 细胞。
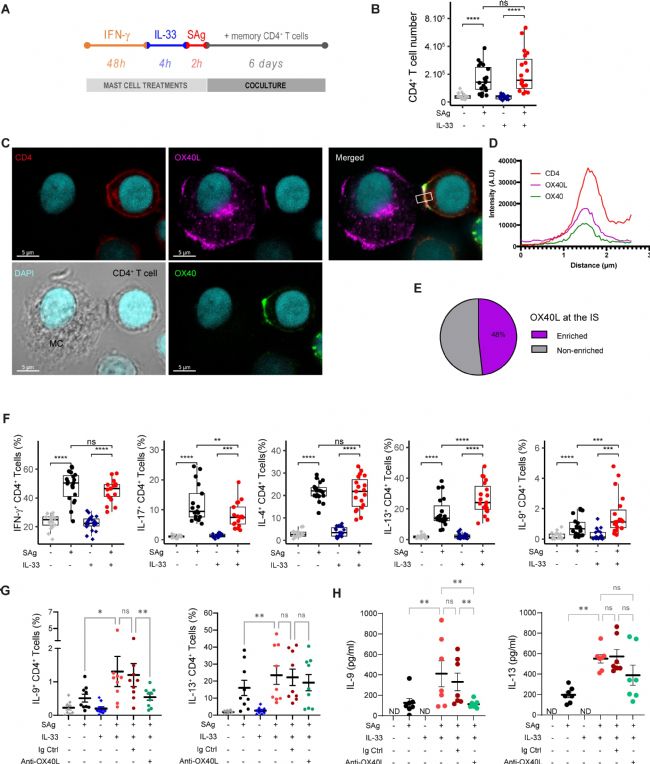 图3 用 IL-33 诱导的抗原呈递 MCs 以 OX40L 依赖性方式促进 CD4+ T 细胞中 IL-9 的产生。
图3 用 IL-33 诱导的抗原呈递 MCs 以 OX40L 依赖性方式促进 CD4+ T 细胞中 IL-9 的产生。
这项研究表明,IL-33 赋予 MCs 以 OX40L 依赖性方式驱动记忆 CD4+ T 细胞产生 IL-9 和 IL-13 的能力。该研究结果将 MCs 整合到 IL-33 引发的免疫反应中。除了增强 MC 功能和促炎能力外,IL-33 还为 MCs 提供了共刺激分子,其中 OX40L 促进 Th2 细胞产生 IL-13 和 IL-9。同样,IL-33 介导的 MCs 可以提供浸润的 Th 细胞产生细胞因子所需的线索,并通过 OX40-OX40L 相互作用提供塑造产生细胞因子组的信号,这里是 IL-9 和 IL-13。
参考文献:Battut L, Leveque E, Valitutti S, Cenac N, Dietrich G, Espinosa E. IL-33-primed human mast cells drive IL-9 production by CD4+ effector T cells in an OX40L-dependent manner. Front Immunol. 2024 Oct 2;15:1470546. doi: 10.3389/fimmu.2024.1470546. PMID: 39416773; PMCID: PMC11479898.
原文链接:https://pubmed.ncbi.nlm.nih.gov/39416773/
Impact Factor 5.7
Electronic ISSN 1664-3224
图片来源: 所有图片均来源于参考文献
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!进入官网www.naturethink.com或关注“Naturethink”公众号,了解更多相关内容。
点击了解:细胞共培养

