抗体偶联药物(ADC)药物有效载荷的作用机制及在癌症治疗中的应用前景
2025-05-16 来源:本站 点击次数:112
在癌症治疗的"军备竞赛"中,抗体偶联药物(ADC)正以前所未有的精准性和杀伤力改写战场规则。目前已有十几种ADC药物获批上市,数百项临床试验正如火如荼,探索新靶点和适应症。这场革命的背后,是四大核心技术突破:靶点验证、抗体优化、偶联升级、载荷创新。其中,有效载荷的多样性更是ADC未来进化的关键引擎。
一、载荷进化论:从"单一弹头"到"超级武器库"
传统ADC的载荷如同"单一弹头":微管抑制剂(如MMAE)和DNA烷化剂(如卡奇霉素)占据主导地位。但近年来,拓扑异构酶1抑制剂的崛起打破了这一格局。Enhertu®(DS-8201a)和Trodelvy®(IMMU-132)的成功,证明非传统载荷的潜力。这些创新得益于连接子技术的突破,允许更高的药物-抗体比(DAR)、更稳定的载荷附着,以及更强的"旁观者效应"。
l 鹅膏覃碱(Amanitin)家族是天然的RNA聚合酶II抑制剂,能阻断转录过程。尽管毒性剧烈,但作为ADC载荷展现出独特优势:
四、Bcl-xL抑制剂:凋亡天平的"砝码调控者"
Bcl-xL蛋白是癌细胞的"存活开关",抑制剂通过打破促凋亡/抗凋亡平衡触发细胞死亡:
ABBV-155:B7-H3抗体与Bcl-xL抑制剂偶联,在肺癌和乳腺癌中展现安全性与疗效。
五、免疫刺激载荷:唤醒免疫系统的"警报器"
免疫检查点抑制剂的成功启发了新方向:将STING/TLR激动剂与抗体结合,在肿瘤微环境精准释放,激活先天免疫:
NJH395/BDC1001:代表新一代免疫刺激ADC,有望突破全身毒性限制。
六、未来战场:载荷创新的"无限可能"
ADC的载荷库正在向更广阔领域延伸:
杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
一、载荷进化论:从"单一弹头"到"超级武器库"
传统ADC的载荷如同"单一弹头":微管抑制剂(如MMAE)和DNA烷化剂(如卡奇霉素)占据主导地位。但近年来,拓扑异构酶1抑制剂的崛起打破了这一格局。Enhertu®(DS-8201a)和Trodelvy®(IMMU-132)的成功,证明非传统载荷的潜力。这些创新得益于连接子技术的突破,允许更高的药物-抗体比(DAR)、更稳定的载荷附着,以及更强的"旁观者效应"。
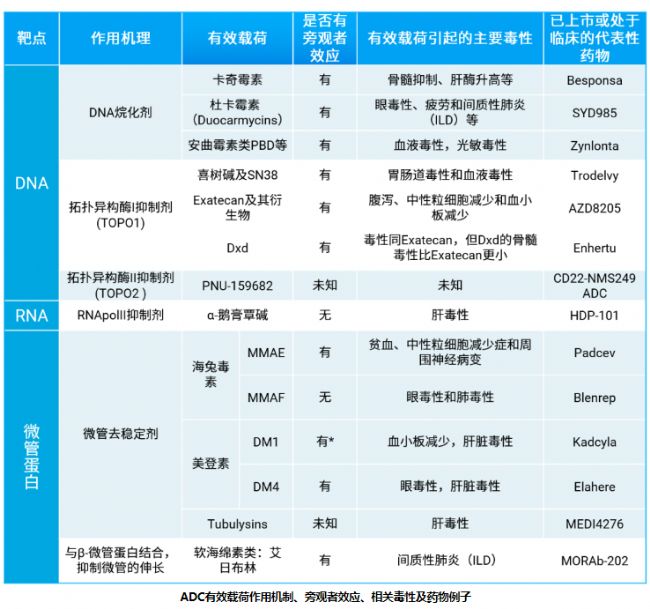
ADC有效载荷作用机制、旁观者效应、相关毒性及药物例子
二、拓扑异构酶抑制剂:DNA修复工地的"破坏者"
拓扑异构酶是控制DNA超螺旋结构的"维修工",抑制剂则通过阻断其修复机制引发DNA断裂,最终诱导癌细胞凋亡。尽管拓扑异构酶抑制剂的效力比微管抑制剂低百倍,但ADC结构改良解决了这一问题:
喜树碱(CPT)家族
- Enhertu®:搭载DXd(exatecan衍生物),DAR高达8,骨髓毒性显著降低。
- PRO1184/PRO1160:采用亲水连接子,突破疏水性限制,增强旁观者效应。
- AZD8205:特有exatecan衍生物AZ'0132,靶向B7-H4,展现广谱潜力。
- 伊立替康(Irinotecan)家族
- Trodelvy®:SN-38与TROP2抗体偶联,获批治疗三阴性乳腺癌。
- IMMU-130/140:分别靶向CEACAM5和HLA-DR,拓展适应症边界。
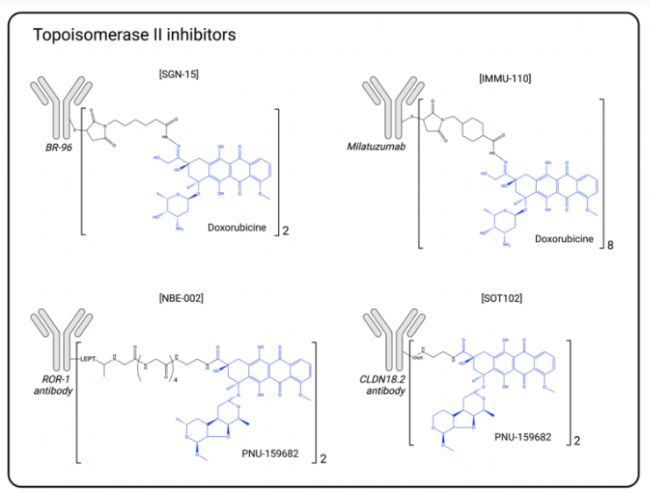
拓扑异构酶2抑制剂示意图
l 鹅膏覃碱(Amanitin)家族是天然的RNA聚合酶II抑制剂,能阻断转录过程。尽管毒性剧烈,但作为ADC载荷展现出独特优势:
- HDP-101:靶向BCMA的ADC,诱导免疫原性细胞死亡,与免疫检查点抑制剂协同增效。
- 其他探索:雷公藤甲素、HDAC抑制剂等转录调控分子,正在突破溶解度与毒性瓶颈。
四、Bcl-xL抑制剂:凋亡天平的"砝码调控者"
Bcl-xL蛋白是癌细胞的"存活开关",抑制剂通过打破促凋亡/抗凋亡平衡触发细胞死亡:
ABBV-155:B7-H3抗体与Bcl-xL抑制剂偶联,在肺癌和乳腺癌中展现安全性与疗效。
五、免疫刺激载荷:唤醒免疫系统的"警报器"
免疫检查点抑制剂的成功启发了新方向:将STING/TLR激动剂与抗体结合,在肿瘤微环境精准释放,激活先天免疫:
NJH395/BDC1001:代表新一代免疫刺激ADC,有望突破全身毒性限制。
六、未来战场:载荷创新的"无限可能"
ADC的载荷库正在向更广阔领域延伸:
- 拓扑异构酶2抑制剂:如PNU-159682,突破外排转运限制。
- 激酶抑制剂:木黄酮偶联物展现多靶点潜力。
- 双弹头设计:核素+细胞毒素、PROTAC技术等跨界组合。
结语:当"魔法子弹"装上"智能弹头"
ADC药物的未来,属于那些敢于突破传统、拥抱创新的探索者。从拓扑异构酶抑制剂到RNA聚合酶抑制剂,从免疫刺激载荷到双弹头设计,每一类新型载荷都在拓展ADC的适应症边界。随着技术迭代,ADC或将真正成为终结癌症的"终极武器"——精准制导、智能杀伤、唤醒免疫,为人类开启癌症治疗的新纪元。


杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
相关文章
更多 >

