ADC药物新型有效载荷的的抗癌机制
2025-05-16 来源:本站 点击次数:156
在肿瘤治疗的"武器库"中,化疗药物始终是主力军。它们像精准狙击手,有的阻断核苷酸合成,有的破坏DNA复制,还有的直接拆解微管蛋白——这个支撑细胞骨架的"钢筋工"。但传统化疗如同地毯式轰炸,敌我不分。直到抗体偶联药物(ADC)的出现,才让"精准打击"成为可能。
一、ADC进化史:从"青铜时代"到"王者归来"
最早的ADC尝试要追溯到20世纪50年代,科学家试图将鼠源抗体与化疗药物"联姻"。然而初代ADC如同装备简陋的"青铜战士":靶向性差、药物活性低,疗效未达预期却毒性不减。直到近年来,随着抗体工程技术和连接子化学的突破,ADC才真正实现"鸟枪换炮"。
当现有"弹头"逐渐显出局限性,科学家开始挖掘更具杀伤力的新型有效载荷:
三、临床前研究:为"超级武器"装上"安全阀"
要让这些"弹头"既高效又安全,需经过层层考验:
四、未来战场:ADC的"跨界远征"
理想的ADC"弹头"需满足:
独特作用机制:避免交叉耐药
pM级杀伤力:确保高效杀伤
旁观者效:清除异质性肿瘤细胞
快速清除:降低系统毒性
一、ADC进化史:从"青铜时代"到"王者归来"
最早的ADC尝试要追溯到20世纪50年代,科学家试图将鼠源抗体与化疗药物"联姻"。然而初代ADC如同装备简陋的"青铜战士":靶向性差、药物活性低,疗效未达预期却毒性不减。直到近年来,随着抗体工程技术和连接子化学的突破,ADC才真正实现"鸟枪换炮"。
如今获批的ADC堪称"超级武器",其搭载的"弹头"(有效载荷)毒性比传统化疗药物高1-2个数量级。这些"弹头"包括:
- DNA破坏者:如卡奇霉素(DNA烷化剂)、SN-38(拓扑异构酶抑制剂)
- 微管终结者:如MMAE(微管蛋白抑制剂)
- 转录狙击手:如DM1(RNA聚合酶抑制剂)
Payload特点
有效载荷(Payload)发挥ADC的细胞内细胞毒活性,通过接头部分与抗体共价结合的细胞毒性剂的性质非常重要,因为其作用机制将决定所得ADC作为抗癌化合物的效力及其可能的适应症。理想的有效载荷具备以下特点:具有足够高的细胞毒性;具有足够低的免疫原性;具有高稳定性;具有可修改的功能组,而不会显著影响其效力;具有旁观者杀伤效应;具有适当的水溶性;靶点应为细胞内,因为大多数ADC需要进入肿瘤细胞才能释放其有效载荷。
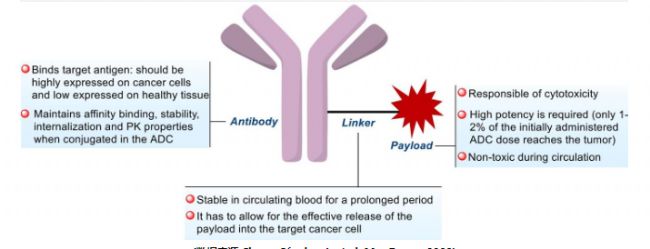
(数据来源 Cheng-Sánchez I, et al. Mar Drugs. 2022)
当现有"弹头"逐渐显出局限性,科学家开始挖掘更具杀伤力的新型有效载荷:
- 杜卡霉素:DNA的"液化武器"
作为DNA烷化剂,杜卡霉素能穿透细胞膜,连"铜墙铁壁"的多药耐药细胞也难逃其害。SYD985这款ADC就像"智能导弹",通过组织蛋白酶B精准裂解,释放毒性环丙烷攻击DNA。 - PNU-159682:蒽环类的"终极进化"
传统阿霉素的细胞毒性不够强?PNU-159682作为其肝脏代谢物,毒性提升百倍,专门狙击DNA拓扑异构酶II,且能绕过外排转运蛋白的"防御系统"。 - 鹅膏覃碱:RNA合成的"终结者"
这种从毒蘑菇提取的双环肽,能高效抑制RNA聚合酶II,连休眠期的肿瘤干细胞也无处可逃。HDP-101将其改造为"免疫激活弹头",与免疫检查点抑制剂联用展现协同效应。 - Tubulysins:微管的"拆解专家"
这类从粘细菌提取的四肽,毒性是长春碱的千倍。MEDI4276采用双特异性抗体设计,像"双面胶"般紧抓癌细胞,释放Tubulysin衍生物阻断微管聚合。 - 艾日布林:微管的"速冻装置"
作为海绵提取物的合成类似物,艾日布林能冻结微管动态平衡,对紫杉醇耐药细胞依然有效。MORAb-202将其与叶酸受体抗体结合,在临床试验中展现出同类最佳潜力。
三、临床前研究:为"超级武器"装上"安全阀"
要让这些"弹头"既高效又安全,需经过层层考验:
- 血浆蛋白结合:用放射性标记追踪低浓度下的结合率
- 组织分布:通过定量整体放射性自显影(QWBA)精准定位
- 代谢研究:确保"弹头"在循环系统中快速代谢,降低系统毒性
- 转运体影响:避开外排转运蛋白的"防御网",确保肿瘤组织有效蓄积
四、未来战场:ADC的"跨界远征"
理想的ADC"弹头"需满足:
独特作用机制:避免交叉耐药
pM级杀伤力:确保高效杀伤
旁观者效:清除异质性肿瘤细胞
快速清除:降低系统毒性
随着双弹头设计、核素载荷、PROTAC技术等创新涌现,ADC的适应症正从肿瘤向感染、自身免疫疾病等领域扩展。这场由"精准制导+超级弹头"引领的癌症治疗革命,正在改写人类的抗癌规则。
产品信息
杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
相关文章
更多 >

