从细胞杀手到免疫激活:ADC有效载荷的三代进化与未来突破
2025-05-16 来源:本站 点击次数:106
在抗体偶联药物(ADC)的精准抗癌体系中,有效载荷(payload)如同导弹的 “弹头”,其杀伤力与特异性直接决定治疗效果。从最初借用化疗药物的 “粗放攻击”,到如今聚焦 DNA 损伤剂与免疫调节剂的 “智能制导”,有效载荷历经三代技术革新,正从单一细胞毒性分子升级为融合多重机制的 “多功能武器”。本文将从作用机制、创新路径与未来方向,解析这一核心组件如何重塑 ADC 药物的抗癌格局。
一、有效载荷的 “理想武器” 画像:精准杀伤的六大黄金准则
理想的有效载荷需兼具 “杀手本能” 与 “精准特质”:
1. 第一代:化疗药物的 “跨界试水”
早期 ADC 直接借用经典化疗药如甲氨蝶呤、阿霉素,虽实现靶向递送,但毒性不足、耐药性强的缺陷显著。例如阿霉素类 ADC 因 payload 水溶性差、旁观者效应弱,临床效果有限,促使研发转向更高效的分子。
2. 第二代:微管抑制剂的 “精准绞杀”
以美登素(Maytansinoids)和奥瑞他汀(Auristatins)为代表,通过阻断微管聚合或稳定微管结构,将癌细胞阻滞在 G2/M 期:
3. 第三代:DNA 损伤剂的 “基因组爆破”
转向靶向 DNA 的载荷,通过双链断裂、烷基化等机制引发不可逆损伤:
三、多元化创新:从 “单一杀伤” 到 “机制跨界”
1. 靶向 RNA:狙击休眠癌细胞的 “沉默杀手”
针对 RNA 的载荷可攻击分裂期与休眠期细胞:
2. 免疫激活:改写肿瘤微环境的 “双向武器”
免疫类 ADC(ISACs)跳出直接杀伤模式,通过激活免疫系统实现 “双重打击”:
3. 新型潜力:突破传统框架的 “未来之星”
四、未来方向:从 “单一弹头” 到 “智能武器库”
1. 双载荷 ADC:同时搭载微管抑制剂与 DNA 损伤剂,协同攻击多条通路,降低耐药风险;
2. 个性化定制:基于肿瘤基因组特征设计载荷,如针对 BRCA 突变肿瘤的 PARP 抑制剂载荷;
3. 多学科融合:结合 AI 药物设计优化载荷结构,利用基因编辑技术开发肿瘤特异性靶点偶联物;
4. 毒性精准调控:通过可裂解连接子与 pH 响应释放,平衡疗效与安全性,如改善卡奇霉素的正常组织毒性。
有效载荷 ——ADC 变革的 “引擎核心”
从天然产物提取到全合成创新,从细胞毒性分子到免疫调节剂,有效载荷的进化史就是 ADC 药物的 “战斗力升级史”。当靶向微管的 “细胞分裂终结者”、靶向 DNA 的 “基因组爆破手” 与激活免疫的 “微环境重塑者” 协同发力,ADC 正从 “精准打击” 迈向 “系统瓦解”。未来,随着双载荷、PROTAC 等新技术的落地,有效载荷将成为连接靶向治疗、免疫治疗与基因治疗的核心枢纽,推动癌症治疗进入 “个性化精准制导” 的全新时代。每一次载荷创新,都是向 “治愈癌症” 目标发射的一枚新 “弹头”,而这场持续升级的 “武器革命”,终将改写肿瘤治疗的未来格局。
产品信息
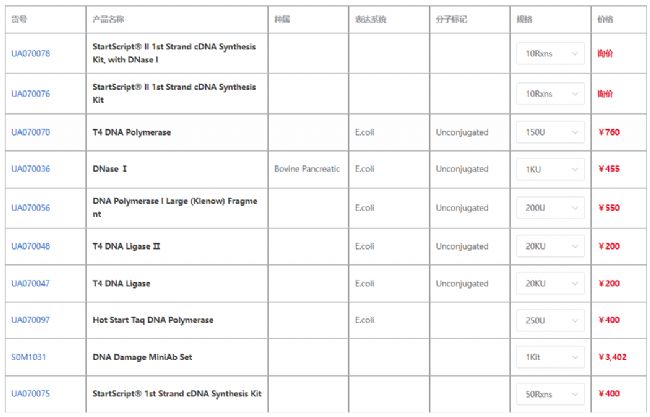
杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
一、有效载荷的 “理想武器” 画像:精准杀伤的六大黄金准则
理想的有效载荷需兼具 “杀手本能” 与 “精准特质”:
- 极致毒性:皮摩尔级(pM)细胞毒性,确保少量分子即可诱导癌细胞凋亡;
- 低免疫原性:避免引发抗体反应,延长药物循环时间;
- 稳定性优势:在血液中保持结构完整,抵达肿瘤后响应微环境释放;
- 可修饰性:预留偶联位点,不影响药效的同时兼容连接子设计;
- 旁观者效应:杀伤邻近未表达抗原的癌细胞,应对肿瘤异质性;
- 胞内靶向:作用靶点位于细胞内,规避细胞外环境干扰。
这些特性如同 “武器验收标准”,驱动有效载荷从天然产物改造走向全合成创新。
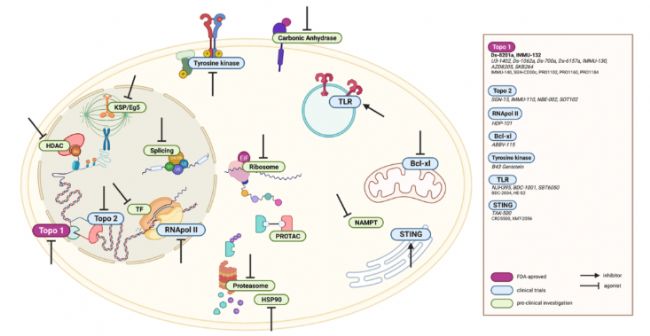
微管和DNA烷化剂以外的ADC有效载荷示意图
1. 第一代:化疗药物的 “跨界试水”
早期 ADC 直接借用经典化疗药如甲氨蝶呤、阿霉素,虽实现靶向递送,但毒性不足、耐药性强的缺陷显著。例如阿霉素类 ADC 因 payload 水溶性差、旁观者效应弱,临床效果有限,促使研发转向更高效的分子。
2. 第二代:微管抑制剂的 “精准绞杀”
以美登素(Maytansinoids)和奥瑞他汀(Auristatins)为代表,通过阻断微管聚合或稳定微管结构,将癌细胞阻滞在 G2/M 期:
- 美登素衍生物 DM1/DM4:源自非洲灌木的天然产物,经 C3 侧链修饰获得偶联位点,成为曲妥珠单抗 ADC(T-DM1)的核心载荷,开创 HER2 阳性乳腺癌治疗新范式;
- 奥瑞他汀 MMAE/MMAF:海兔毒素合成类似物,四肽结构赋予高膜渗透性,介导的旁观者效应显著增强实体瘤杀伤,支撑帕妥珠单抗等 ADC 的临床成功。
这类载荷的 IC50 低至纳摩尔级(nM),但对分裂期细胞的选择性限制了对休眠肿瘤细胞的作用。
3. 第三代:DNA 损伤剂的 “基因组爆破”
转向靶向 DNA 的载荷,通过双链断裂、烷基化等机制引发不可逆损伤:
- 烯二炔类卡奇霉素:自然界最强细胞毒素之一,诱导 DNA 双链断裂效率比化疗药高 100 倍,支撑 Mylotarg 治疗急性髓系白血病;
- 拓扑异构酶 I 抑制剂 DXd:喜树碱衍生物,克服传统药物水溶性差问题,在 T-DXd 中展现 “旁观者效应” 优势,对 HER2 低表达乳腺癌客观缓解率达 60%;
- PBD 二聚体:选择性烷基化 DNA 小沟,单药即可引发凋亡,成为下一代高特异性载荷候选。
这类载荷作用于全细胞周期,对低抗原表达肿瘤仍有效,突破第二代的靶点限制。
三、多元化创新:从 “单一杀伤” 到 “机制跨界”
1. 靶向 RNA:狙击休眠癌细胞的 “沉默杀手”
针对 RNA 的载荷可攻击分裂期与休眠期细胞:
- 泰兰斯他汀:抑制 mRNA 剪接体,阻断癌细胞基因表达,辉瑞将其与曲妥珠单抗偶联,体外试验显示对耐药细胞株的高效清除;
- 毒伞肽:抑制 RNA 聚合酶 II,水溶性环状八肽结构赋予稳定性,HDP-101 靶向 BCMA 治疗多发性骨髓瘤,临床试验显示深度缓解潜力。
2. 免疫激活:改写肿瘤微环境的 “双向武器”
免疫类 ADC(ISACs)跳出直接杀伤模式,通过激活免疫系统实现 “双重打击”:
- TLR 激动剂:如 TLR7/8 激动剂与抗 Her2 抗体偶联,驱动树突状细胞成熟和 CD8+T 细胞募集,将 “冷肿瘤” 转化为 “热肿瘤”,恒瑞、百济等药企已布局相关管线;
- STING 激动剂:环二核苷酸(CDN)偶联抗体靶向递送,激活 I 型干扰素通路,Mersana 的 XMT-2056 获 FDA 孤儿药认定,针对胃癌的临床前数据显示肿瘤微环境显著重塑。
3. 新型潜力:突破传统框架的 “未来之星”
- Bcl-xL 抑制剂:阻断抗凋亡蛋白,诱导癌细胞程序性死亡,AbbVie 的 ABBV-155 靶向 EGFR,降低对血小板毒性,临床研究中展现对实体瘤的抑制潜力;
- PROTAC 分子:利用蛋白酶体降解机制,为 ADC 引入 “蛋白降解” 新功能,解决传统载荷耐药问题;
- 近红外光免疫疗法:IR700DX 等光敏剂作为载荷,光照触发肿瘤血管破坏,开创 “光控精准杀伤” 新领域。
四、未来方向:从 “单一弹头” 到 “智能武器库”
1. 双载荷 ADC:同时搭载微管抑制剂与 DNA 损伤剂,协同攻击多条通路,降低耐药风险;
2. 个性化定制:基于肿瘤基因组特征设计载荷,如针对 BRCA 突变肿瘤的 PARP 抑制剂载荷;
3. 多学科融合:结合 AI 药物设计优化载荷结构,利用基因编辑技术开发肿瘤特异性靶点偶联物;
4. 毒性精准调控:通过可裂解连接子与 pH 响应释放,平衡疗效与安全性,如改善卡奇霉素的正常组织毒性。
有效载荷 ——ADC 变革的 “引擎核心”
从天然产物提取到全合成创新,从细胞毒性分子到免疫调节剂,有效载荷的进化史就是 ADC 药物的 “战斗力升级史”。当靶向微管的 “细胞分裂终结者”、靶向 DNA 的 “基因组爆破手” 与激活免疫的 “微环境重塑者” 协同发力,ADC 正从 “精准打击” 迈向 “系统瓦解”。未来,随着双载荷、PROTAC 等新技术的落地,有效载荷将成为连接靶向治疗、免疫治疗与基因治疗的核心枢纽,推动癌症治疗进入 “个性化精准制导” 的全新时代。每一次载荷创新,都是向 “治愈癌症” 目标发射的一枚新 “弹头”,而这场持续升级的 “武器革命”,终将改写肿瘤治疗的未来格局。
产品信息

杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
相关文章
更多 >

