泛素化的作用机制、多维功能及在疾病治疗中的应用
2025-05-19 来源:本站 点击次数:245
在细胞的精密调控网络中,泛素化堪称最为复杂且多功能的翻译后修饰之一。这种通过小分子蛋白泛素(Ub)对靶蛋白进行共价标记的过程,犹如为蛋白质配备了可动态改写的 “分子标签”,不仅决定蛋白质的命运,更在细胞生命活动的各个维度发挥核心调控作用。从细胞周期的精准推进到 DNA 损伤修复的分子机制,从癌症的发生发展到神经退行性疾病的病理进程,泛素化系统以其独特的多样性和多价性,编织出一张覆盖细胞稳态与疾病发生的复杂调控网络。
一、泛素化:从基础机制到功能多样性的分子革命
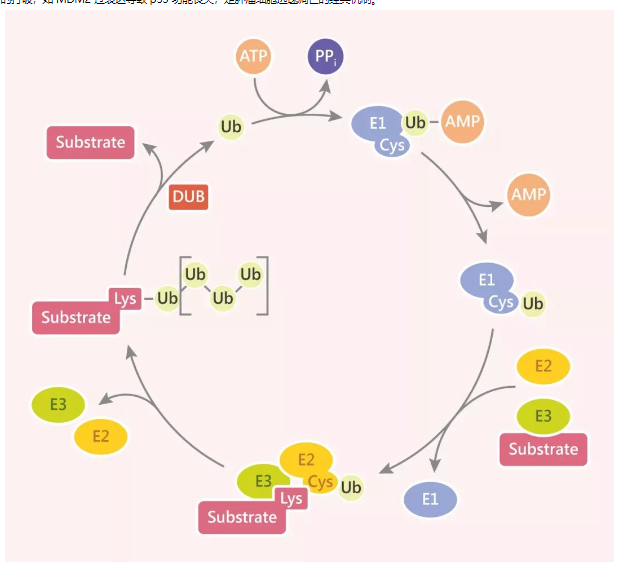
泛素化的核心是通过 E1-E2-E3 酶促级联反应,将 76 个氨基酸组成的泛素分子连接到靶蛋白的赖氨酸残基上。这一过程绝非简单的 “蛋白质降解信号”,而是根据泛素链的长度(单泛素化、多泛素化、多聚泛素化)和连接方式(Met1、K6、K11 等 8 种赖氨酸位点及 N 端甲硫氨酸),赋予靶蛋白丰富的功能调控维度:
二、细胞调控的核心枢纽:泛素化的多维功能解析
1. 细胞周期:泛素化的精准计时机制
在细胞分裂的 “倒计时” 中,SCF 与 APC/C 两类 E3 连接酶通过特异性泛素化修饰扮演 “分子时钟” 角色:SCF 识别磷酸化底物(如 p27)促进 S 期进程,APC/C 则通过 K11 泛素化降解周期蛋白(Cyclins)驱动有丝分裂。这种时空特异性的泛素化事件,确保染色体分离与细胞周期转换的高度有序,其异常如 APC/C 功能失调,直接导致基因组不稳定性,成为癌症的重要特征。
2. 受体内化:膜信号的动态终结者
跨膜受体如 EGFR 的信号终止依赖泛素化介导的内吞分选:Cbl 家族 E3 连接酶催化 EGFR 的 K63 单泛素化,决定其进入网格蛋白依赖或非依赖的内化路径,进而影响信号持续时间与细胞响应。这种 “信号刹车” 机制的失效,如 EGFR 泛素化异常导致的持续激活,是多种实体瘤发生的关键驱动因素。
3. DNA 损伤修复:基因组的 “分子修补匠”
在 DNA 遭遇损伤时,泛素化通过单泛素化修饰启动修复级联:范科尼贫血相关蛋白 FANCD2 的 K561 单泛素化,介导其招募至损伤位点并与 BRCA1/2 协同修复交联 DNA。这种精准的损伤响应网络若出现缺陷,如 FANCD2 泛素化位点突变,将导致染色体不稳定,显著增加白血病与鳞状细胞癌风险。
4. 细胞凋亡:生死抉择的分子开关
泛素化在凋亡调控中呈现双向调节特性:MDM2 通过 K48 泛素化降解抑癌基因 p53,解除细胞周期阻滞与凋亡诱导;而凋亡抑制因子 IAPs 则通过泛素化降解促凋亡蛋白 Caspase,形成抗凋亡保护。这种平衡的打破,如 MDM2 过表达导致 p53 功能丧失,是肿瘤细胞逃逸凋亡的经典机制。
三、疾病关联:从机制异常到治疗新靶标
1. 癌症:泛素化网络的系统性失衡
泛素化失调在肿瘤发生中呈现多维度影响:
在帕金森病中,α- 突触核蛋白的异常泛素化形成路易氏小体,阻碍蛋白酶体功能并引发神经元死亡;阿尔茨海默病中,tau 蛋白的过度磷酸化与泛素化导致神经原纤维缠结,UPS 系统效率下降加速病理进程。泛素化修饰的位点特异性(如 α- 突触核蛋白的 K63 泛素化促进聚集)为开发精准干预策略提供了靶点,如靶向异常泛素化聚集的小分子化合物已进入临床前研究。
四、未来展望:从基础解析到精准干预
尽管泛素化研究已揭示其在细胞调控与疾病中的核心地位,仍有诸多未解之谜:非典型泛素链(如 K11、K27)的功能多样性、泛素化与磷酸化 / 乙酰化的交叉调控网络,以及如何针对 E3 连接酶的底物特异性开发高选择性药物。随着蛋白质组学技术的进步与基因编辑工具的创新,泛素化系统正从 “基础机制研究” 迈向 “精准医疗应用”:
结语:解码分子标签,开启精准调控新维度
泛素化系统的发现与研究,不仅革新了我们对蛋白质功能调控的认知,更揭示了细胞稳态维持与疾病发生的深层逻辑。从最初被视为 “蛋白质降解信号” 到如今作为覆盖多维度调控的 “分子操作系统”,泛素化的故事远未终结。随着技术的进步与机制的深入解析,这个存在于所有真核生物中、仅相差 3 个氨基酸的保守系统,正引领我们走向精准干预疾病的新前沿。或许正如其发现历程所启示的,对泛素化功能的每一次解密,都是打开细胞调控黑箱的一把钥匙,终将为癌症、神经退行性疾病等重大疾病的治疗带来颠覆性突破。
产品信息
杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
一、泛素化:从基础机制到功能多样性的分子革命
泛素化的核心是通过 E1-E2-E3 酶促级联反应,将 76 个氨基酸组成的泛素分子连接到靶蛋白的赖氨酸残基上。这一过程绝非简单的 “蛋白质降解信号”,而是根据泛素链的长度(单泛素化、多泛素化、多聚泛素化)和连接方式(Met1、K6、K11 等 8 种赖氨酸位点及 N 端甲硫氨酸),赋予靶蛋白丰富的功能调控维度:
- 标签类型决定功能输出:K48 连接的多聚泛素化通常标记蛋白酶体降解,如 p53 的负调控因子 MDM2 通过 K48 泛素化促进 p53 降解;K63 连接的泛素化则更多参与信号传导与膜运输,如 EGFR 的内吞分选依赖 K63 泛素链增强效率。
- 动态可逆的调控平衡:去泛素化酶(DUBs)如 USP 家族与泛素化系统形成双向调控,确保细胞在增殖、凋亡等关键过程中的精确响应,这种动态平衡的失调往往是疾病发生的重要诱因。
二、细胞调控的核心枢纽:泛素化的多维功能解析
1. 细胞周期:泛素化的精准计时机制
在细胞分裂的 “倒计时” 中,SCF 与 APC/C 两类 E3 连接酶通过特异性泛素化修饰扮演 “分子时钟” 角色:SCF 识别磷酸化底物(如 p27)促进 S 期进程,APC/C 则通过 K11 泛素化降解周期蛋白(Cyclins)驱动有丝分裂。这种时空特异性的泛素化事件,确保染色体分离与细胞周期转换的高度有序,其异常如 APC/C 功能失调,直接导致基因组不稳定性,成为癌症的重要特征。
2. 受体内化:膜信号的动态终结者
跨膜受体如 EGFR 的信号终止依赖泛素化介导的内吞分选:Cbl 家族 E3 连接酶催化 EGFR 的 K63 单泛素化,决定其进入网格蛋白依赖或非依赖的内化路径,进而影响信号持续时间与细胞响应。这种 “信号刹车” 机制的失效,如 EGFR 泛素化异常导致的持续激活,是多种实体瘤发生的关键驱动因素。
3. DNA 损伤修复:基因组的 “分子修补匠”
在 DNA 遭遇损伤时,泛素化通过单泛素化修饰启动修复级联:范科尼贫血相关蛋白 FANCD2 的 K561 单泛素化,介导其招募至损伤位点并与 BRCA1/2 协同修复交联 DNA。这种精准的损伤响应网络若出现缺陷,如 FANCD2 泛素化位点突变,将导致染色体不稳定,显著增加白血病与鳞状细胞癌风险。
4. 细胞凋亡:生死抉择的分子开关
泛素化在凋亡调控中呈现双向调节特性:MDM2 通过 K48 泛素化降解抑癌基因 p53,解除细胞周期阻滞与凋亡诱导;而凋亡抑制因子 IAPs 则通过泛素化降解促凋亡蛋白 Caspase,形成抗凋亡保护。这种平衡的打破,如 MDM2 过表达导致 p53 功能丧失,是肿瘤细胞逃逸凋亡的经典机制。

三、疾病关联:从机制异常到治疗新靶标
1. 癌症:泛素化网络的系统性失衡
泛素化失调在肿瘤发生中呈现多维度影响:
- 蛋白稳定性调控:VHL 基因缺失导致 HIF-1α 泛素化降解失效,促进肿瘤血管生成;SCF-SKP2 异常激活降解 p27,驱动细胞周期失控。
- 信号通路活化:K-RAS 的单泛素化增强其 GTP 结合能力,激活 PI3K-AKT 通路;EGFR 泛素化缺陷导致 MAPK 信号持续激活,促进细胞恶性转化。
针对泛素化通路的药物开发已取得突破,如蛋白酶体抑制剂硼替佐米在多发性骨髓瘤中的应用,以及 MDM2 抑制剂通过解除 p53 抑制重启凋亡通路。
在帕金森病中,α- 突触核蛋白的异常泛素化形成路易氏小体,阻碍蛋白酶体功能并引发神经元死亡;阿尔茨海默病中,tau 蛋白的过度磷酸化与泛素化导致神经原纤维缠结,UPS 系统效率下降加速病理进程。泛素化修饰的位点特异性(如 α- 突触核蛋白的 K63 泛素化促进聚集)为开发精准干预策略提供了靶点,如靶向异常泛素化聚集的小分子化合物已进入临床前研究。
四、未来展望:从基础解析到精准干预
尽管泛素化研究已揭示其在细胞调控与疾病中的核心地位,仍有诸多未解之谜:非典型泛素链(如 K11、K27)的功能多样性、泛素化与磷酸化 / 乙酰化的交叉调控网络,以及如何针对 E3 连接酶的底物特异性开发高选择性药物。随着蛋白质组学技术的进步与基因编辑工具的创新,泛素化系统正从 “基础机制研究” 迈向 “精准医疗应用”:
- 靶向 E3 连接酶:开发如 VHL、MDM2 等特异性抑制剂,精准恢复肿瘤抑制因子功能;
- 调控去泛素化酶:通过激活 USP 家族成员挽救抑癌蛋白表达,或抑制 DUBs 增强蛋白酶体降解效率;
- 多组学整合:结合泛素化修饰组学与单细胞测序,绘制疾病相关的泛素化动态图谱,实现个体化治疗策略。
结语:解码分子标签,开启精准调控新维度
泛素化系统的发现与研究,不仅革新了我们对蛋白质功能调控的认知,更揭示了细胞稳态维持与疾病发生的深层逻辑。从最初被视为 “蛋白质降解信号” 到如今作为覆盖多维度调控的 “分子操作系统”,泛素化的故事远未终结。随着技术的进步与机制的深入解析,这个存在于所有真核生物中、仅相差 3 个氨基酸的保守系统,正引领我们走向精准干预疾病的新前沿。或许正如其发现历程所启示的,对泛素化功能的每一次解密,都是打开细胞调控黑箱的一把钥匙,终将为癌症、神经退行性疾病等重大疾病的治疗带来颠覆性突破。
产品信息

杭州斯达特 (www.starter-bio.com)志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
相关文章
更多 >

