常见实验技术免疫染色 (IHCICCIF) 全流程解析
2025-06-25 来源:MedChemExpress 点击次数:42IHC/ICC/IF 总迷糊? 免疫染色为啥感觉那么多?
速戳本文!让你的看后胸有成竹~
Section.01
免疫染色知多少?
免疫染色 (Immunostaining) 是一项重要的生物学技术,主要用于检测组织切片中的特定抗原并获取有关细胞结构的信息。
免疫染色是基于抗体与其靶抗原的特异性结合 (图 1)。抗原抗体复合物的检测依赖于与抗体偶联的标记物。使用酶时,需要酶的比色法或化学发光法底物。酶催化反应生成有色产物,可使用光学显微镜检测。对于荧光染料,可使用荧光显微镜测量荧光信号,无需额外的底物[1]。
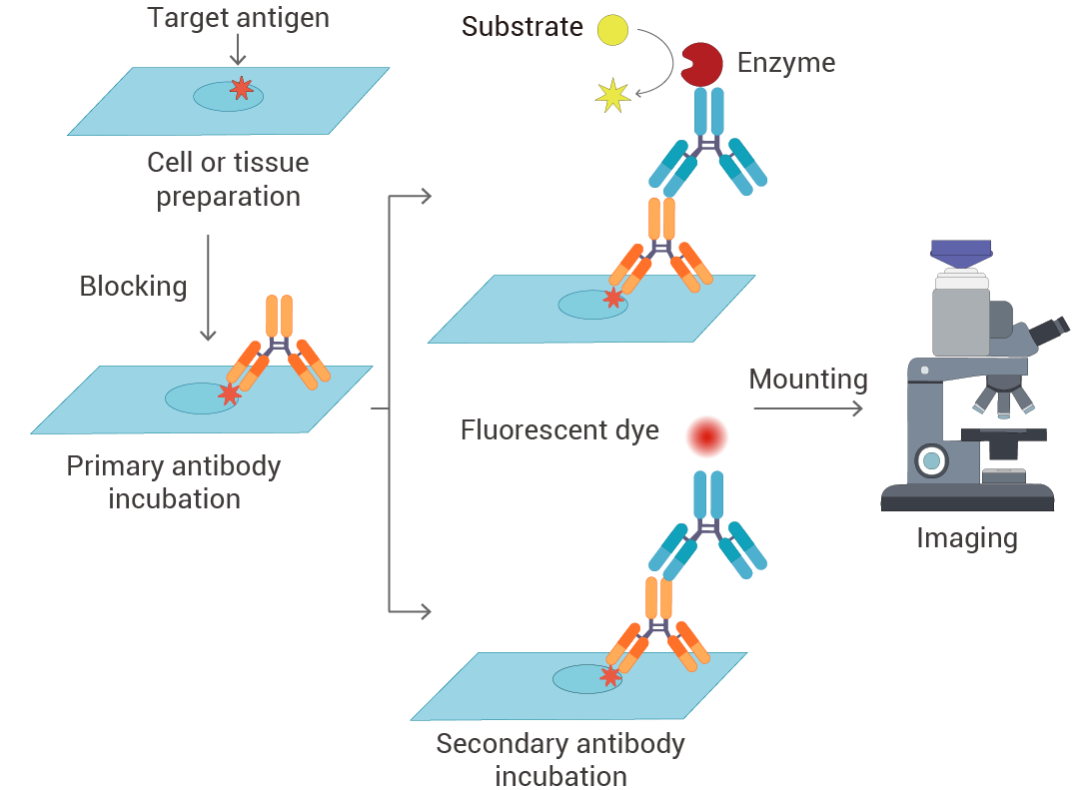 图 1. 免疫染色的典型工作流程。
图 1. 免疫染色的典型工作流程。免疫染色始于细胞或组织制备,其中特定细胞或组织样本被固定以保留其结构。然后将样本与封闭缓冲液孵育,以防止抗原和抗体之间的非特异性结合。随后,将样本与特异性结合目标抗原的一抗孵育,再与连接荧光染料或酶的二抗孵育。清洗去除多余抗体后,使用封固剂将样本封固在载玻片上。最后,使用合适的显微镜观察抗原-抗体复合物。
免疫染色:直接法 or 间接法?
免疫染色主要使用两种方法:间接免疫染色法和直接免疫染色法。
- 间接法:同时使用一抗和二抗。一抗可特异性结合目标抗原。一抗通常在动物体内通过注射特定抗原而产生 (例如山羊、小鼠或兔子)。二抗通常与可检测标记物(例如酶或荧光染料)偶联,并与一抗结合。为防止交叉反应,最好使用与产生一抗的物种不同的二抗。多个二抗可以与每个一抗相互作用,从而增强可检测信号。此外,一种二抗可以与多种一抗一起使用。
- 直接法:使用与特异性结合抗原的可检测标记物偶联的单一抗体。该方法只需一步抗体孵育,比间接法更简单、更快捷。然而,由于直接法使用单一抗体,其灵敏度低于间接法,而且由于可用的探针/酶偶联一抗有限,其应用受到限制。
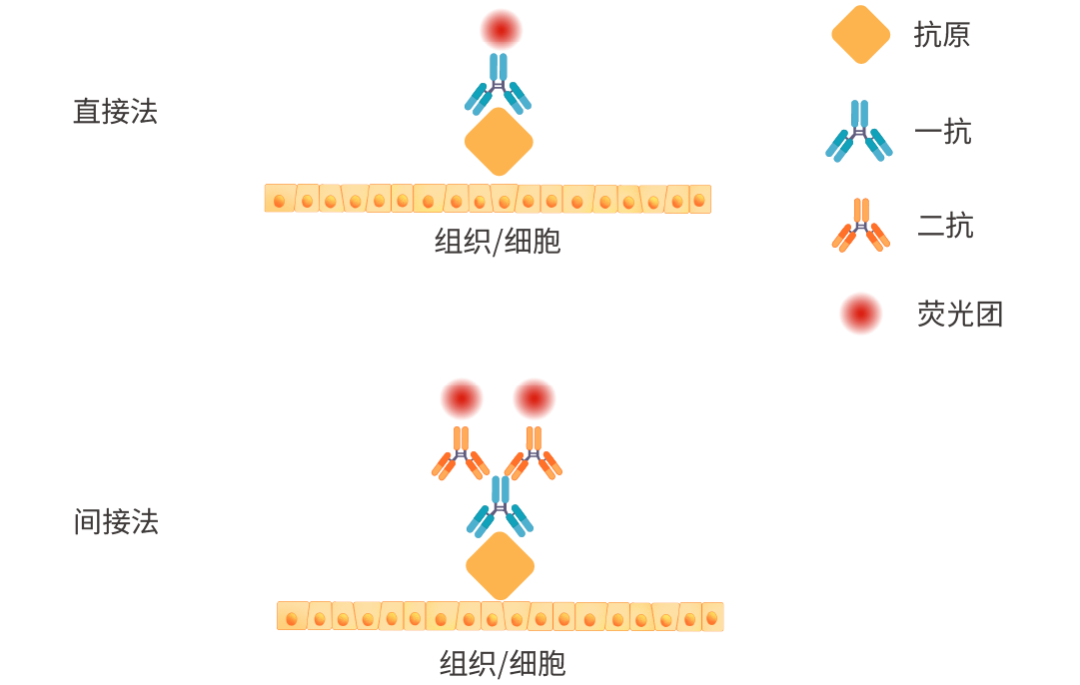
图 2. 直接法和间接法示意图。
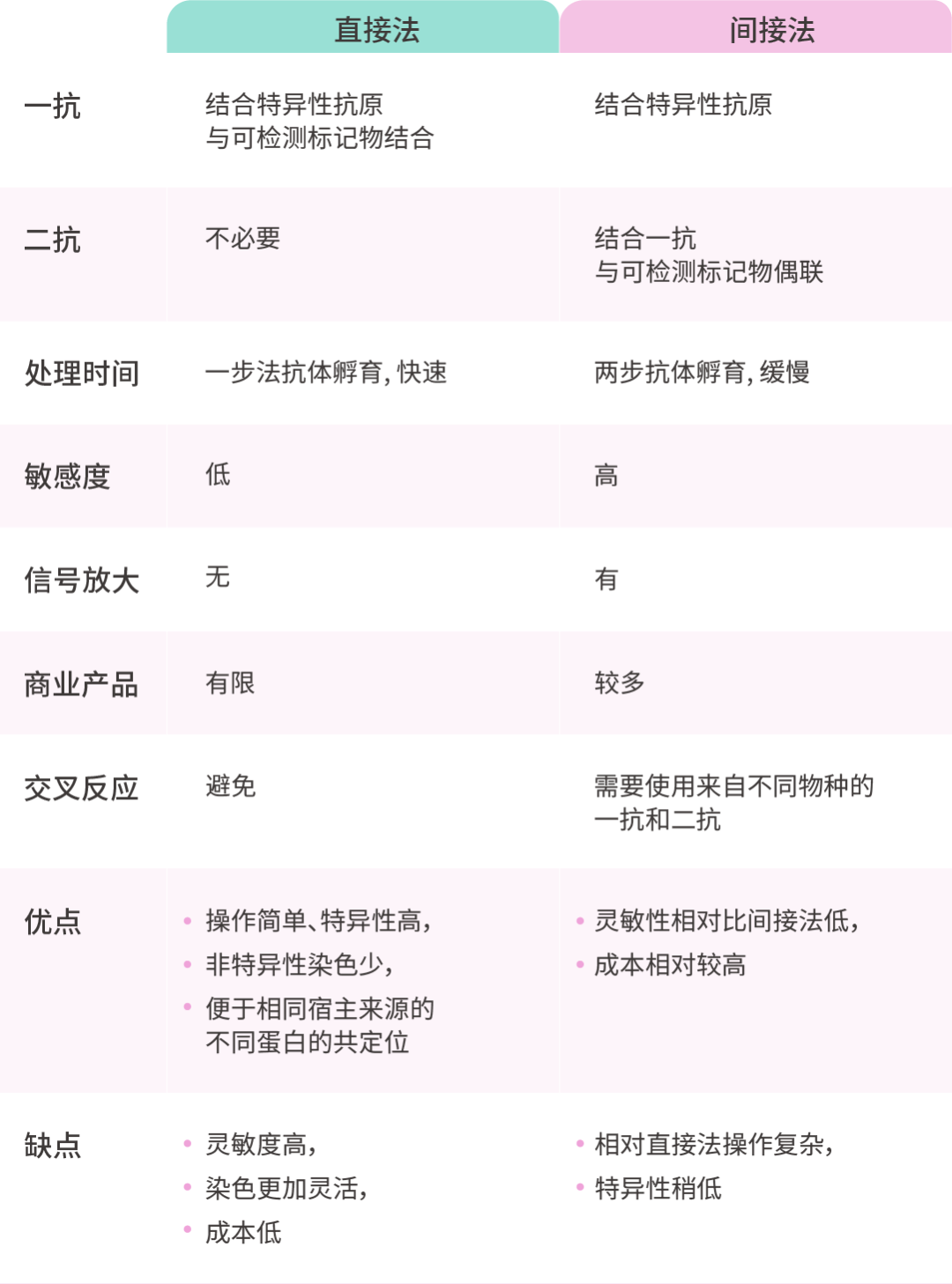
两种方法各有优势,研究人员可参考下面表格 (表 1)[1],根据实验目的选择合适的方法!
表 1. 直接和间接免疫染色方法的特点
 分不清 一文 Get 全流程! (建议收藏)/6_15Yl6OugxGAoC1AggGYqbYgA9JQgOQ.png)
免疫染色:ICC、IHC 与 IF?
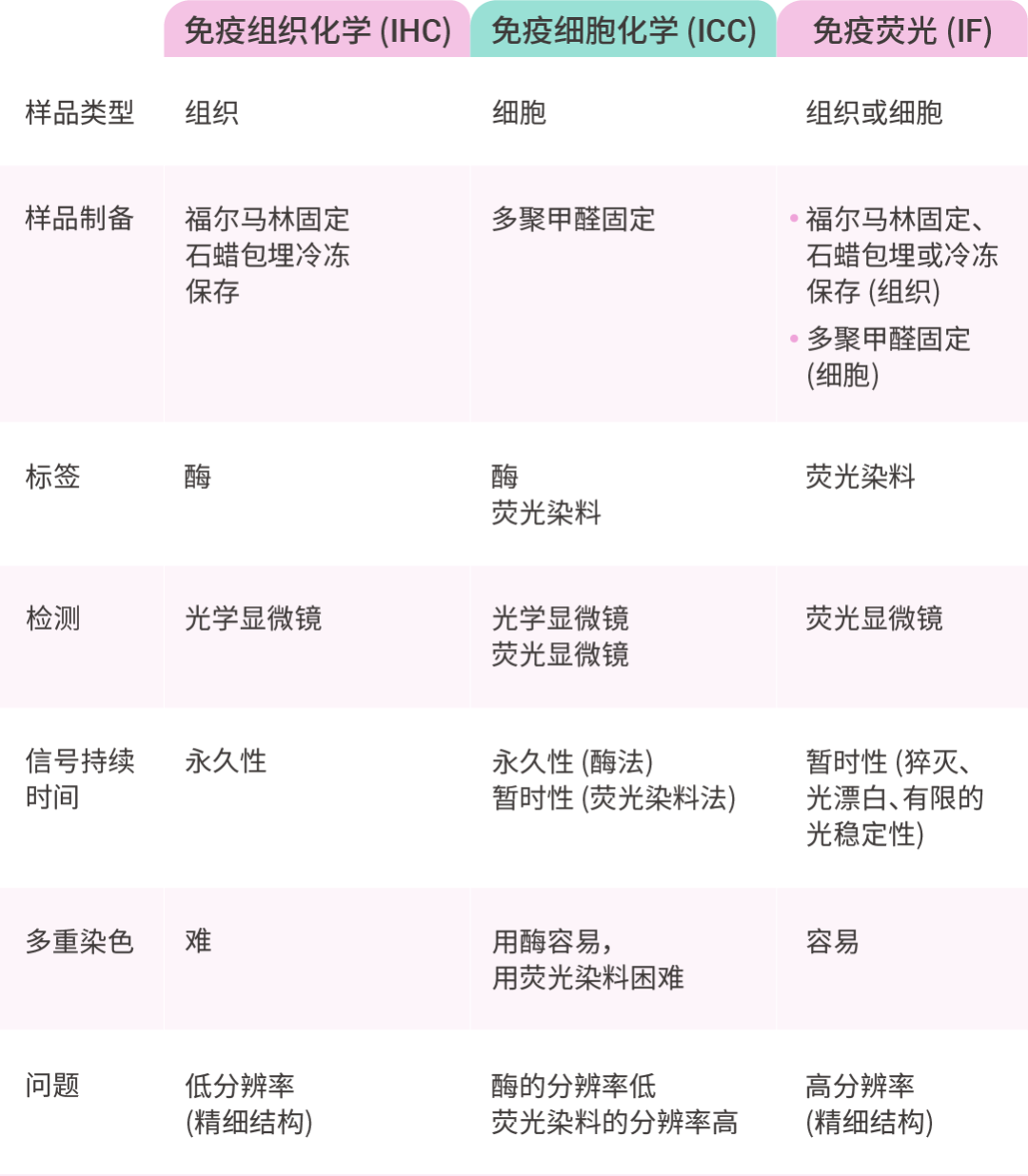
ICC 与 IHC 均属于免疫染色。免疫组化 (Immunohistochemistry, IHC) 是用于检测组织切片中特定抗原或蛋白质,广泛应用于病理学,以诊断癌症等疾病和研究组织特异性蛋白质测定。当应用于细胞学制备时,通常称为免疫细胞化学 (Immunocytochemistry, ICC),其适用于多种细胞学样本,例如细胞块、风干玻片、乙醇固定玻片、直接涂片、细胞离心涂片和液基细胞学 (Liquid-based cytology, LBC) 样本[2][3]。ICC 常用于识别细胞中特定生物标志物的存在、亚细胞定位和原位大分子相互作用[1]。
免疫荧光 (Immunofluorescence, IF) 也是利用抗体和抗原的结合特异性,是免疫染色的一种广泛应用的例子。IHC 通常使用多种不同的酶标记物来检测目标抗原。(当然,IHC 也可升级为多重荧光染色的 mIHC)。ICC 通过使用与抗体偶联的荧光染料或酶,可以分别在荧光显微镜和光学显微镜下可视化目标抗原。IF 利用荧光显微镜检测与抗体结合的荧光染料,此外,IF 可进行多种荧光染色,允许研究人员进行多重标记,IF 的多重染色常用于评估大分子的共定位[1]。
注意:对于多重染色,需要选择发射光谱不重叠的荧光染料,以防止光谱重叠导致信号错误解读。
表 2. 不同类型免疫染色的特点[1]
 分不清 一文 Get 全流程! (建议收藏)/7_TD1sWFkBj1tJypD6y6ngkQKUtGyjNA.png)
Section.02
ICC/IF: 实操流程
往期我们为大家介绍了免疫组化,本期我们来了解下 ICC/IF 究竟如何做?
第一步:样品准备
细胞免疫荧光技术是一种基于抗体与标记物相互作用的技术。它通过特异性的抗体与细胞表面或细胞内分子结合,再通过标记物在荧光显微镜下进行观察。实验流程通常包括样品制备、固定、通透、封闭、抗体孵育、复染、封片和观察 8 个部分。
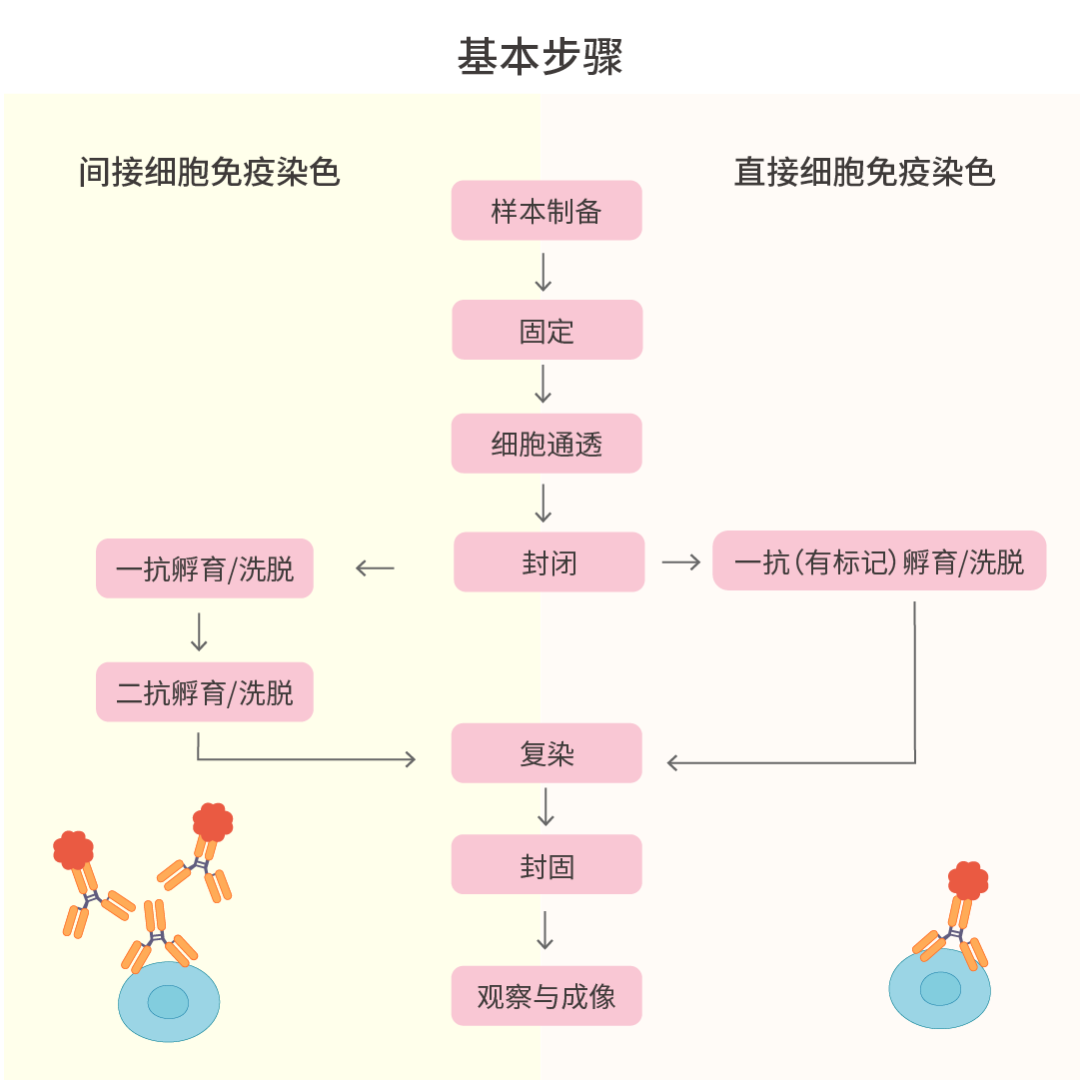
 分不清 一文 Get 全流程! (建议收藏)/8_UGvSWANxPbJlNOXfbiaRsozvfpg65g.png) 图 3. ICC/IF 实验流程图。
图 3. ICC/IF 实验流程图。目的
根据实验设计,准备状态良好的细胞样品。细胞培养是实验的基础,细胞状态直接影响实验结果。
步骤
基本步骤:
1. 准备盖玻片或共聚焦小皿。盖玻片需提前浸泡在 70% 乙醇中,盖玻片完全干燥后移至细胞培养板中,整个过程注意无菌操作。
2. 铺细胞。在包被的盖玻片或板上铺适当的细胞,使后续固定细胞时,融汇度达到 50-60%。如果细胞过密或过稀,正常细胞结构可能会受到影响。
3. 收集样品。针对贴壁细胞,细胞继续培养 12 h,细胞牢牢贴壁后,收集样品进行后续操作。而对于悬浮细胞,可以通过甩片进行。
Tips:
① 尽量选用新鲜制备的样本,并确定样品中抗原分子的表达丰度;
② 后续所有操作,动作要轻柔,避免细胞脱落;
③ 后续所有操作都需避免干片。
第二步:固定
目的
使用固定剂(如甲醇、丙酮、多聚甲醛等)处理细胞,使蛋白质变性凝固,从而固定细胞形态和结构。同时,固定剂还能减少或终止内源性或外源性细胞内分解酶的反应,防止组织细胞自溶,保护抗原性。
固定剂如何选?
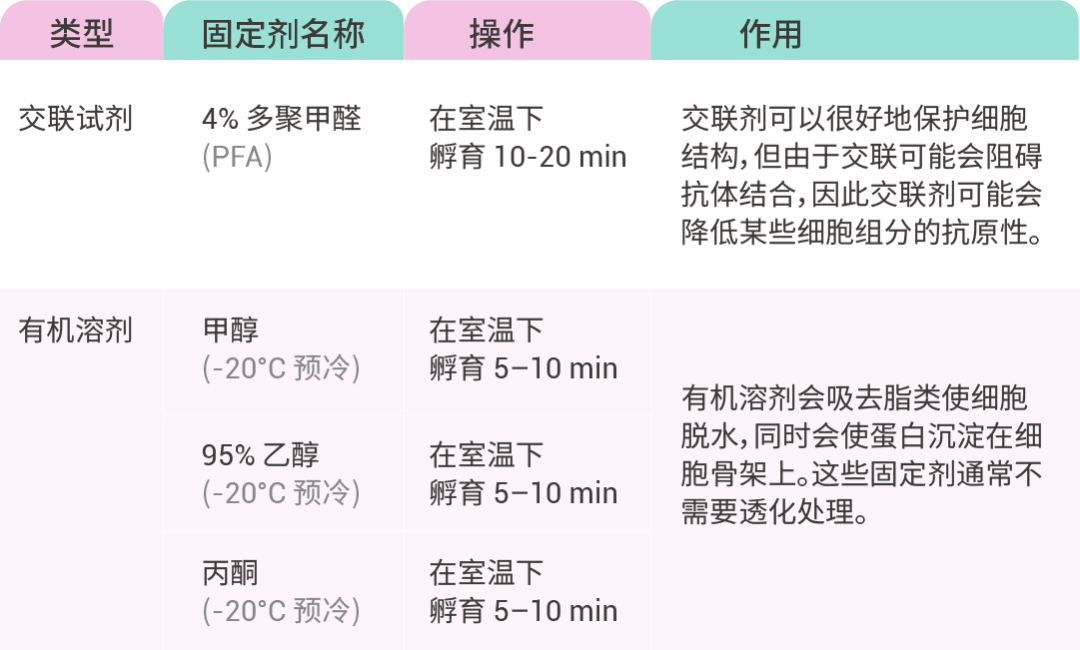
 分不清 一文 Get 全流程! (建议收藏)/9_ibfT7XibZGWRsTGfPJYupO38WKmf3g.png)
步骤
1. 固定:使用 4% 的多聚甲醛固定细胞 10 ~ 15 min;
2. 洗涤:使用 PBS 缓冲液清洗 3 次,以去除残留的固定液。
Tips:
① 初次实验,建议从 4% 的多聚甲醛,固定 15 min 开始尝试,倘若没有达到预期效果,再调整固定时间或更换另一种固定剂。
② 较长的孵育时间通常会导致更高的固定程度,直至表位可能过度固定。孵育时间短可能导致表位保存不良和样品固定不足。最佳固定时间需要根据经验确定。
第三步:通透
目的
通过去污剂部分溶解细胞膜,形成孔洞,从而使抗体能够到达细胞内表位,与细胞内的抗原结合。(该步骤可选做;通透步骤会破坏细胞膜,细胞膜表面抗原不适合选择通透实验)
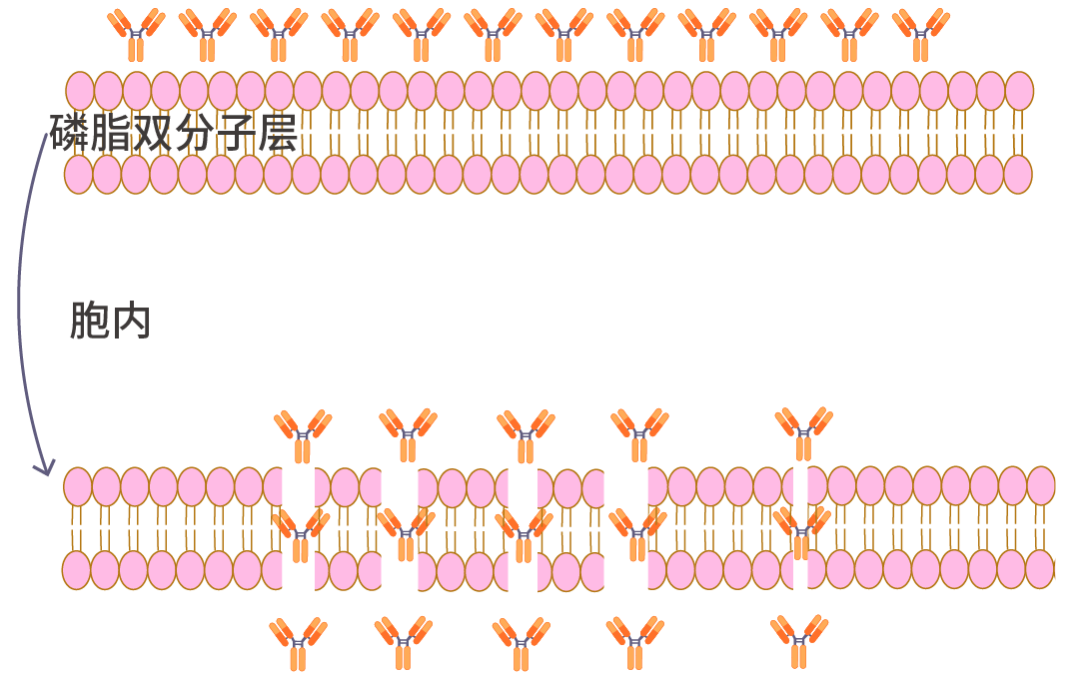
 分不清 一文 Get 全流程! (建议收藏)/10_j0uRjf1gxDPRQBoWK4XiaAlGuY5PHA.png) 图 4. 细胞膜打孔处理示意图。
图 4. 细胞膜打孔处理示意图。通透剂如何选?
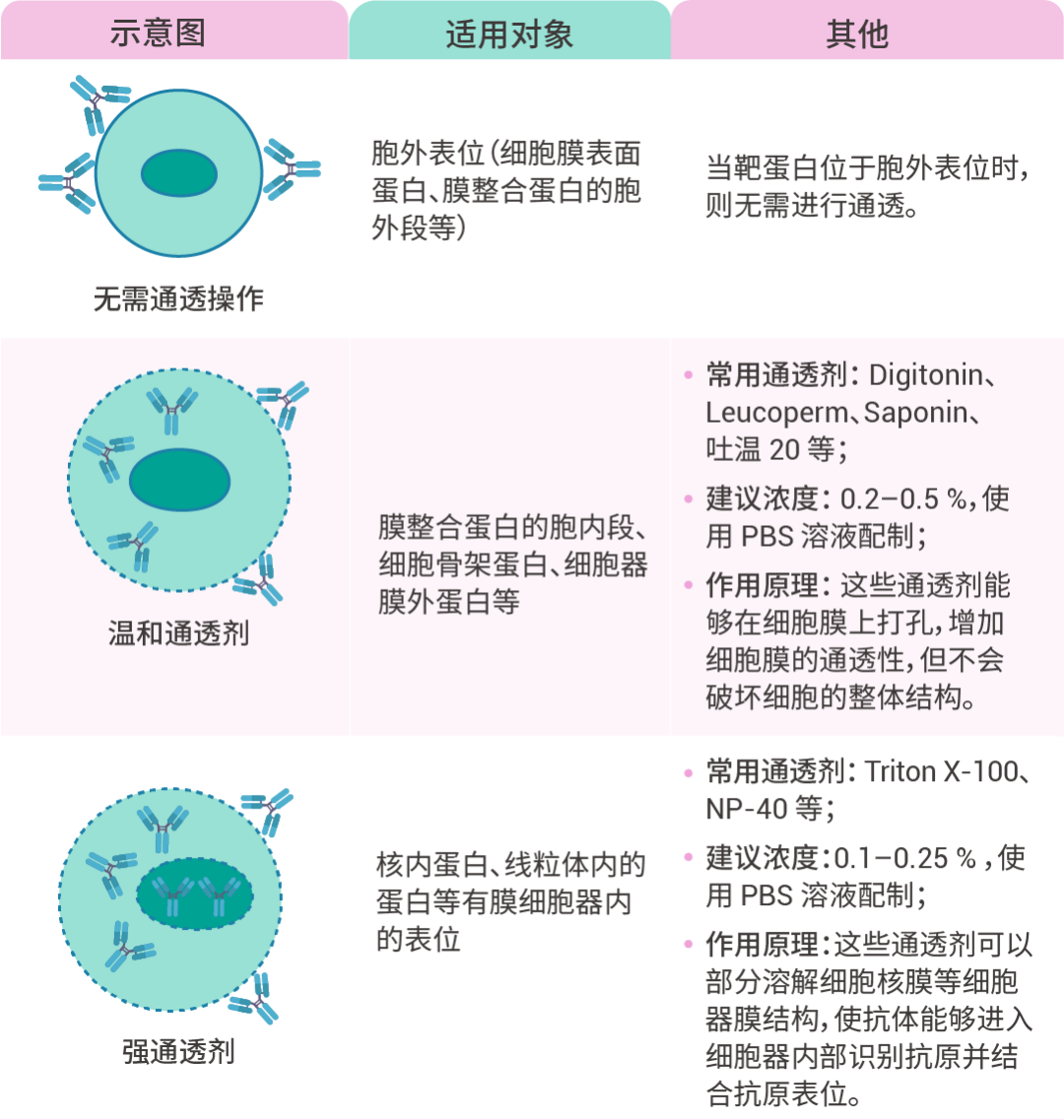
 分不清 一文 Get 全流程! (建议收藏)/11_3abicFIqbNlng04VV823N4D5F8zkVA.png)
步骤
1. 通透:加入 0.1–0.25% Triton X-100 (PBS 配制),覆盖细胞,室温下通透 5-10 min;
2. 洗涤:使用 PBS 缓冲液清洗 3 次,以去除残留通透液。
Tips:
① 通透剂的浓度和孵育时间应针对所用样品进行优化。
第四步:封闭
封闭液中的成分能够与细胞表面的非特异性位点结合,从而阻止抗体与这些位点的非特异性结合。
目的
根据实验设计,准备状态良好的细胞样品。细胞培养是实验的基础,细胞状态直接影响实验结果。
封闭液的选择
可以选择与二抗相同来源的血清或者 BSA 等,例如,若二抗为山羊抗小鼠,应选择山羊血清作为封闭剂。
步骤
使用 2-10% 的 BSA/山羊血清,室温或 37℃ 封闭 1 h。
Tips:
① 封闭溶液不应含有一抗的宿主动物血清,因为这可能会导致高背景。
第五步:抗体孵育
目的
使抗体充分与目的蛋白抗原结合,决定了荧光信号的位置和特异性,进而影响实验结果的准确性和可靠性。
注意:该步骤可选择 (i) 直接检测,一抗直接与荧光基团偶联。(ii) 间接检测,使用合适的荧光标记二抗检测一抗。这两种方法各有优点和缺点,其中,间接检测是最常用的检测方法。
抗体的选择
- 单染:一抗要选择任一宿主来源的抗体,二抗选择对应的抗一抗宿主的抗体。例如,一抗是小鼠来源,二抗要选择抗小鼠的抗体 (如山羊抗小鼠,驴抗小鼠等)。
- 双染/多染:在进行多个荧光标记实验时,一抗要选择不同宿主来源的抗体,二抗选择对应的抗一抗宿主的抗体。同时要注意选择具有高区分度的荧光二抗,避免荧光重叠。例如,在进行三色荧光标记时,一般选用绿色、蓝色和红色这三种荧光基团,以确保每个信号都能被清晰地区分出来。
步骤
基本步骤:
(以间接检测为例):
1. 一抗孵育:根据研目标抗原和样品特性选择符合要求的一抗,并按照说明书要求稀释一抗,加入到样品中并在 4℃ 条件下孵育过夜 (12 ~ 16 h)。
2. 洗涤:回收一抗工作液,用 TBST/PBST 摇床缓慢清洗 3 次,每次 5~10 min,以去除未结合的抗体。洗涤次数和时间可根据实验条件调整。
3. 二抗孵育:根据一抗的种类及样品特性 (二抗携带的荧光需要与样品自带荧光不冲突) 选择合适的荧光标记的二抗,在室温下避光孵育 1 h。稀释和使用方法应遵循说明书。
4. 洗涤:去除/回收二抗工作液,用 TBST/PBST 摇床缓慢清洗 3 次,每次 5 ~ 10 min,以去除未结合的抗体。洗涤次数和时间可根据实验条件调整。
Tips:
① 孵育荧光二抗之后,一定要注意避光保存!
② 确定合适的二抗工作浓度浓度,避免无信号或背景过高现象的发生;
③ 注意湿盒的保湿效果,避免样品的干燥;
④ 洗涤时转速要温和,防止细胞脱片。
第六步:复染
目的
使用染色剂对细胞核进行染色,直观地区分细胞核和其他细胞及抗原结构的位置,便于观察和解读实验结果。
步骤
在清洗完毕的细胞中滴加 DAPI,室温避光静置约 30 s。
第七步:封片
目的
保护已经染色的样本,防止其受到外界环境的损害。同时,封片还有助于保存实验结果,便于后续的分析和比较。
步骤
1. 封片:向载玻片上加入一滴封片剂,将盖玻片缓慢扣在载玻片上,细胞所在面靠近载玻片,用吸水纸吸除多余封片剂。
2. 观察:轻轻用指甲油密封盖玻片四周,避免样品在显微镜下移动。指甲油干透后,直接观察或 4℃ 下避光保存。
Tips:
① 避免气泡:在封片过程中,需要避免产生气泡。气泡会干扰显微镜下的观察,影响实验结果的准确性。因此,在滴加封片液时,需要缓慢而均匀地滴加,并用镊子轻轻调整盖玻片的位置,以确保没有气泡产生。
② 选择合适的封片剂:封片剂的选择也很重要。常用的封片剂包括缓冲甘油、抗荧光淬灭封片液等。在选择封片剂时,需要根据实验的具体需求和标本的特性进行选择。
③ 保持避光和湿度:封片后,需要将标本放置在避光和湿度适宜的环境中保存。这可以有效地防止荧光信号的淬灭和标本的干燥,确保实验结果的稳定性和准确性。
④ 细胞样品在封片剂处理后,理论上可以在 -20℃/4℃ 冰箱保存 1 周。然而,为了成像清晰和高荧光强度,建议尽快进行成像分析。
第八步:观察
成像及分析:在显微镜下观察并采集图像,并对结果进行实验分析。
让我们再来看看科研人的期刊文献中的免疫荧光 (IF) 成果图吧!
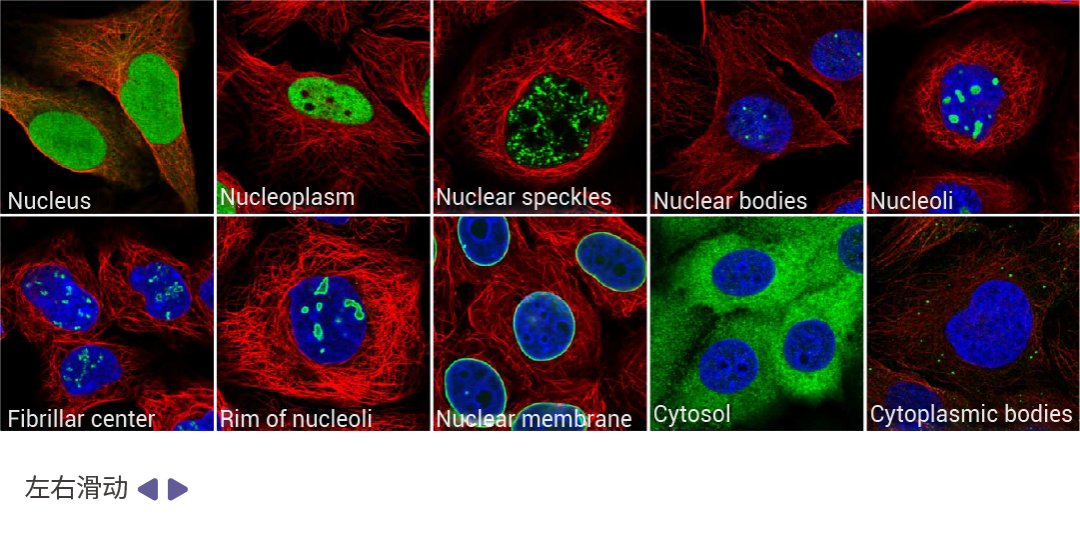
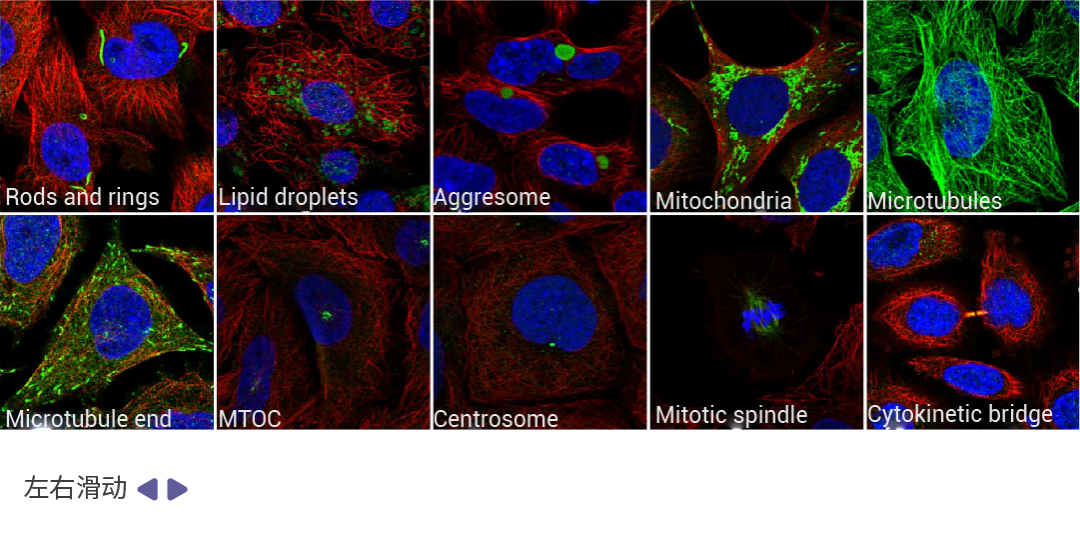
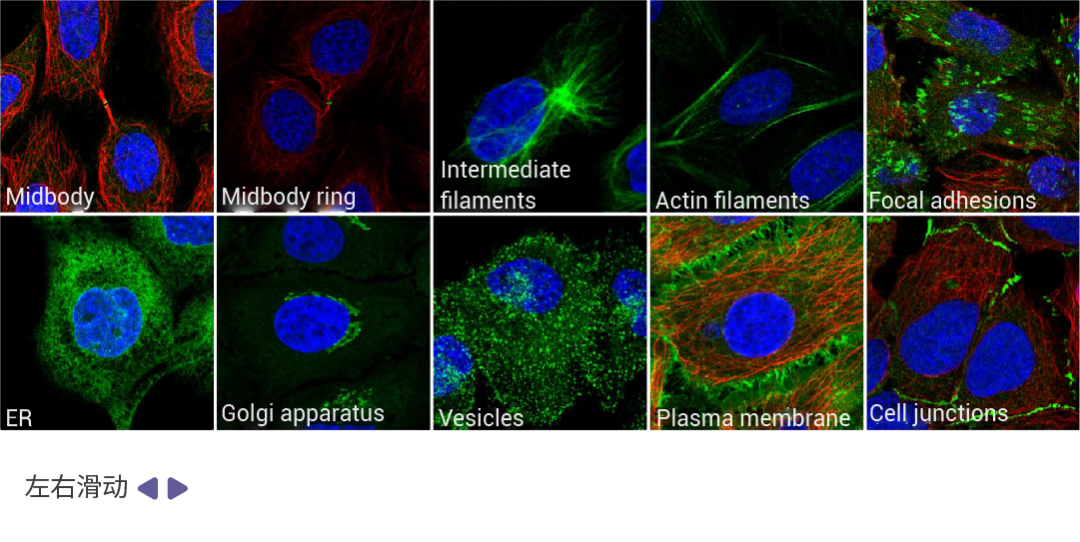
图 5. 亚细胞结构免疫荧光图[1]。
当然,如果你没有使用与抗体偶联的荧光染料,那么你的图片是这样的!
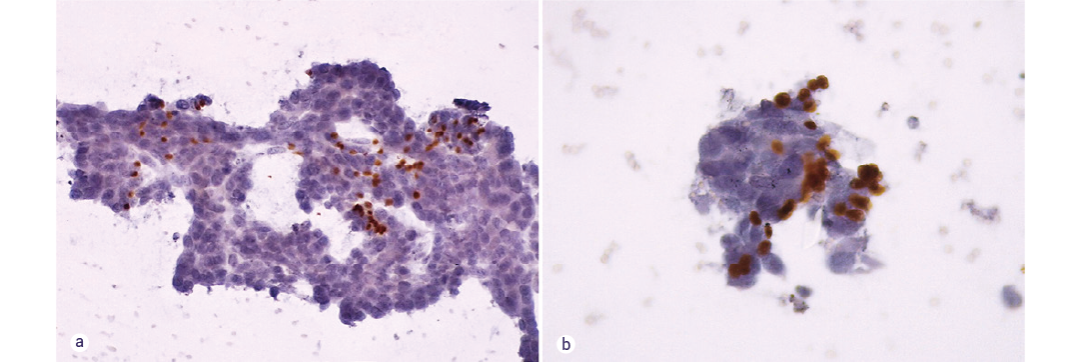 图 6. 肿瘤标志物 P63 的 ICC 检测。
图 6. 肿瘤标志物 P63 的 ICC 检测。在 LBC 玻片上进行 p63 染色。可见核染色,突出肌上皮细胞。可以看到 (a) 中一片较大的细胞,(b) 中一小簇细胞。两者均显示中度细胞异形性,且染色细胞数不足 25%。如果这是标本的主要形态,则足以支持恶性肿瘤的诊断。
好啦,朋友们,到这里细胞免疫荧光实验就结束啦!怎么样?有没有跃跃欲试的小念头?如有购买需求或实验疑惑都可 Call 小 M 喔~
| 产品推荐 |
| Goat Anti-Mouse IgG H&L (FITC) (HY-P80950) 该抗体偶联了荧光素 FITC、山羊来源、抗小鼠 IgG 抗体。可用于小鼠背景下 ICC/IF、FC 实验。 |
| Goat Anti-Rabbit IgG H&L (FITC) (HY-P80951) 该抗体偶联了荧光素 FITC、山羊来源、抗兔源 IgG 抗体。可用于兔子背景下 ICC/IF、FC 实验。 |
| TRITC-conjugated AffiniPure Goat Anti-Mouse IgG H&L (HY-P81008) 该抗体偶联了 TRITC 标记的、山羊来源的抗小鼠 IgG 抗体。可用于小鼠背景下 ICC/IF, FC 实验。 |
| TRITC-conjugated AffiniPure Goat Anti-Rabbit IgG H&L (HY-P81007) 该抗体偶联了 TRITC 标记的、山羊来源的抗小鼠 IgG 抗体。可用于小鼠背景下 ICC/IF, FC 实验。 |
| Alexa Fluor® 647-conjugated AffiniPure Goat Anti-Mouse IgG H&L (HY-P81013) 该抗体偶联了红色荧光团 Alexa Fluor® 647 标记的、山羊来源的抗小鼠 IgG 抗体。可用于小鼠背景下 IF-Cell, IF-Tissue 实验。 |
| Alexa Fluor® 647-conjugated AffiniPure Goat Anti-Rabbit IgG H&L (HY-P80952) 该抗体偶联了红色荧光团 Alexa Fluor® 647、山羊来源、抗兔源 IgG 抗体。可用于兔子背景下 ICC/IF、IHC-F、FC、ELISA 实验。 |
| Alexa Fluor® 488-conjugated AffiniPure Goat Anti-Mouse IgG H&L (HY-P8005) 该抗体偶联了绿色荧光团 Alexa Fluor® 488、山羊来源的抗小鼠 IgG 抗体。可用于小鼠背景下 ICC/IF、IHC-F、FC、ELISA 实验。 |
| Alexa Fluor® 488-conjugated AffiniPure Goat Anti-Rabbit IgG H&L (HY-P8002) 该抗体偶联了绿色荧光团 Alexa Fluor® 488、山羊来源的抗兔 IgG 抗体。可用于兔子背景下 ICC/IF、IHC-F、IHC-P、FC、ELISA 实验。 |

[1] Park G, et al. Brief guide to immunostaining. Mol Cells. 2025 Jan;48(1):100157. doi: 10.1016/j.mocell.2024.100157. Epub 2024 Nov 19.
[2] Srebotnik Kirbis I. State of the Art and Science of Immunocytochemistry. Acta Cytol. 2025;69(1):51-59.
[3] Jain D, et al. Diagnostic and Predictive Immunocytochemistry in Lung Cancer. Acta Cytol. 2025;69(1):69-76.
[4] Pinto D, Schmitt FC. Immunohistochemistry Applied to Breast Cytological Material. Pathobiology. 2022;89(5):343-358.



