IF 24.9文章:南方医院方媛研究团队发现SPHK1调控结直肠癌肝转移机制
2025-08-25 来源:本站 点击次数:35结直肠癌肝转移(CRLM)是结直肠癌(CRC)最常见的转移类型,约50%的CRC患者会发生CRLM,多数患者无法手术,5年生存率仅14%。CRLM的特征是具有免疫抑制性微环境,且对免疫治疗的反应不佳。值得注意的是,肿瘤相关巨噬细胞(TAMs)在调节免疫反应中发挥关键作用,并且在CRLM中表现出显著的异质性。鞘氨醇激酶1(SPHK1)作为一种关键激酶,在维持神经酰胺和鞘氨醇-1-磷酸(S1P)水平的平衡中起重要作用。然而,在CRLM过程中,TAMs中的SPHK1在肿瘤免疫逃逸中所发挥的作用仍不明确。
近期,南方医科大学南方医院放疗科方媛团队在Cancer Communications (IF 24.9)发表题为“Targeting SPHK1 in macrophages remodels the tumor microenvironment and enhances anti-PD-1 immunotherapy efficacy in colorectal cancer liver metastasis”的文章。研究结果强调,TAMs中的SPHK1通过促进CD8+T细胞功能异常和形成免疫抑制性微环境,在CRLM的进展中发挥作用,将SPHK1阻断与抗PD-1疗法相结合,可能是CRLM患者一种有前景的治疗方案。

· 维真助力 - AAV、LV及质粒 ·
基因信息:鞘氨醇激酶1(Sphk1)
病毒产品:AAV-Sphk1
病毒用量:2 µL/mouse(5×10^10 vg/mL)
注射方式:尾静脉注射
病毒产品:
LV-Sphk1(mouse)
LV-shSPHK1(human)
LV-shSphk1(mouse)
LV-shAdam17(mouse)
病毒滴度:1×10^8 TU/mL
感染细胞:THP-1细胞;MC38细胞
MOI:10
基因信息:鞘氨醇激酶1(Sphk1)
病毒产品:AAV-Sphk1
病毒用量:2 µL/mouse(5×10^10 vg/mL)
注射方式:尾静脉注射
病毒产品:
LV-Sphk1(mouse)
LV-shSPHK1(human)
LV-shSphk1(mouse)
LV-shAdam17(mouse)
病毒滴度:1×10^8 TU/mL
感染细胞:THP-1细胞;MC38细胞
MOI:10
研究方法与结果
1、SPHK1通过调控肿瘤微环境发挥促肿瘤作用
通过对公共RNA-seq和scRNA-seq等数据的分析,研究团队发现SPHK1在来自CRLM的TAM中高度表达,并且与CRC患者的预后不良密切相关。通过药物抑制或基因敲除TAMs中的SPHK1,可减少CRLM模型中小鼠肝转移瘤的数量和直径,延长其生存期;同时,SPHK1的抑制或敲除会降低肝肿瘤中S1P的水平,表明靶向TAMs中的SPHK1能有效抑制CRLM进展。进一步分析发现TAMs中SPHK1缺失后,CRLM模型小鼠的TME免疫抑制状态得到逆转,具体表现为肝转移肿瘤中TAMs比例减少,CD4+T细胞、CD8+T细胞及常规树突状细胞比例增加;CD8+T细胞的耗竭标志物(如PD-1、LAG3)表达降低,效应分子(如IFN-γ)及激活标志物(如CD44、CD25)表达升高。随后,研究团队将慢病毒载体转导THP1细胞,建立SPHK1稳定敲低的细胞系,体外共培养实验也证实,SPHK1缺失的巨噬细胞可减少CD8+T细胞耗竭并增强其抗肿瘤活性,且该效应依赖于TAMs和CD8+T细胞的存在。
1、SPHK1通过调控肿瘤微环境发挥促肿瘤作用
通过对公共RNA-seq和scRNA-seq等数据的分析,研究团队发现SPHK1在来自CRLM的TAM中高度表达,并且与CRC患者的预后不良密切相关。通过药物抑制或基因敲除TAMs中的SPHK1,可减少CRLM模型中小鼠肝转移瘤的数量和直径,延长其生存期;同时,SPHK1的抑制或敲除会降低肝肿瘤中S1P的水平,表明靶向TAMs中的SPHK1能有效抑制CRLM进展。进一步分析发现TAMs中SPHK1缺失后,CRLM模型小鼠的TME免疫抑制状态得到逆转,具体表现为肝转移肿瘤中TAMs比例减少,CD4+T细胞、CD8+T细胞及常规树突状细胞比例增加;CD8+T细胞的耗竭标志物(如PD-1、LAG3)表达降低,效应分子(如IFN-γ)及激活标志物(如CD44、CD25)表达升高。随后,研究团队将慢病毒载体转导THP1细胞,建立SPHK1稳定敲低的细胞系,体外共培养实验也证实,SPHK1缺失的巨噬细胞可减少CD8+T细胞耗竭并增强其抗肿瘤活性,且该效应依赖于TAMs和CD8+T细胞的存在。
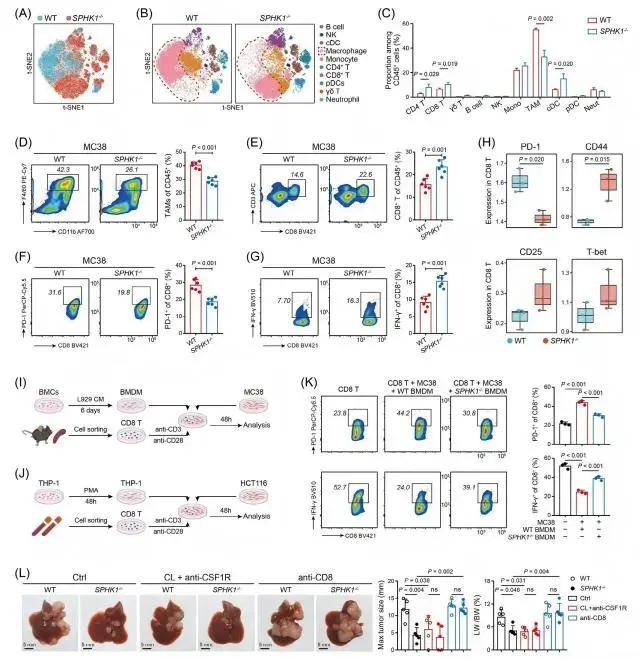
TAMs中SPHK1缺陷逆转CRLM的免疫抑制性TME
2、SPHK1-S1P轴通过NLRP3炎性体促进TAMs分泌IL-1β
RNA-seq数据分析显示SPHK1-S1P轴增强IL-1β和NLRP3的mRNA表达。通过GSEA确定了SPHK1-/-TAM和SPHK1敲低CRC中NLRP3炎性体通路的显著下调。进一步探索发现S1P可上调BMDM和THP-1来源TAMs中NLRP3炎症小体相关蛋白的表达,而敲低SPHK1则会减少这些蛋白的表达。此外,CRC细胞与活化的CD8+T细胞共培养可通过IFN-γ促进TAMs中SPHK1磷酸化以及IL-1β和NLRP3的表达。提示TAMs中CD8+T细胞驱动SPHK1-NLRP3-IL-1β轴,这一过程可能参与CRLM的适应性免疫逃避。随后利用AAV-SPHK1将SPHK1导入TAMs,导致小鼠肝转移灶增加,而IL-1β拮抗剂可逆转这一效果。这些数据表明TAM中的SPHK1通过IL-1β介导的免疫抑制促进肝转移进展。进一步的机制探索证实S1P-S1PR2轴通过NF-κB和HIF-1α信号通路激活NLRP3炎性体。
RNA-seq数据分析显示SPHK1-S1P轴增强IL-1β和NLRP3的mRNA表达。通过GSEA确定了SPHK1-/-TAM和SPHK1敲低CRC中NLRP3炎性体通路的显著下调。进一步探索发现S1P可上调BMDM和THP-1来源TAMs中NLRP3炎症小体相关蛋白的表达,而敲低SPHK1则会减少这些蛋白的表达。此外,CRC细胞与活化的CD8+T细胞共培养可通过IFN-γ促进TAMs中SPHK1磷酸化以及IL-1β和NLRP3的表达。提示TAMs中CD8+T细胞驱动SPHK1-NLRP3-IL-1β轴,这一过程可能参与CRLM的适应性免疫逃避。随后利用AAV-SPHK1将SPHK1导入TAMs,导致小鼠肝转移灶增加,而IL-1β拮抗剂可逆转这一效果。这些数据表明TAM中的SPHK1通过IL-1β介导的免疫抑制促进肝转移进展。进一步的机制探索证实S1P-S1PR2轴通过NF-κB和HIF-1α信号通路激活NLRP3炎性体。
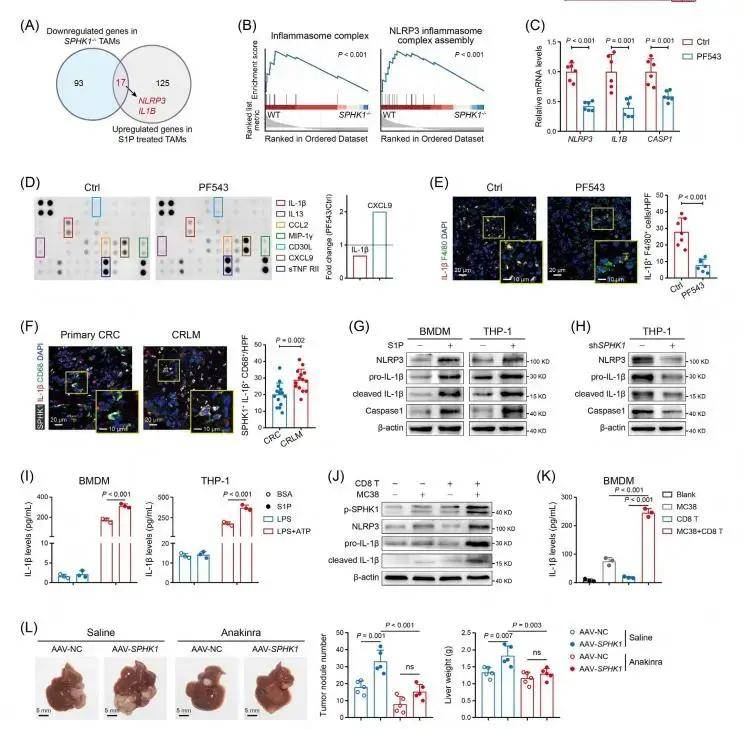
SPHK1-S1P轴通过NLRP3炎性体促进TAMs中IL-1β的分泌
3、rIL-1β处理的CRC细胞促进TAM募集和CD8+T细胞功能障碍
细胞因子阵列显示,SPHK1敲低的THP-1细胞与HCT116细胞、CD8+T细胞共培养时,上清中CCL2水平显著降低,而IL-2水平升高;TAMs中CCL2表达不受SPHK1调控或S1P预处理影响,但与SPHK1敲除/敲低巨噬细胞共培养的 CRC细胞中,单核细胞趋化因子(CCL2、CCL7、CCL8、CXCL12)水平显著降低。重组IL-1β(rIL-1β)可显著上调CRC细胞中单核细胞趋化因子的表达;Transwell实验显示,SPHK1缺陷显著抑制与CRC细胞共培养时的巨噬细胞迁移,且SPHK1-/-肝肿瘤中CCL2表达较低。这些数据表明,表达SPHK1的TAM促进IL-1β分泌,然后与CRC细胞相互作用,以招募更多的TAM进入TME。蛋白质组学分析发现,rIL-1β处理的MC38细胞分泌组中ADAM17及多种单核细胞趋化因子富集,ELISA证实rIL-1β可诱导ADAM17分泌,且IL-1β与ADAM17 表达呈正相关。进一步的分析表明SPHK1+TAMs通过IL-1β诱导CRC细胞释放ADAM17,从而限制CD8+T细胞的运输和抗肿瘤活性。联合治疗效果评估发现,SPHK1靶向治疗可增强抗PD-1免疫治疗的疗效,联合治疗能显著抑制CRLM,减少肝转移灶数量,延长小鼠生存期,且与放疗联合时效果更优,同时可降低放疗导致的肝损伤。
细胞因子阵列显示,SPHK1敲低的THP-1细胞与HCT116细胞、CD8+T细胞共培养时,上清中CCL2水平显著降低,而IL-2水平升高;TAMs中CCL2表达不受SPHK1调控或S1P预处理影响,但与SPHK1敲除/敲低巨噬细胞共培养的 CRC细胞中,单核细胞趋化因子(CCL2、CCL7、CCL8、CXCL12)水平显著降低。重组IL-1β(rIL-1β)可显著上调CRC细胞中单核细胞趋化因子的表达;Transwell实验显示,SPHK1缺陷显著抑制与CRC细胞共培养时的巨噬细胞迁移,且SPHK1-/-肝肿瘤中CCL2表达较低。这些数据表明,表达SPHK1的TAM促进IL-1β分泌,然后与CRC细胞相互作用,以招募更多的TAM进入TME。蛋白质组学分析发现,rIL-1β处理的MC38细胞分泌组中ADAM17及多种单核细胞趋化因子富集,ELISA证实rIL-1β可诱导ADAM17分泌,且IL-1β与ADAM17 表达呈正相关。进一步的分析表明SPHK1+TAMs通过IL-1β诱导CRC细胞释放ADAM17,从而限制CD8+T细胞的运输和抗肿瘤活性。联合治疗效果评估发现,SPHK1靶向治疗可增强抗PD-1免疫治疗的疗效,联合治疗能显著抑制CRLM,减少肝转移灶数量,延长小鼠生存期,且与放疗联合时效果更优,同时可降低放疗导致的肝损伤。
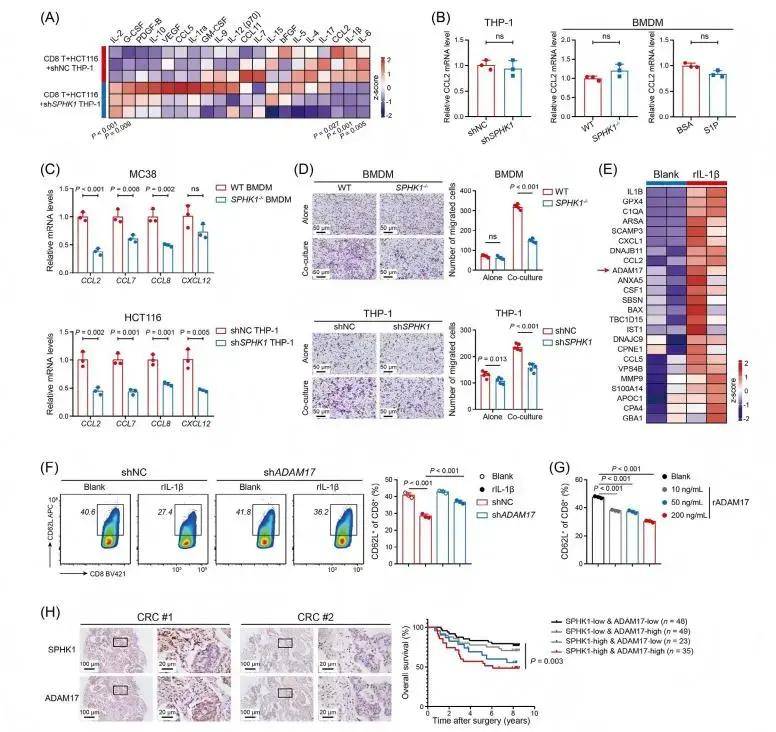
rIL-1β处理的CRC细胞促进TAM募集和CD8+T细胞功能障碍
总结
本研究揭示SPHK1在TAMs中通过S1P-NLRP3-IL-1β 通路促进CRLM的肿瘤免疫微环境的形成,导致CD8+T细胞功能障碍和免疫治疗耐药。强调联合靶向SPHK1与抗PD-1治疗是CRLM的潜在有效治疗策略。返
本研究揭示SPHK1在TAMs中通过S1P-NLRP3-IL-1β 通路促进CRLM的肿瘤免疫微环境的形成,导致CD8+T细胞功能障碍和免疫治疗耐药。强调联合靶向SPHK1与抗PD-1治疗是CRLM的潜在有效治疗策略。返
相关文章
更多 >

