Portal机械挤压穿孔技术在造血干细胞工程化中的应用优势
2025-09-05 来源:本站 点击次数:608
在基因治疗领域,尤其是针对血红蛋白病等罕见遗传病的治疗中,基于基因编辑的自体造血干细胞(HSCs)移植展现出巨大的治愈潜力。然而,HSCs 作为一种极为敏感且脆弱的细胞类型,其高效改造仍面临多重挑战:现有递送技术毒性高、可递送分子类型受限、难以实现规模化应用。
传统电穿孔技术(Electroporation, EP)虽应用广泛,却容易造成明显的细胞损伤,导致活力下降、基因表达异常,并影响其长期增殖与分化能力,严重限制了临床转化。美国Portal公司基于机械挤压穿孔技术开发的创新递送平台,正为这一领域带来全新解决方案。
什么是Portal机械挤压穿孔技术?
Portal创新递送平台采用基于物理原理的机械挤压穿孔技术,其工作流程高效且温和:
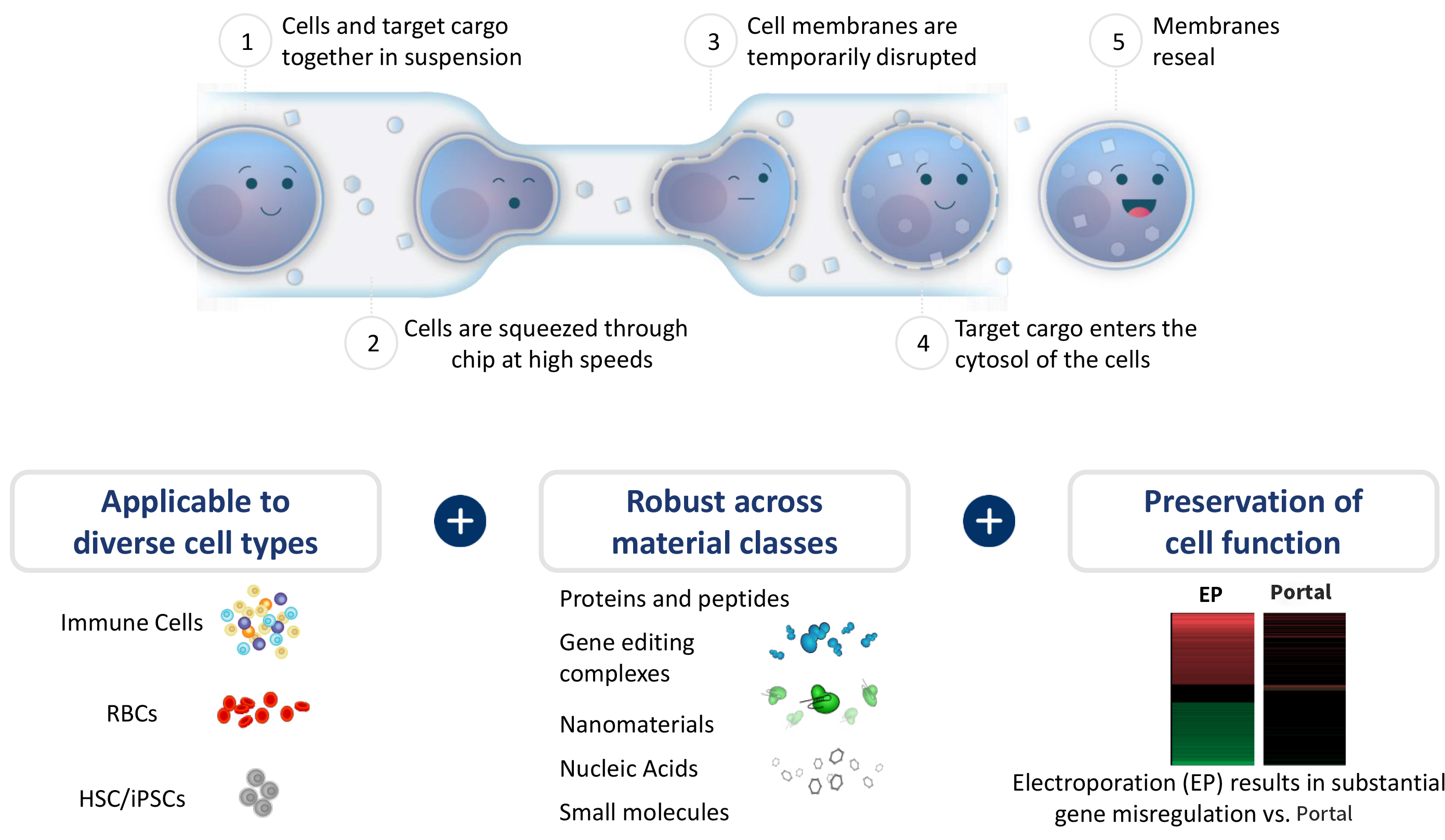
为什么Portal更适合HSCs工程化?
1. 高效递送多种mRNA与RNP,支持体内外表达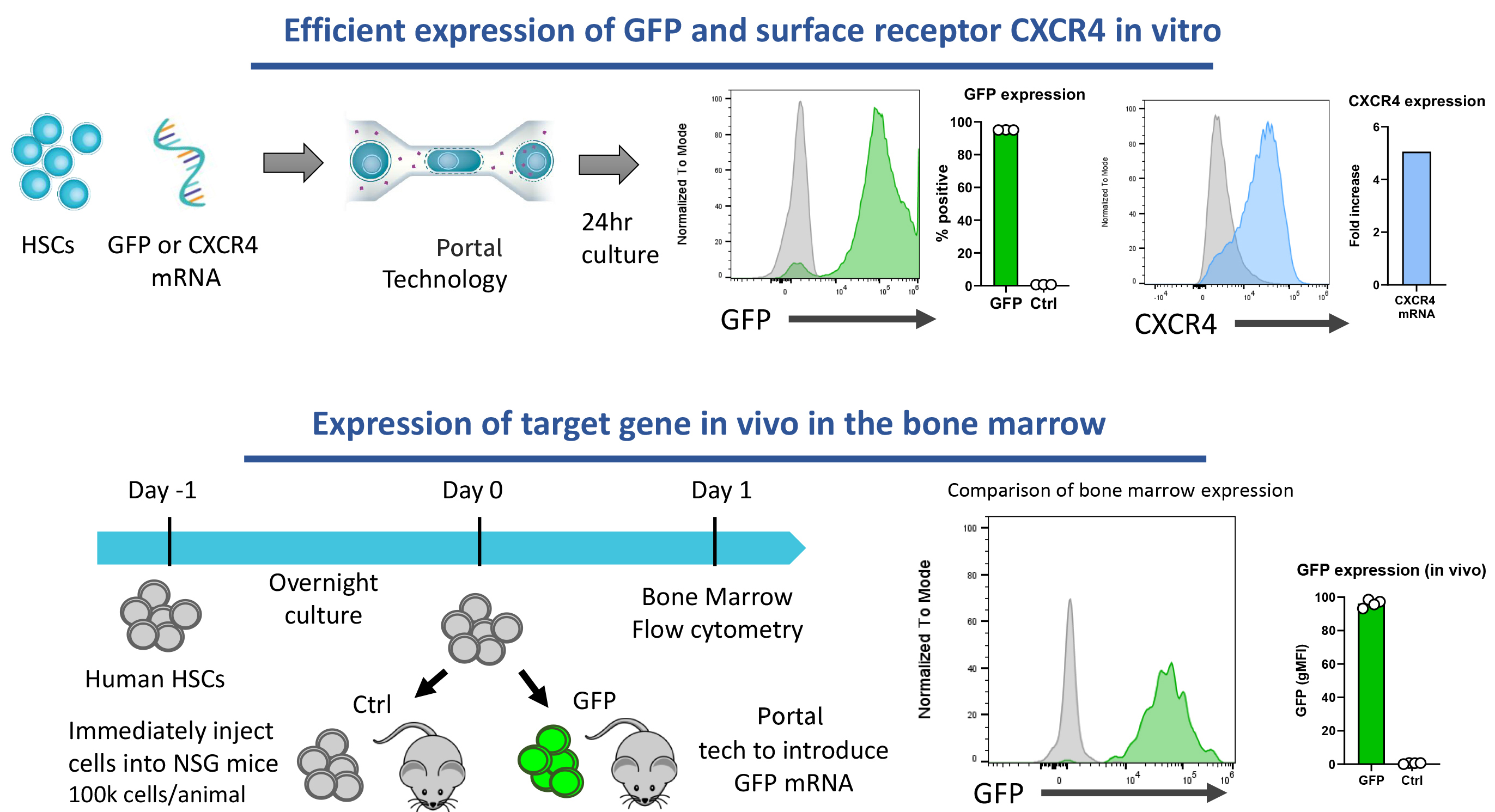
2. 更大限度保持细胞表型与功能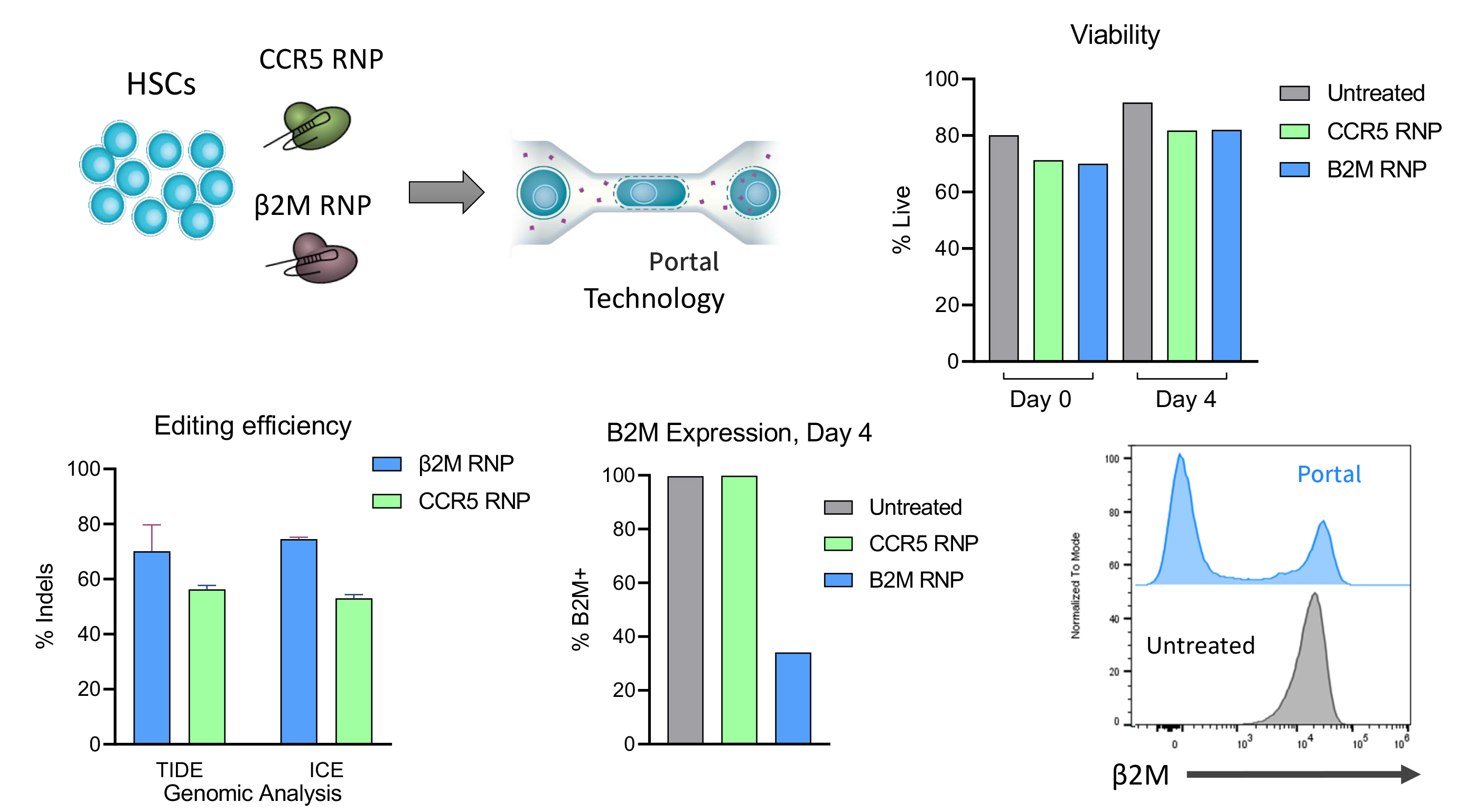
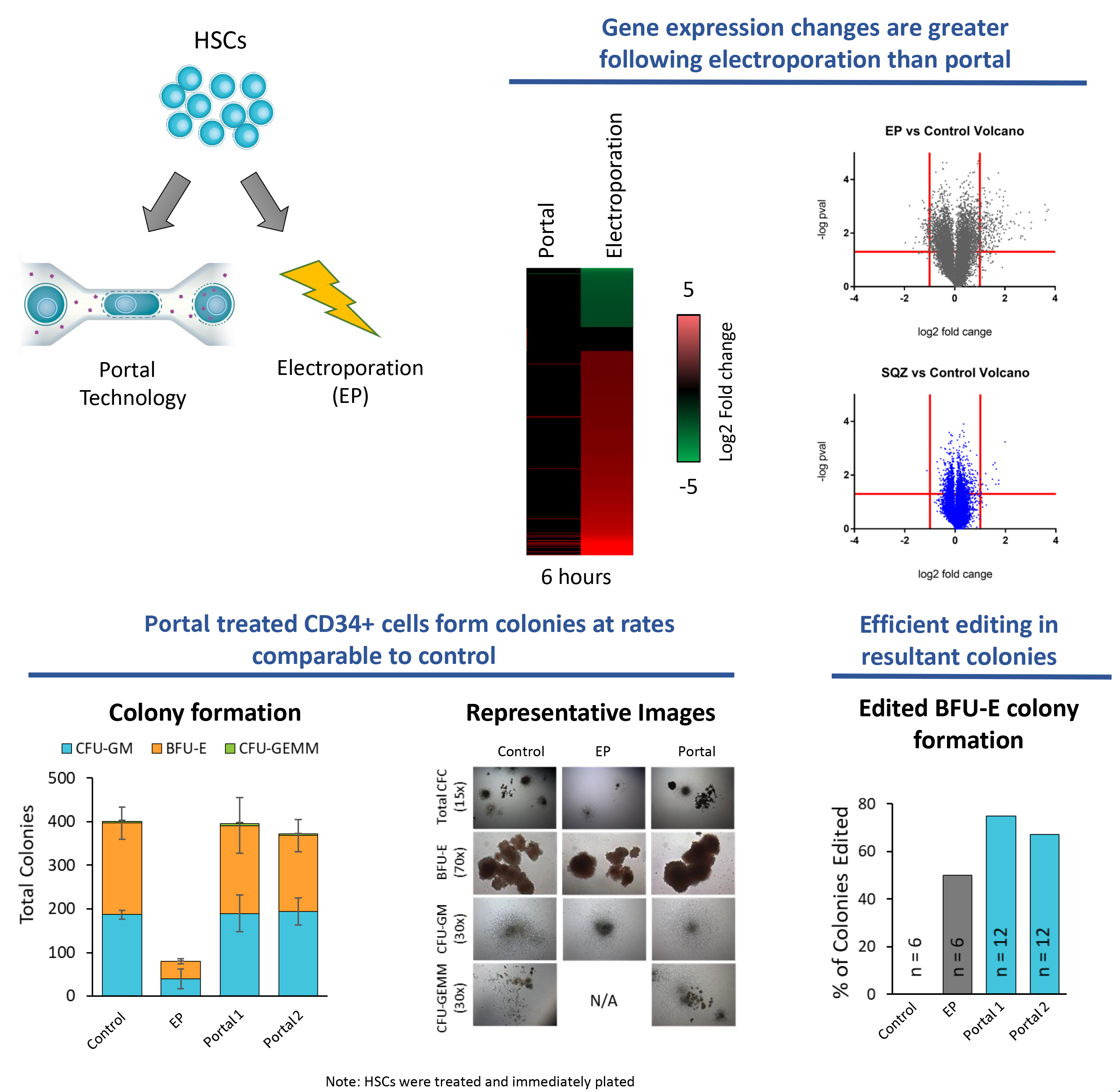
3. 处理后细胞可立即使用,大幅缩短制备周期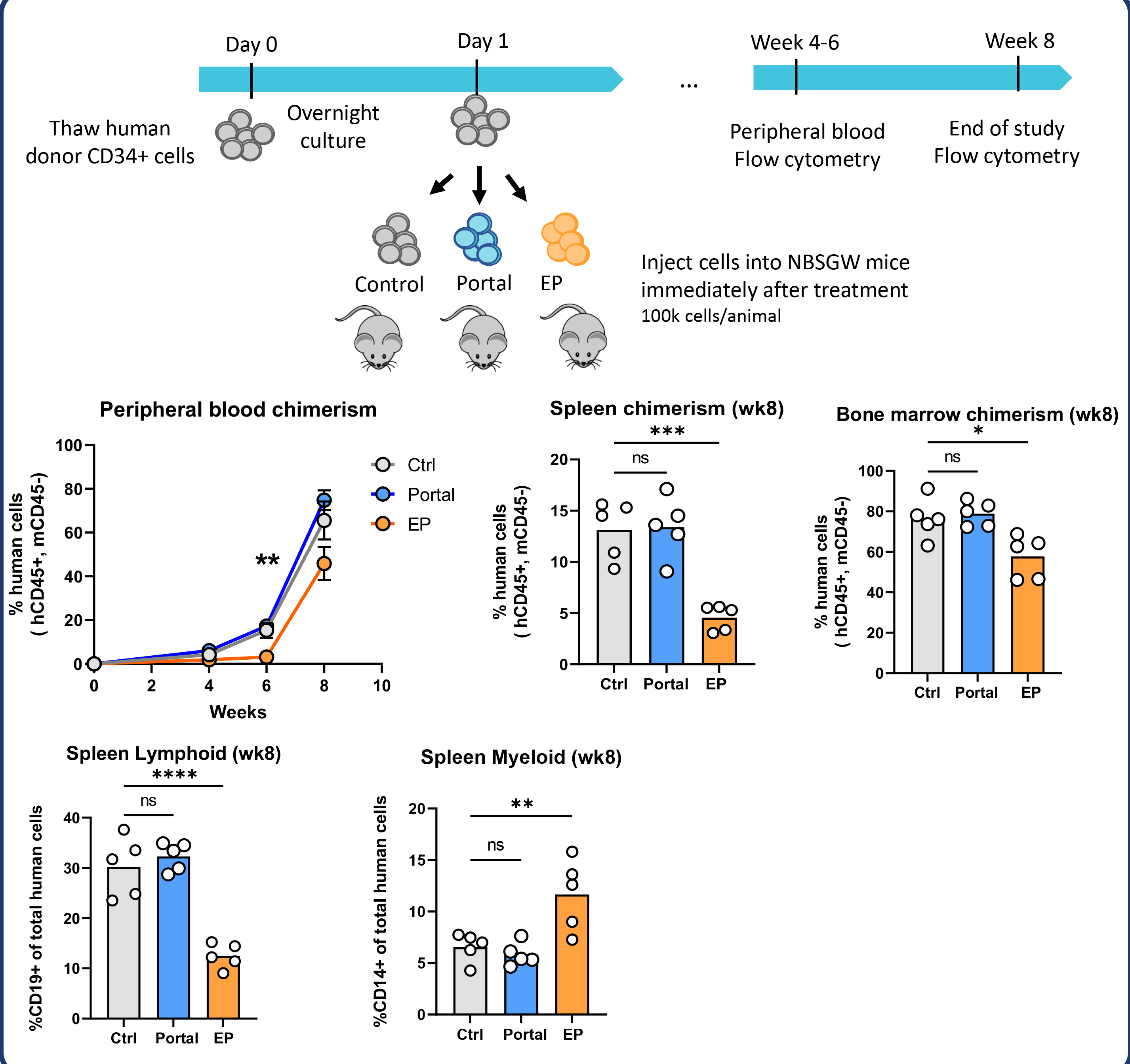
Portal是人类原代CD34+细胞进行mRNA转染或基因编辑的理想技术方案,不仅可实现高效细胞改造,还可快速投入临床应用,助力建立更贴近患者的HSC治疗新范式。
产品矩阵:覆盖研发至临床的全链条需求
1. Gateway™ :科研级细胞递送系统

专为细胞基因治疗研发设计,支持CRISPR RNP、mRNA、蛋白质等多样化递送。适用于免疫细胞、干细胞等难转染细胞,显著提升基因编辑效率。
2. Galaxy™ :高通量细胞递送系统

可与自动化平台无缝集成,满足大规模化合物筛选需求,助力药企快速筛选有效候选药物,降低研发成本与时间。
3. GMP级模块化耗材(MilliBooster等)

支持临床级细胞治疗生产,兼容第三方GMP设备,推动产业化进程。
应用前景:推动更接近临床的HSC治疗新模式
Portal创新递送平台不仅适用于mRNA和RNP,还可高效递送蛋白质、小分子、纳米材料等多种生物材料,具备广泛的应用潜力。该技术有望实现:
了解更多信息,欢迎关注我们,获取细胞工程与基因治疗领域的前沿进展。
传统电穿孔技术(Electroporation, EP)虽应用广泛,却容易造成明显的细胞损伤,导致活力下降、基因表达异常,并影响其长期增殖与分化能力,严重限制了临床转化。美国Portal公司基于机械挤压穿孔技术开发的创新递送平台,正为这一领域带来全新解决方案。
什么是Portal机械挤压穿孔技术?
Portal创新递送平台采用基于物理原理的机械挤压穿孔技术,其工作流程高效且温和:

Portal机械挤压穿孔技术工作原理
- 混合:将细胞与目标载荷(如 mRNA、RNP等)共同悬浮于溶液中;
- 挤压:使细胞快速通过 Portal® 特殊设计的微流控芯片通道(孔径约为细胞直径的70%);
- 进入:细胞在物理挤压下发生瞬时形变,形成可自我修复的孔隙,周围目标分子顺势进入细胞质;
- 恢复:细胞膜迅速修复,细胞恢复完整状态。
为什么Portal更适合HSCs工程化?
1. 高效递送多种mRNA与RNP,支持体内外表达
- 超过90%的HSCs可高效表达转染的mRNA。

多种mRNA在体内外的高效递送和表达
2. 更大限度保持细胞表型与功能
- 经微阵列分析、CFC测定和NBSGW小鼠移植研究证实,Portal处理的CD34+细胞在行为上与未处理组高度一致;
- 相比之下,电穿孔易导致基因表达失调、集落形成下降、植入率降低及分化能力受损;
- 递送抗B2M和抗CCR5 RNPs时,CD34+细胞可实现高编辑率。

Portal对细胞存活率几乎没有影响

Portal对细胞表型和分化能力几乎没有影响
3. 处理后细胞可立即使用,大幅缩短制备周期
- 无需恢复培养,可直接用于移植,显著减少体外操作时间;
- 更符合临床“床旁即时使用”(point-of-care)需求。

治疗后立即高效输入Portal处理的造血干细胞
Portal是人类原代CD34+细胞进行mRNA转染或基因编辑的理想技术方案,不仅可实现高效细胞改造,还可快速投入临床应用,助力建立更贴近患者的HSC治疗新范式。
产品矩阵:覆盖研发至临床的全链条需求
1. Gateway™ :科研级细胞递送系统

专为细胞基因治疗研发设计,支持CRISPR RNP、mRNA、蛋白质等多样化递送。适用于免疫细胞、干细胞等难转染细胞,显著提升基因编辑效率。
2. Galaxy™ :高通量细胞递送系统

可与自动化平台无缝集成,满足大规模化合物筛选需求,助力药企快速筛选有效候选药物,降低研发成本与时间。
3. GMP级模块化耗材(MilliBooster等)

支持临床级细胞治疗生产,兼容第三方GMP设备,推动产业化进程。
应用前景:推动更接近临床的HSC治疗新模式
Portal创新递送平台不仅适用于mRNA和RNP,还可高效递送蛋白质、小分子、纳米材料等多种生物材料,具备广泛的应用潜力。该技术有望实现:
- 快速、规模化的细胞工程化;
- 体外停留时间更短,降低细胞应激;
- 更优的细胞存活率与功能维持,进一步提升治疗效果。
了解更多信息,欢迎关注我们,获取细胞工程与基因治疗领域的前沿进展。
相关文章
更多 >

