x细胞递送平台Gateway™系统的组成、原理及应用案例分享
2025-10-23 来源:本站 点击次数:695
由美国Portal公司开发的创新型递送平台Gateway™系统,基于先进的机械挤压穿孔技术,不仅在造血干细胞的工程化改造中表现出色,还能高效递送多种RNA类载荷(包括mRNA、siRNA、saRNA等)。该系统在原代免疫细胞及干细胞的多重递送中展现出低毒性、高存活率与广谱细胞兼容性的优势,大幅简化了细胞工程改造流程。
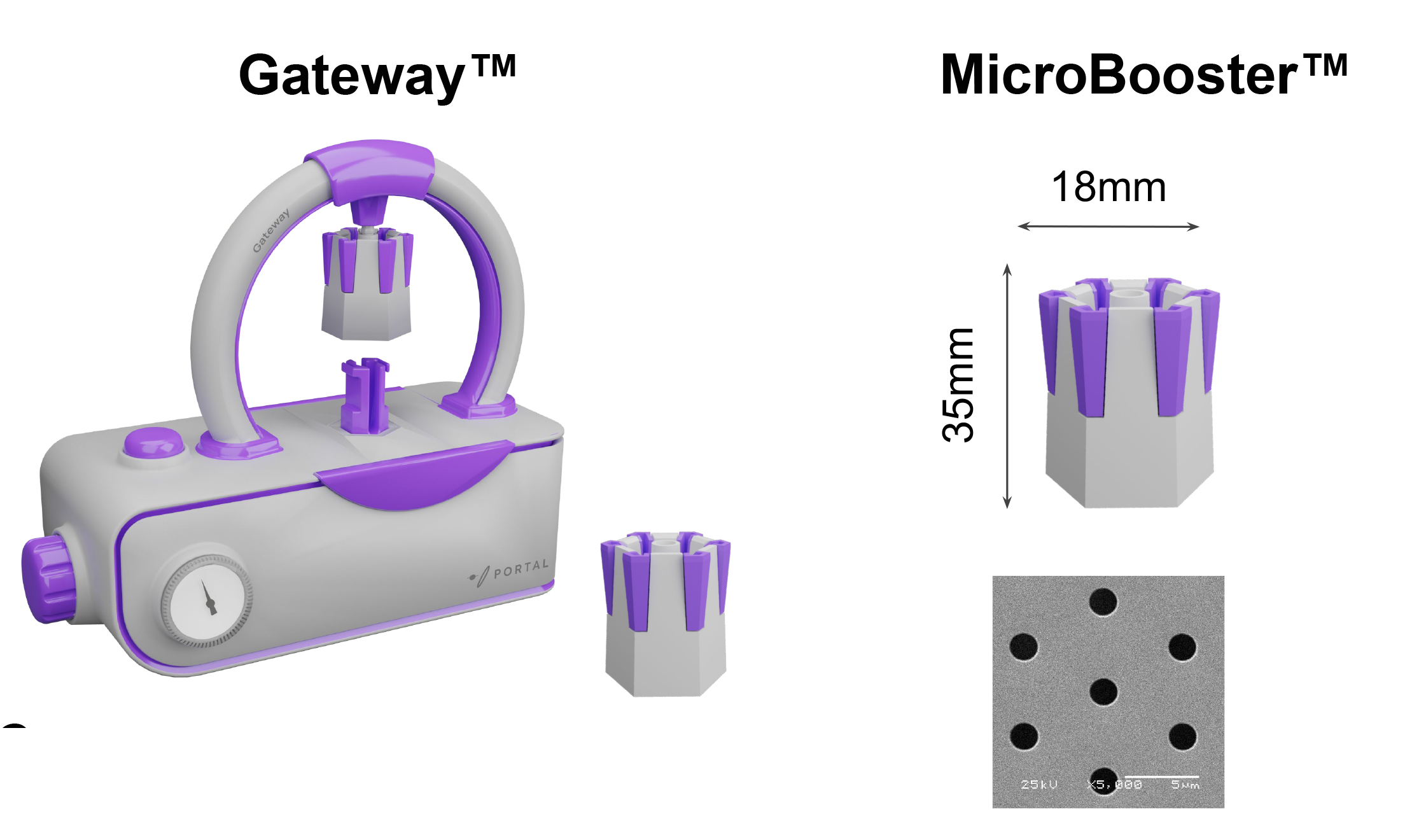
Gateway™:模块化设计实现精准高效递送
Gateway™系统由两部分组成:主机控制单元采用紧凑型台式设计,可精确控制输送参数,且能轻松置于生物安全柜内操作;MicroBooster™则是针对不同细胞类型优化设计的递送芯片,具备特定孔径结构,确保各类细胞均能实现更高效率的外源载荷处理。

混合:将细胞与目标载荷(如 mRNA、RNP等)共同悬浮于溶液中;
挤压:使细胞快速通过 Portal特殊设计的微流控芯片通道(孔径约为细胞直径的70%);
进入:细胞在物理挤压下发生瞬时形变,形成可自我修复的孔隙,周围目标分子顺势进入细胞质;
恢复:细胞膜迅速修复,细胞恢复完整状态。
整个过程快速、温和,无需化学试剂或病毒载体,也避免了电击对细胞造成的应激与损伤。
实验数据验证:高效递送与功能实现
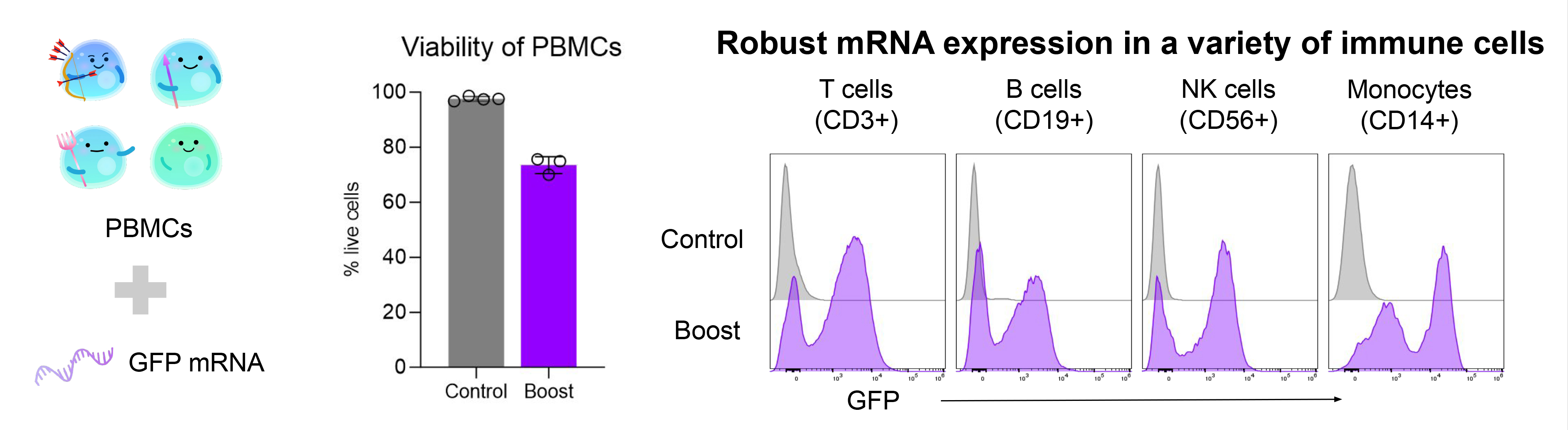
1. 高效递送mRNA至多种免疫细胞
使用Gateway™系统向人类外周血单个核细胞 (PBMCs)递送GFP mRNA 20小时后,流式细胞术检测显示细胞活性良好,且在T细胞、B细胞、NK细胞和单核细胞中均检测到广泛GFP表达。
2. 人类诱导多能干细胞(iPSCs)中mRNA的高效表达
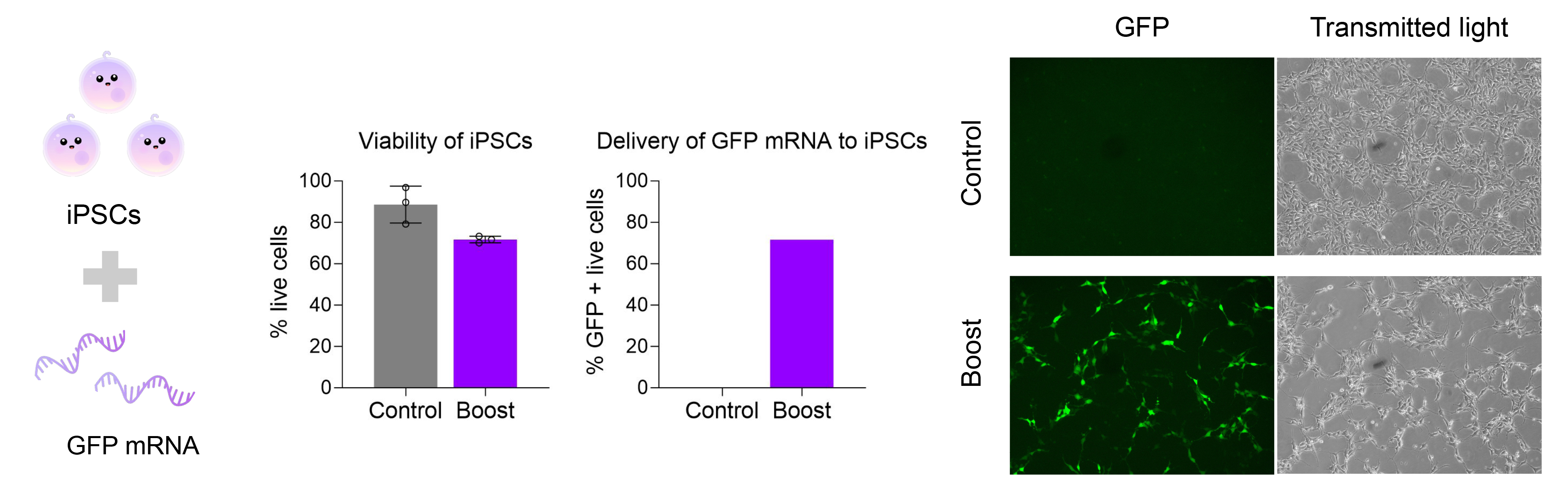
递送GFP mRNA至人iPSCs 20小时后,通过荧光显微镜与流式细胞术均观察到强GFP信号,细胞状态保持稳定。
3. CD34+细胞中的基因敲低
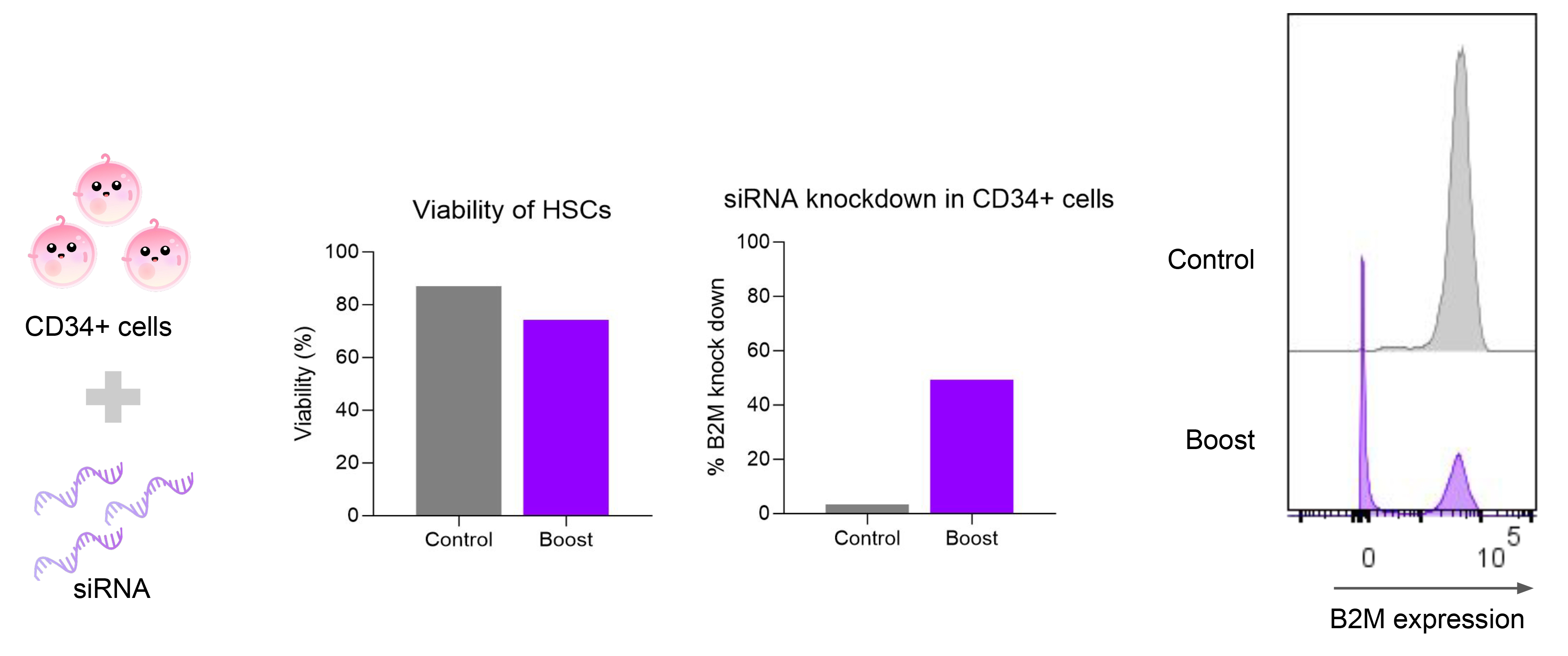
递送B2M siRNA至人类CD34+造血干细胞40小时后,流式细胞术显示B2M表达显著下降,同时细胞存活率维持较高水平。
4. 初始T细胞中的高效多重递送
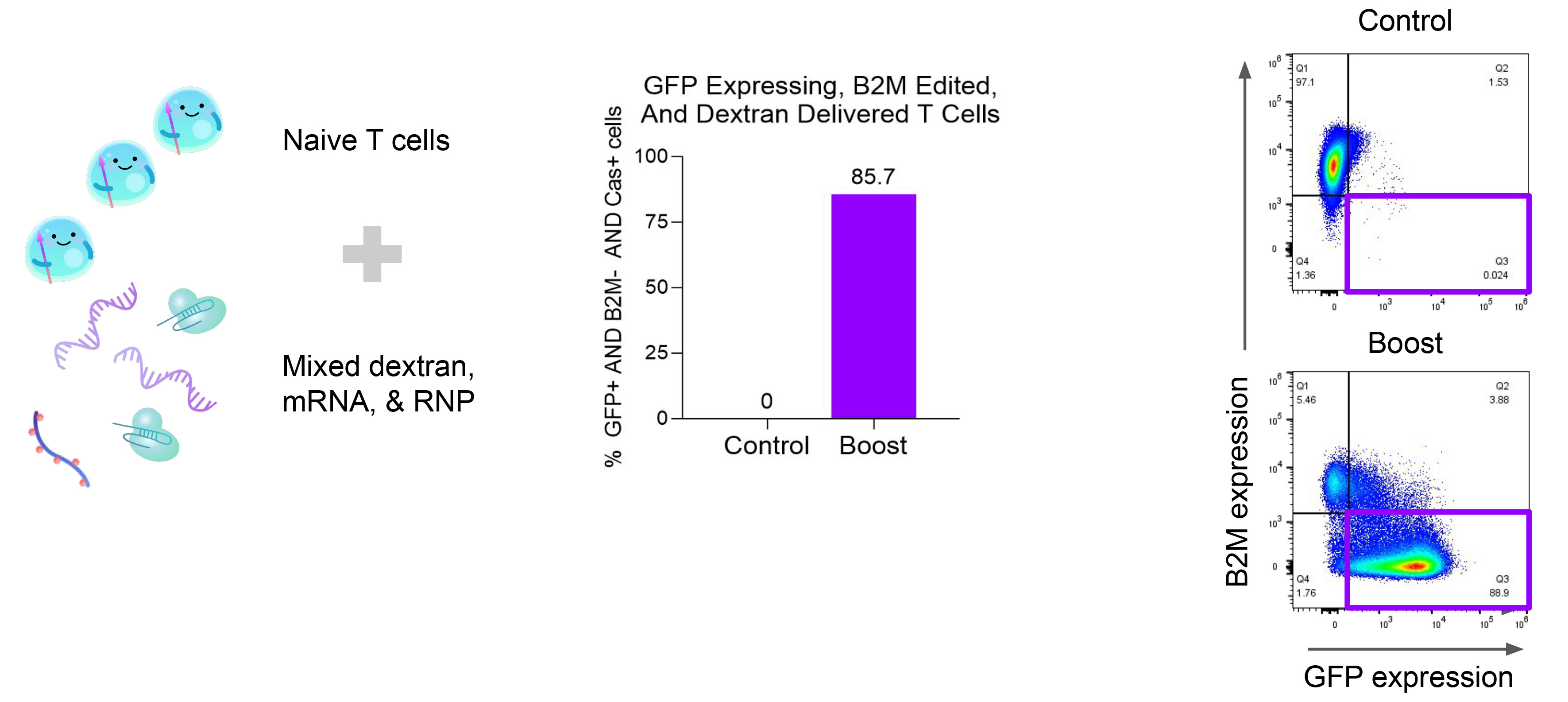
从外周血单个核细胞中分离出初始T细胞,将GFP mRNA、荧光标记的葡聚糖聚合物和β2微球蛋白(B2M)CRISPR RNPs等多重载体递送至初始T细胞。40小时后,使用流式细胞术评估mRNA和B2M蛋白的表达,证实该系统支持高效多重递送。
5. CAR-T功能验证
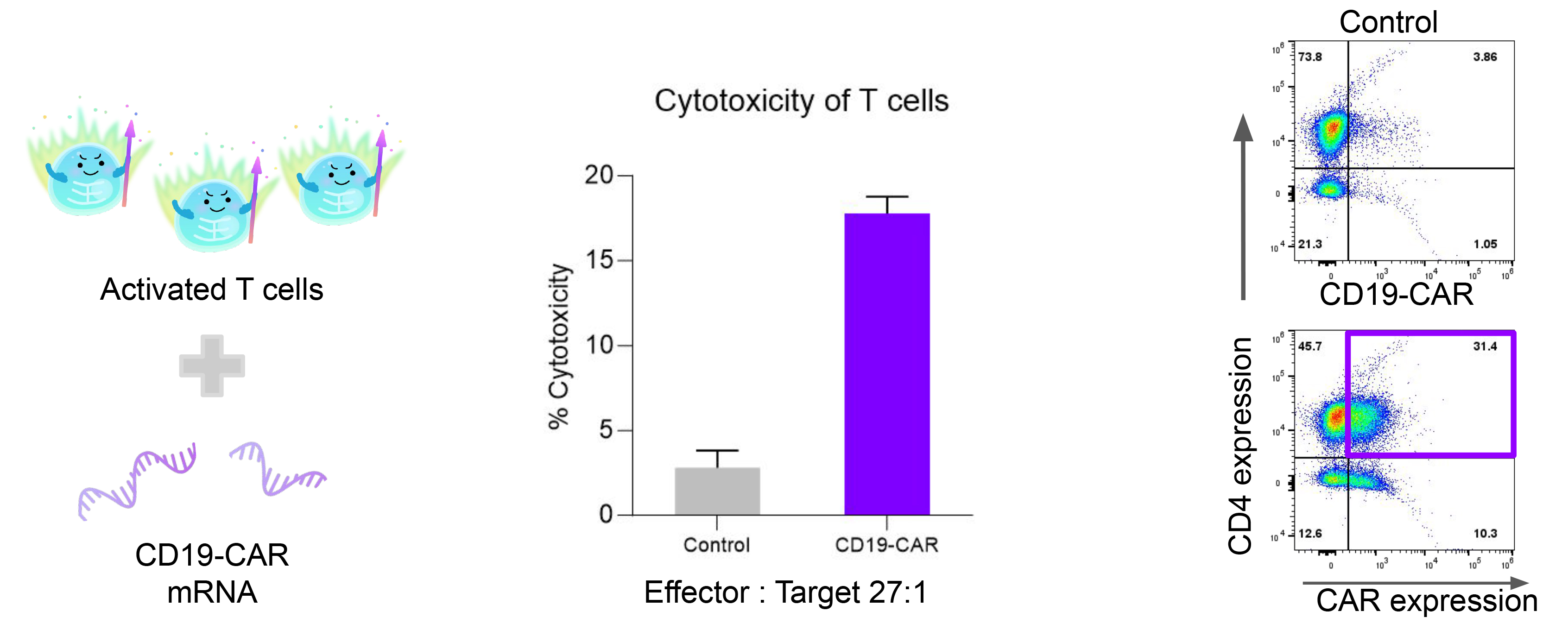
将CD19嵌合抗原受体(CAR)mRNA递送至活化的T细胞中。转染20小时后,采用流式细胞术检测CD19 CAR的表达水平。随后,将高表达CAR的T细胞与Raji细胞共培养,通过Cytotox96法检测LDH释放量,以评估CAR-T细胞的效应功能。
客户应用案例
案例一:细胞重编程——驱动iPSC向神经元分化
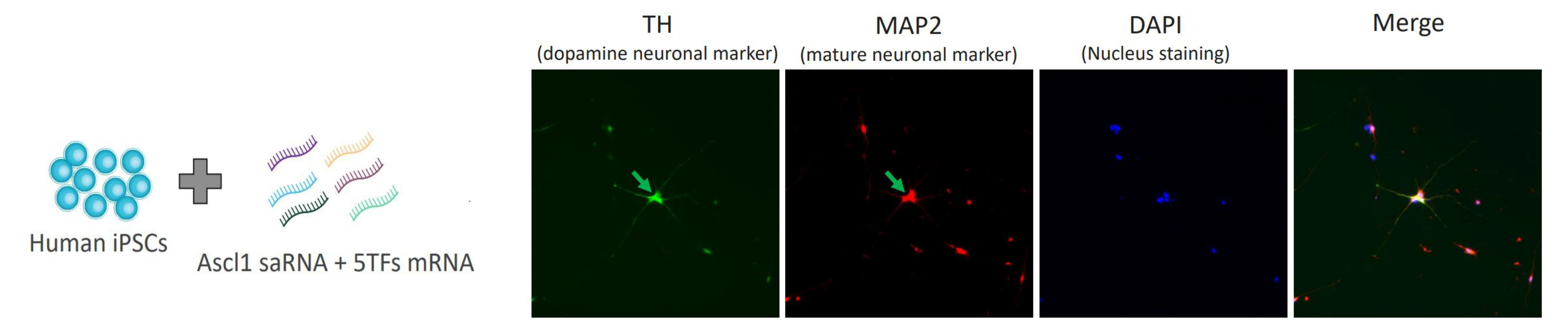
研究人员使用Gateway™系统将Ascl1 saRNA及神经元5种转录因子(FoxA2, Lmx1a, Nurr1, Pitx3, EN1))的mRNA递送至诱导多能干细胞(iPSCs)。14天后,细胞成功表达多巴胺能神经元标志物酪氨酸羟化酶(TH)和成熟神经元标志物MAP2(绿色箭头所示),展现出神经元分化潜力。
案例二:减少预处理需求——增强HSC存活与归巢能力
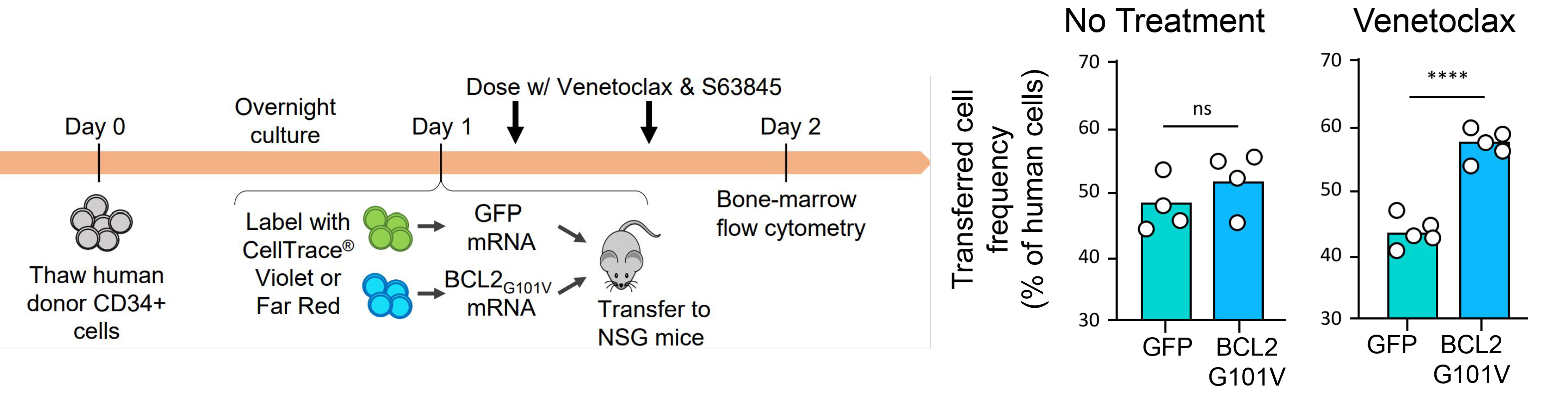
研究人员使用Gateway™系统将GFP或BCL-2(G101V)mRNA递送至CD34+ HSC(造血干细胞),并移植至NSG小鼠。结果显示,突变BCL2能够抵抗Venetoclax诱导的凋亡,显著提升HSC存活与骨髓归巢效率。
案例三:增强免疫细胞功能——改善T细胞表型与细胞毒性
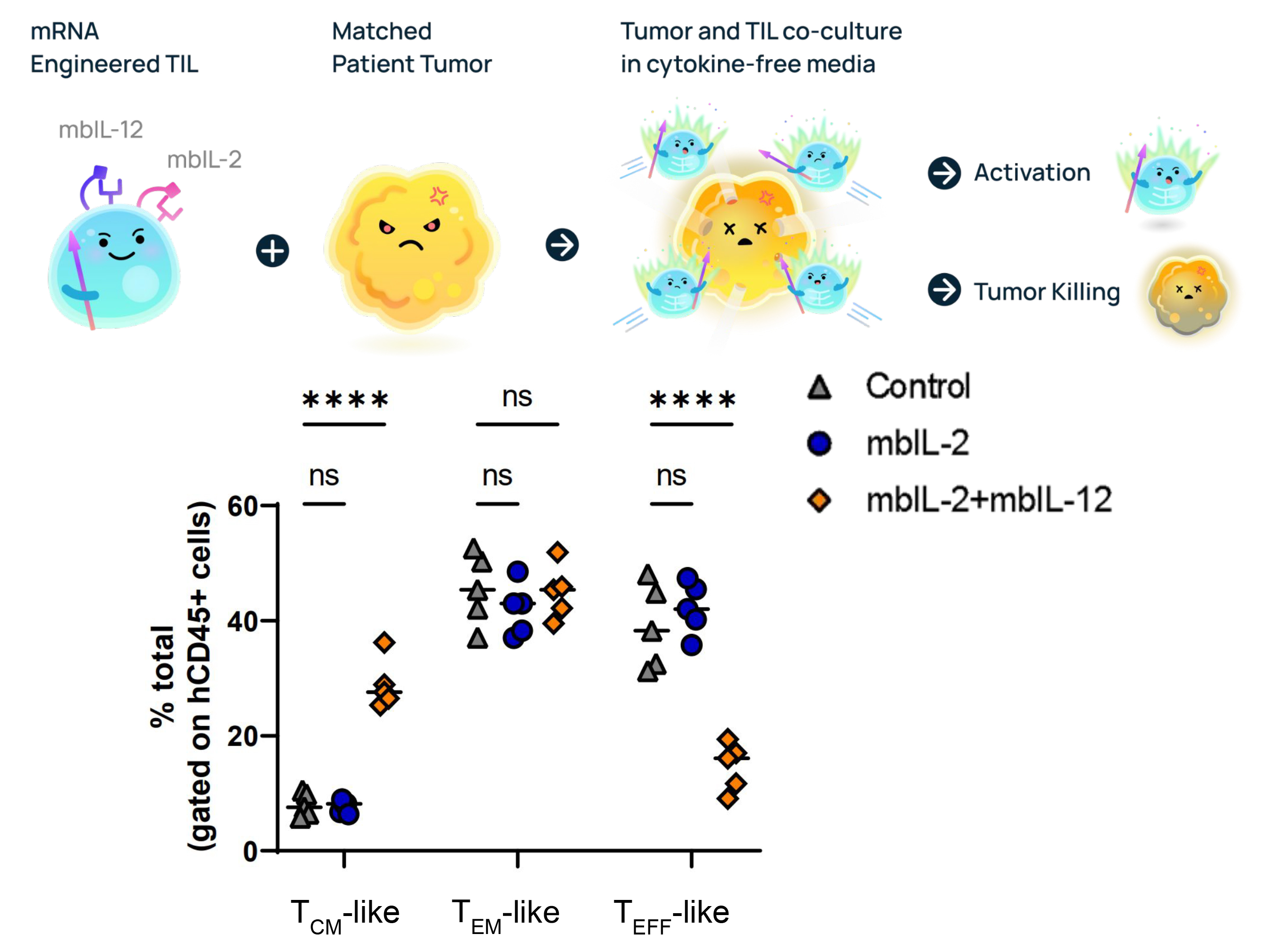
研究人员使用Gateway™系统将膜结合型IL-2/12 mRNA递送至T细胞,并移植至小鼠模型。5天后血液检测表明,mbIL-2/12 T细胞比例显著增加,证实其在改善T细胞记忆表型和增强细胞毒性方面具有潜力。
Gateway™系统技术优势
强大的核酸递送能力:支持mRNA、siRNA、saRNA、DNA、RNP复合物等多种核酸类载荷,并可实现多重递送;
广泛的细胞兼容性:覆盖难转染的原代免疫细胞(T、B、NK、单核细胞)及干细胞(iPSC、CD34+ HSC);
优异的细胞活性维持:低毒性、高存活率,保障细胞功能完整性;
便捷的流程整合:可无缝嵌入现有细胞生产流程,便于临床及产业推广。
未来展望
作为面向新一代细胞疗法的先进技术,Gateway™系统在细胞治疗、生物制造、再生医学、诊断与分析以及高通量筛选等领域展现出巨大潜力。其在提升递送效率、保障细胞活性及多重载荷兼容性方面的优势,使其成为推动临床转化与产业化的关键工具,为未来精准医疗与规模化细胞工程提供坚实支撑。
Gateway™:模块化设计实现精准高效递送
Gateway™系统由两部分组成:主机控制单元采用紧凑型台式设计,可精确控制输送参数,且能轻松置于生物安全柜内操作;MicroBooster™则是针对不同细胞类型优化设计的递送芯片,具备特定孔径结构,确保各类细胞均能实现更高效率的外源载荷处理。


图1. Portal机械挤压穿孔技术工作原理
混合:将细胞与目标载荷(如 mRNA、RNP等)共同悬浮于溶液中;
挤压:使细胞快速通过 Portal特殊设计的微流控芯片通道(孔径约为细胞直径的70%);
进入:细胞在物理挤压下发生瞬时形变,形成可自我修复的孔隙,周围目标分子顺势进入细胞质;
恢复:细胞膜迅速修复,细胞恢复完整状态。
整个过程快速、温和,无需化学试剂或病毒载体,也避免了电击对细胞造成的应激与损伤。
实验数据验证:高效递送与功能实现
1. 高效递送mRNA至多种免疫细胞
使用Gateway™系统向人类外周血单个核细胞 (PBMCs)递送GFP mRNA 20小时后,流式细胞术检测显示细胞活性良好,且在T细胞、B细胞、NK细胞和单核细胞中均检测到广泛GFP表达。

2. 人类诱导多能干细胞(iPSCs)中mRNA的高效表达

递送GFP mRNA至人iPSCs 20小时后,通过荧光显微镜与流式细胞术均观察到强GFP信号,细胞状态保持稳定。
3. CD34+细胞中的基因敲低

递送B2M siRNA至人类CD34+造血干细胞40小时后,流式细胞术显示B2M表达显著下降,同时细胞存活率维持较高水平。
4. 初始T细胞中的高效多重递送

从外周血单个核细胞中分离出初始T细胞,将GFP mRNA、荧光标记的葡聚糖聚合物和β2微球蛋白(B2M)CRISPR RNPs等多重载体递送至初始T细胞。40小时后,使用流式细胞术评估mRNA和B2M蛋白的表达,证实该系统支持高效多重递送。
5. CAR-T功能验证

将CD19嵌合抗原受体(CAR)mRNA递送至活化的T细胞中。转染20小时后,采用流式细胞术检测CD19 CAR的表达水平。随后,将高表达CAR的T细胞与Raji细胞共培养,通过Cytotox96法检测LDH释放量,以评估CAR-T细胞的效应功能。
客户应用案例
案例一:细胞重编程——驱动iPSC向神经元分化

研究人员使用Gateway™系统将Ascl1 saRNA及神经元5种转录因子(FoxA2, Lmx1a, Nurr1, Pitx3, EN1))的mRNA递送至诱导多能干细胞(iPSCs)。14天后,细胞成功表达多巴胺能神经元标志物酪氨酸羟化酶(TH)和成熟神经元标志物MAP2(绿色箭头所示),展现出神经元分化潜力。
案例二:减少预处理需求——增强HSC存活与归巢能力

研究人员使用Gateway™系统将GFP或BCL-2(G101V)mRNA递送至CD34+ HSC(造血干细胞),并移植至NSG小鼠。结果显示,突变BCL2能够抵抗Venetoclax诱导的凋亡,显著提升HSC存活与骨髓归巢效率。
案例三:增强免疫细胞功能——改善T细胞表型与细胞毒性

研究人员使用Gateway™系统将膜结合型IL-2/12 mRNA递送至T细胞,并移植至小鼠模型。5天后血液检测表明,mbIL-2/12 T细胞比例显著增加,证实其在改善T细胞记忆表型和增强细胞毒性方面具有潜力。
Gateway™系统技术优势
强大的核酸递送能力:支持mRNA、siRNA、saRNA、DNA、RNP复合物等多种核酸类载荷,并可实现多重递送;
广泛的细胞兼容性:覆盖难转染的原代免疫细胞(T、B、NK、单核细胞)及干细胞(iPSC、CD34+ HSC);
优异的细胞活性维持:低毒性、高存活率,保障细胞功能完整性;
便捷的流程整合:可无缝嵌入现有细胞生产流程,便于临床及产业推广。
未来展望
作为面向新一代细胞疗法的先进技术,Gateway™系统在细胞治疗、生物制造、再生医学、诊断与分析以及高通量筛选等领域展现出巨大潜力。其在提升递送效率、保障细胞活性及多重载荷兼容性方面的优势,使其成为推动临床转化与产业化的关键工具,为未来精准医疗与规模化细胞工程提供坚实支撑。
相关文章
更多 >

