单细胞测序助力γ-分泌酶抑制剂联合CAR-T疗法重塑肿瘤微环境机制研究
2025-09-11 来源:本站 点击次数:715近期,《Blood》期刊刊载了一项意义非凡的研究成果。科学家们借助单细胞测序技术深入探究,发现γ - 分泌酶抑制剂(GSI)与抗 BCMA CAR - T 疗法的联合应用,不仅能够显著增强对肿瘤细胞的识别能力,还具备重塑骨髓微环境的潜力,为复发 / 难治性多发性骨髓瘤(MM)患者开辟了新的治疗途径,点燃了新的希望之光。



免疫微环境重塑
在该研究中,单细胞测序技术揭示了γ - 分泌酶抑制剂(GSI)联合抗 BCMA CAR - T 疗法对免疫微环境的重塑作用,其中单核细胞亚群发生了显著变化。具体表现为非经典单核细胞比例下降(如图 2D - E 所示),这一变化有助于改善免疫微环境,增强抗肿瘤免疫反应。

关键通路调控:Notch 信号、NF-κB 通路活性改变(图 3C-D)


生存获益新发现
研究揭示了BCMA基因拷贝数与无进展生存期(PFS)存在强相关性(如图7B所示),这一发现为精准预测患者的治疗反应提供了重要依据。此外,治疗后可溶性BCMA(sBCMA)水平呈现持续下降的趋势(如图7C所示),表明该治疗方案能够有效降低sBCMA水平,进而减少其对治疗效果的潜在干扰。

图 7C:sBCMA 动态变化监测
核心发现
-
快速起效:首次给药后仅 2 小时,sBCMA 水平即开始显著下降,表明该联合治疗方案能够迅速发挥药效,对 sBCMA 的产生与释放进行有效干预。
-
显著降幅:经过三剂治疗后,sBCMA 水平的降幅达到 60% 以上,这一显著的下降幅度充分体现了联合疗法在降低 sBCMA 水平方面的强大效力。
-
持久抑制:持续抑制效果可维持长达 96 小时,确保了治疗效果的稳定性和持久性,为患者提供了长期的疾病控制保障。
机制深度解读
-
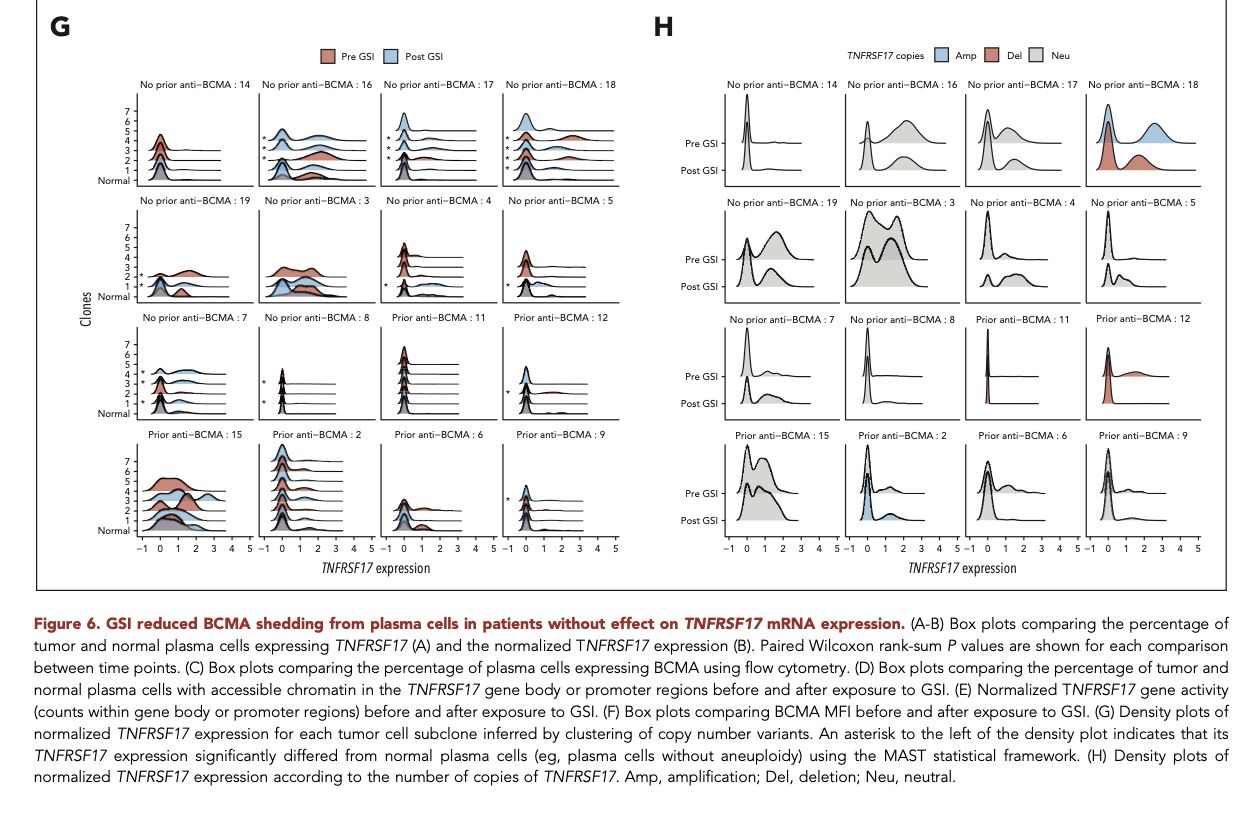
肿瘤细胞层面:γ - 分泌酶抑制剂(GSI)通过特异性抑制 γ - 分泌酶的活性,有效阻断了 BCMA 胞外域从肿瘤细胞表面脱落的过程,从而减少 sBCMA 的产生。单细胞分析结果显示,BCMA 基因表达在肿瘤细胞群体中呈现出显著的异质性(如图 6G - H 所示),这一发现为深入理解肿瘤细胞对治疗的个体化反应提供了重要依据。
免疫细胞
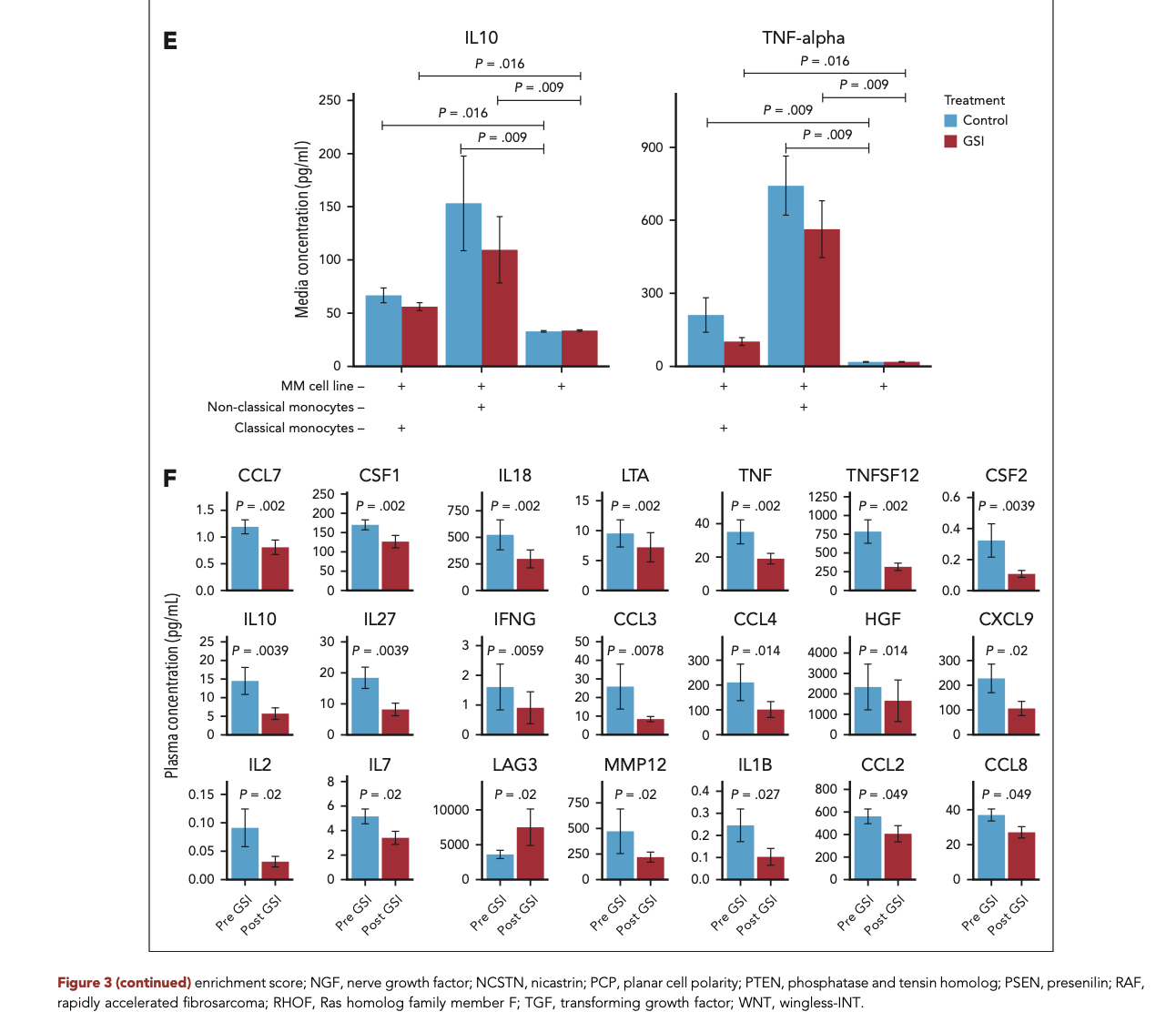
非经典单核细胞减少与 IL-10/TNF-α 分泌下降直接相关(图 3E-F)
在本研究中,通过对免疫细胞的深入分析,发现非经典单核细胞(Non-classical Monocytes, NCM)的比例显著减少,这一变化与 IL-10 和 TNF-α 分泌的下降存在直接相关性。非经典单核细胞在免疫系统中具有重要的免疫监视和调节功能。它们通过分泌细胞因子如 IL-10 和 TNF-α,参与调节炎症反应和免疫应答。IL-10 是一种具有免疫抑制作用的细胞因子,能够下调单核细胞表面主要组织相容性抗原Ⅱ(MHCⅡ)的表达,降低其抗原呈递作用,从而抑制炎症反应。TNF-α 则是一种促炎细胞因子,能够激活免疫细胞并促进炎症反应。因此,非经典单核细胞的减少及其相关细胞因子分泌的变化,可能对整体免疫微环境产生重要影响,进而影响治疗效果和疾病进展。

未来展望
目前,已有 12 项临床试验正在开展,旨在深入探索 GSI 与 BCMA 靶向药物联合应用的潜力。单细胞多组学技术凭借其强大的解析能力,为个性化治疗提供了新的靶点,例如 MCL1 通路的激活。
行业锐评
“这项研究首次系统揭示了 GSI 对肿瘤 - 免疫微环境的双重调控机制,为 BCMA 靶向治疗耐药难题提供了创新解决方案。” ——《Blood》同期述评

