Adezmapimod作为p38MAPK选择性抑制剂的作用机理及在科研中的应用
2025-10-09 来源:本站 点击次数:51
Adezmapimod(SB 203580)是一种p38 MAPK(p38丝裂原活化蛋白激酶)的ATP竞争性抑制剂。Adezmapimod(SB 203580,AbMole,M1781)在细胞信号转导、炎症反应调控、细胞自噬研究以及动物模型研究等方面展现出显著的科学价值。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、Adezmapimod(SB 203580)的作用机理
p38 丝裂原活化蛋白激酶(p38 MAPK)是 MAPK 家族中的重要成员,在细胞信号传导网络中扮演着关键角色,广泛参与多种生物学过程的调控。p38 MAPK具有典型的丝氨酸/ 苏氨酸激酶结构域,包含 ATP 结合位点、底物结合位点以及调控磷酸化的关键位点。p38 MAPK 的激活通常与细胞受到各种应激刺激相关,这些刺激包括炎症因子(如 IL-1、TNF-α)、环境应激(如紫外线、渗透压变化、氧化应激)、细胞损伤等。激活后的 p38 MAPK 可通过磷酸化下游的转录因子(如 ATF2、MEF2C、p53 等),调控相关基因的表达,从而引发细胞的各种应答反应。p38 MAPK参与调控的细胞活动主要有炎症反应、应激应答、细胞凋亡、细胞增殖与分化。Adezmapimod(SB 203580,AbMole,M1781)具有特殊的分子结构,可通过占据p38 MAPK的ATP结合口袋的疏水区域实现对后者的特异性抑制。Adezmapimod(SB 203580,AbMole,M1781)对p38 MAPK的选择性是其它激酶的100倍以上,因此对其它激酶的干扰较小。这种选择性源于p38 MAPK的ATP结合域内Thr106残基,该残基可与Adezmapimod(SB 203580)形成氢键网络,而其他激酶(如ERK、JNK等)缺乏此关键位点。
二、Adezmapimod(SB 203580)的科研应用
1. Adezmapimod调节细胞炎症反应
p38 MAPK 在炎症信号传导中处于核心位置,多种炎症刺激(如脂多糖、细胞因子等)可激活 p38 MAPK 通路,进而引发下游一系列炎症相关反应。Adezmapimod(SB 203580,AbMole,M1781)对p38 MAPK 的抑制可阻断炎症相关信号通路的传导。在巨噬细胞、单核细胞等免疫细胞中,当受到炎症刺激时,p38 MAPK 的激活会促进IL-1β、TNF-α、IL-6等促炎细胞因子的合成与分泌[1]。Adezmapimod(SB 203580)处理后,可显著降低这些细胞因子的mRNA水平和蛋白表达量。例如,Adezmapimod(SB 203580,AbMole,M1781)能剂量依赖性地抑制脂多糖刺激的巨噬细胞释放IL-1β和TNF-α,且这种抑制效应与p38 MAPK活性的降低密切相关[1]。此外,Adezmapimod还可影响趋化因子(如 MCP-1、CXCL8)的表达,这些趋化因子在招募免疫细胞到达炎症部位的过程中发挥关键作用。Adezmapimod(RWJ 64809)通过减少趋化因子的释放,还可抑制免疫细胞的浸润,从而减轻局部炎症反应。此外,Adezmapimod还能够阻断细胞因子诱导的免疫细胞增殖,例如IL-2诱导的T细胞增殖[2]。综上所述,Adezmapimod(RWJ 64809)可从多个角度调节炎症反应。
2. Adezmapimod(SB 203580)激活细胞自噬和线粒体自噬
Adezmapimod(SB 203580,AbMole,M1781)的另一个显著作用是能够激活细胞自噬和线粒体自噬。自噬是一个细胞过程,涉及受损或不必要的细胞成分的降解和再循环。线粒体自噬是自噬的一种特殊形式,专门靶向并降解受损的线粒体。在一项研究中,实验人员发现Adezmapimod (RWJ 64809)可诱导肝细胞癌的自噬,其机制涉及Adezmapimod 对AMPK和DAPK的激活[3]。上述实验证实Adezmapimod具有诱导细胞自噬的能力,并且不依赖p38 MAPK[3]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
3. Adezmapimod(SB 203580)调节细胞分化
p38-MAPK信号通路在多种细胞分化过程中发挥关键作用,例如p38-MAPK信号通路可促进成骨细胞分化、脂肪细胞分化[4]。Adezmapimod(SB 203580,AbMole,M1781)作为p38 MAPK的抑制剂,可用于多种细胞分化的调节以及干细胞培养[4]。例如Adezmapimod是维持小鼠胚胎干细胞干性的重要工具化合物之一。Adezmapimod还可以用于细胞分化的诱导,例如使用 Adezmapimod处理后,神经干细胞(NSC)中的神经元特异性标志物β- III微管蛋白的表达显著增加,同时星形胶质细胞标志物 GFAP的表达减少,表明Adezmapimod能够调控NSC的分化方向,推动其向神经元方向分化[5]。此外,SB203580能够促进iPSC细胞向中胚层表型的转化[6]。
4. Adezmapimod(SB 203580)用于动物模型的研究
Adezmapimod(SB 203580,AbMole,M1781)可用于动物神经疾病、心血管疾病等多个模型的研究。在一项研究中,Adezmapimod(RWJ 64809)被用于小鼠模型,以研究逆转录病毒抑制剂诱导的神经疼痛。研究发现,p38-MAPK信号通路在小鼠脊髓中的微胶质细胞激活中起重要作用,而Adezmapimod能够显著抑制这种激活,从而减轻机械性痛觉传递[7]。Adezmapimod还被用于评估其对猪缺血再灌注损伤的影响。研究发现,Adezmapimod能够通过抑制p38-MAPK信号通路,显著延迟缺血诱导的猪心肌细胞死亡[8]。
三、范例详解
1. Nat Commun. 2015 Jan 19;6:6018.
多伦多大学、美国贝勒医学院、波士顿大学的科研团队在上述文章中探讨了高强度耐力运动与小鼠心房颤动(AF)易感性增加的关系及其机制。研究发现,6周游泳或跑步机运动可改善小鼠心脏泵血功能、降低心率,但会增加AF易感性,具体表现为心房炎症、纤维化、迷走神经张力升高、传导速度减慢、心肌细胞动作电位延长及 RyR2(S2814 位点)磷酸化等心房特异性重塑,而心室无相应变化。进一步研究表明,炎症因子 TNFα 是运动诱导心房重塑的关键因素:运动通过 TNFα 依赖性途径激活NF-κB和p38 MAPK通路;使用 TNFα 抑制剂Etanercept、敲除TNFα基因或抑制p38 MAPK,均可阻止运动诱导的心房结构变化和AF的易感性,且不影响运动带来的有益生理变化(如心率降低、心室功能改善)。此外,运动诱导的心房重塑(如纤维化、AF 易感性)在停止运动 6 周后仍持续存在,而心率变化可逆转,提示结构重塑具有不可逆性[9]。AbMole的Adezmapimod(SB 203580,AbMole,M1781)作为 p38 MAPK 抑制剂,在实验中被用于验证 p38 MAPK 通路在运动诱导心房重塑中的作用。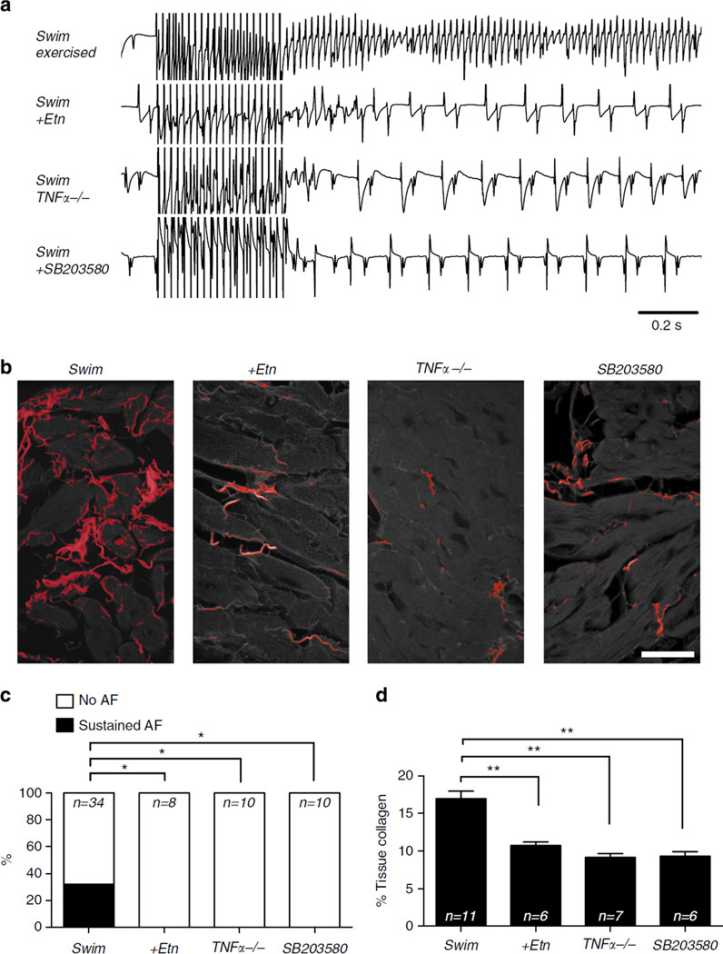

2. J Environ Sci (China). 2024 Mar;137:108-119.


一、Adezmapimod(SB 203580)的作用机理
p38 丝裂原活化蛋白激酶(p38 MAPK)是 MAPK 家族中的重要成员,在细胞信号传导网络中扮演着关键角色,广泛参与多种生物学过程的调控。p38 MAPK具有典型的丝氨酸/ 苏氨酸激酶结构域,包含 ATP 结合位点、底物结合位点以及调控磷酸化的关键位点。p38 MAPK 的激活通常与细胞受到各种应激刺激相关,这些刺激包括炎症因子(如 IL-1、TNF-α)、环境应激(如紫外线、渗透压变化、氧化应激)、细胞损伤等。激活后的 p38 MAPK 可通过磷酸化下游的转录因子(如 ATF2、MEF2C、p53 等),调控相关基因的表达,从而引发细胞的各种应答反应。p38 MAPK参与调控的细胞活动主要有炎症反应、应激应答、细胞凋亡、细胞增殖与分化。Adezmapimod(SB 203580,AbMole,M1781)具有特殊的分子结构,可通过占据p38 MAPK的ATP结合口袋的疏水区域实现对后者的特异性抑制。Adezmapimod(SB 203580,AbMole,M1781)对p38 MAPK的选择性是其它激酶的100倍以上,因此对其它激酶的干扰较小。这种选择性源于p38 MAPK的ATP结合域内Thr106残基,该残基可与Adezmapimod(SB 203580)形成氢键网络,而其他激酶(如ERK、JNK等)缺乏此关键位点。
二、Adezmapimod(SB 203580)的科研应用
1. Adezmapimod调节细胞炎症反应
p38 MAPK 在炎症信号传导中处于核心位置,多种炎症刺激(如脂多糖、细胞因子等)可激活 p38 MAPK 通路,进而引发下游一系列炎症相关反应。Adezmapimod(SB 203580,AbMole,M1781)对p38 MAPK 的抑制可阻断炎症相关信号通路的传导。在巨噬细胞、单核细胞等免疫细胞中,当受到炎症刺激时,p38 MAPK 的激活会促进IL-1β、TNF-α、IL-6等促炎细胞因子的合成与分泌[1]。Adezmapimod(SB 203580)处理后,可显著降低这些细胞因子的mRNA水平和蛋白表达量。例如,Adezmapimod(SB 203580,AbMole,M1781)能剂量依赖性地抑制脂多糖刺激的巨噬细胞释放IL-1β和TNF-α,且这种抑制效应与p38 MAPK活性的降低密切相关[1]。此外,Adezmapimod还可影响趋化因子(如 MCP-1、CXCL8)的表达,这些趋化因子在招募免疫细胞到达炎症部位的过程中发挥关键作用。Adezmapimod(RWJ 64809)通过减少趋化因子的释放,还可抑制免疫细胞的浸润,从而减轻局部炎症反应。此外,Adezmapimod还能够阻断细胞因子诱导的免疫细胞增殖,例如IL-2诱导的T细胞增殖[2]。综上所述,Adezmapimod(RWJ 64809)可从多个角度调节炎症反应。
2. Adezmapimod(SB 203580)激活细胞自噬和线粒体自噬
Adezmapimod(SB 203580,AbMole,M1781)的另一个显著作用是能够激活细胞自噬和线粒体自噬。自噬是一个细胞过程,涉及受损或不必要的细胞成分的降解和再循环。线粒体自噬是自噬的一种特殊形式,专门靶向并降解受损的线粒体。在一项研究中,实验人员发现Adezmapimod (RWJ 64809)可诱导肝细胞癌的自噬,其机制涉及Adezmapimod 对AMPK和DAPK的激活[3]。上述实验证实Adezmapimod具有诱导细胞自噬的能力,并且不依赖p38 MAPK[3]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
3. Adezmapimod(SB 203580)调节细胞分化
p38-MAPK信号通路在多种细胞分化过程中发挥关键作用,例如p38-MAPK信号通路可促进成骨细胞分化、脂肪细胞分化[4]。Adezmapimod(SB 203580,AbMole,M1781)作为p38 MAPK的抑制剂,可用于多种细胞分化的调节以及干细胞培养[4]。例如Adezmapimod是维持小鼠胚胎干细胞干性的重要工具化合物之一。Adezmapimod还可以用于细胞分化的诱导,例如使用 Adezmapimod处理后,神经干细胞(NSC)中的神经元特异性标志物β- III微管蛋白的表达显著增加,同时星形胶质细胞标志物 GFAP的表达减少,表明Adezmapimod能够调控NSC的分化方向,推动其向神经元方向分化[5]。此外,SB203580能够促进iPSC细胞向中胚层表型的转化[6]。
4. Adezmapimod(SB 203580)用于动物模型的研究
Adezmapimod(SB 203580,AbMole,M1781)可用于动物神经疾病、心血管疾病等多个模型的研究。在一项研究中,Adezmapimod(RWJ 64809)被用于小鼠模型,以研究逆转录病毒抑制剂诱导的神经疼痛。研究发现,p38-MAPK信号通路在小鼠脊髓中的微胶质细胞激活中起重要作用,而Adezmapimod能够显著抑制这种激活,从而减轻机械性痛觉传递[7]。Adezmapimod还被用于评估其对猪缺血再灌注损伤的影响。研究发现,Adezmapimod能够通过抑制p38-MAPK信号通路,显著延迟缺血诱导的猪心肌细胞死亡[8]。
三、范例详解
1. Nat Commun. 2015 Jan 19;6:6018.
多伦多大学、美国贝勒医学院、波士顿大学的科研团队在上述文章中探讨了高强度耐力运动与小鼠心房颤动(AF)易感性增加的关系及其机制。研究发现,6周游泳或跑步机运动可改善小鼠心脏泵血功能、降低心率,但会增加AF易感性,具体表现为心房炎症、纤维化、迷走神经张力升高、传导速度减慢、心肌细胞动作电位延长及 RyR2(S2814 位点)磷酸化等心房特异性重塑,而心室无相应变化。进一步研究表明,炎症因子 TNFα 是运动诱导心房重塑的关键因素:运动通过 TNFα 依赖性途径激活NF-κB和p38 MAPK通路;使用 TNFα 抑制剂Etanercept、敲除TNFα基因或抑制p38 MAPK,均可阻止运动诱导的心房结构变化和AF的易感性,且不影响运动带来的有益生理变化(如心率降低、心室功能改善)。此外,运动诱导的心房重塑(如纤维化、AF 易感性)在停止运动 6 周后仍持续存在,而心率变化可逆转,提示结构重塑具有不可逆性[9]。AbMole的Adezmapimod(SB 203580,AbMole,M1781)作为 p38 MAPK 抑制剂,在实验中被用于验证 p38 MAPK 通路在运动诱导心房重塑中的作用。


图 1. TNFα and p38 inhibition prevents arrhythmogenic atrial remodelling[9]
2. J Environ Sci (China). 2024 Mar;137:108-119.
华中科技大学的科研人员在上述论文中研究了乙撑硫脲(ETU)对斑马鱼的神经毒性及其潜在机制。研究发现,ETU暴露会降低斑马鱼胚胎的孵化率、延迟体节发育,且显著降低斑马鱼幼鱼在黑暗环境中的运动速度,引发神经行为异常。通过转录组分析筛选出丝裂原活化蛋白激酶(MAPK)通路相关基因(如 mknk1、atf4、mapkapk3)表达上调,提示运动神经元退化,后续形态观察证实 62.5μg/L ETU 组的轴突长度和分支减少。进一步研究发现,ETU 还会下调突触前支架蛋白相关基因(pcloa、pclob、bsna)并,可能损害神经肌肉接头(NMJ)完整性。由AbMole提供的p38 MAPK 抑制剂--Adezmapimod(SB 203580,AbMole,M1781)被实验人员证实可改善斑马鱼轴突退化,但无法逆转运动行为异常,表明ETU诱导的神经行为缺陷可能是p38 MAPK 通路与突触前蛋白共同作用的结果[10]。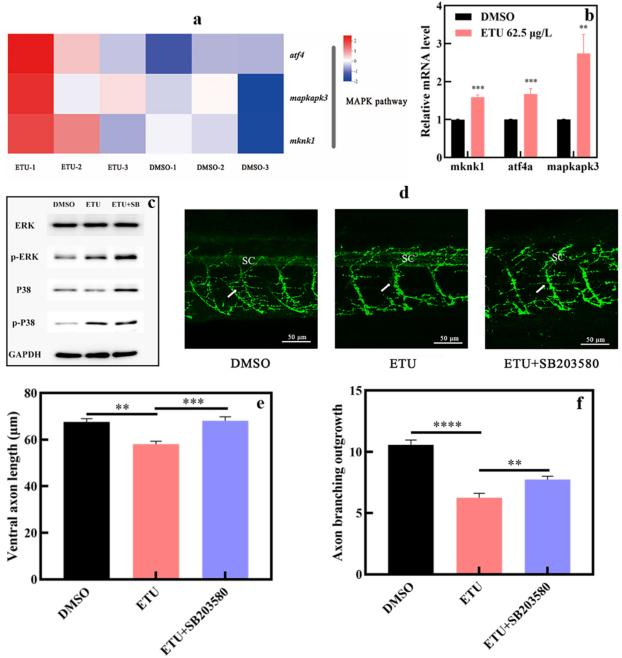



图 2. ETU exposure at 62.5 µg/L retarded motoneuron axon growth through the mitogen-activated protein kinases (MAPK) pathway[10]


参考文献及鸣谢
[1] Chunyun Fang, Lixia Wang, Jingting Qiao, et al., Differential regulation of lipopolysaccharide-induced IL-1β and TNF-α production in macrophages by palmitate via modulating TLR4 downstream signaling, International immunopharmacology 103 (2022) 108456.
[2] S. P. Davies, H. Reddy, M. Caivano, et al., Specificity and mechanism of action of some commonly used protein kinase inhibitors, The Biochemical journal 351(Pt 1) (2000) 95-105.
[3] H. Zhang, G. G. Chen, Z. Zhang, et al., Induction of autophagy in hepatocellular carcinoma cells by SB203580 requires activation of AMPK and DAPK but not p38 MAPK, Apoptosis : an international journal on programmed cell death 17(4) (2012) 325-34.
[4] X. Zhang, Z. Zhang, X. Zou, et al., Unraveling the mechanisms of intervertebral disc degeneration: an exploration of the p38 MAPK signaling pathway, Frontiers in cell and developmental biology 11 (2023) 1324561.
[5] K. Sato, M. Hamanoue, K. Takamatsu, Inhibitors of p38 mitogen-activated protein kinase enhance proliferation of mouse neural stem cells, Journal of neuroscience research 86(10) (2008) 2179-89.
[6] Y. S. Chen, R. A. Pelekanos, R. L. Ellis, et al., Small molecule mesengenic induction of human induced pluripotent stem cells to generate mesenchymal stem/stromal cells, Stem cells translational medicine 1(2) (2012) 83-95.
[7] M. W. Alhadlaq, W. Masocha, Microglia and p38 MAPK Inhibitors Suppress Development of Mechanical Allodynia in Both Sexes in a Mouse Model of Antiretroviral-Induced Neuropathic Pain, International journal of molecular sciences 24(16) (2023).
[8] Miroslav Barancik, Patrik Htun, Claudia Strohm, et al., Inhibition of the Cardiac p38-MAPK Pathway by SB203580 Delays Ischemic Cell Death, 35(3) (2000) 474-483.
[9] R. Aschar-Sobbi, F. Izaddoustdar, A. S. Korogyi, et al., Increased atrial arrhythmia susceptibility induced by intense endurance exercise in mice requires TNFα, Nat Commun 6 (2015) 6018.
[10] Jingming Wang, Zhiquan Yu, Yongfeng Wang, et al., Ethylene thiourea exposure induces neurobehavioral toxicity in zebrafish by disrupting axon growth and neuromuscular junctions, Journal of Environmental Sciences 137 (2024) 108-119.
[4] X. Zhang, Z. Zhang, X. Zou, et al., Unraveling the mechanisms of intervertebral disc degeneration: an exploration of the p38 MAPK signaling pathway, Frontiers in cell and developmental biology 11 (2023) 1324561.
[5] K. Sato, M. Hamanoue, K. Takamatsu, Inhibitors of p38 mitogen-activated protein kinase enhance proliferation of mouse neural stem cells, Journal of neuroscience research 86(10) (2008) 2179-89.
[6] Y. S. Chen, R. A. Pelekanos, R. L. Ellis, et al., Small molecule mesengenic induction of human induced pluripotent stem cells to generate mesenchymal stem/stromal cells, Stem cells translational medicine 1(2) (2012) 83-95.
[7] M. W. Alhadlaq, W. Masocha, Microglia and p38 MAPK Inhibitors Suppress Development of Mechanical Allodynia in Both Sexes in a Mouse Model of Antiretroviral-Induced Neuropathic Pain, International journal of molecular sciences 24(16) (2023).
[8] Miroslav Barancik, Patrik Htun, Claudia Strohm, et al., Inhibition of the Cardiac p38-MAPK Pathway by SB203580 Delays Ischemic Cell Death, 35(3) (2000) 474-483.
[9] R. Aschar-Sobbi, F. Izaddoustdar, A. S. Korogyi, et al., Increased atrial arrhythmia susceptibility induced by intense endurance exercise in mice requires TNFα, Nat Commun 6 (2015) 6018.
[10] Jingming Wang, Zhiquan Yu, Yongfeng Wang, et al., Ethylene thiourea exposure induces neurobehavioral toxicity in zebrafish by disrupting axon growth and neuromuscular junctions, Journal of Environmental Sciences 137 (2024) 108-119.
相关文章
更多 >

