重组EGF的机理及在细胞培养、细胞迁移和侵袭、类器官等实验中的应用
2025-10-16 来源:本站 点击次数:93
表皮生长因子(Epidermal Growth Factor, EGF)作为细胞生长因子家族的核心成员,通过与表皮生长因子受体(EGFR)结合激活下游信号通路,在细胞增殖、分化、存活及组织稳态调控中发挥关键作用。EGF(重组EGF蛋白,AbMole,M9415)在多种细胞和动物模型中被广泛应用,涉及基础细胞生物学实验、干细胞和类器官的培养等。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、EGF(Recombinant EGF Protein)的机理
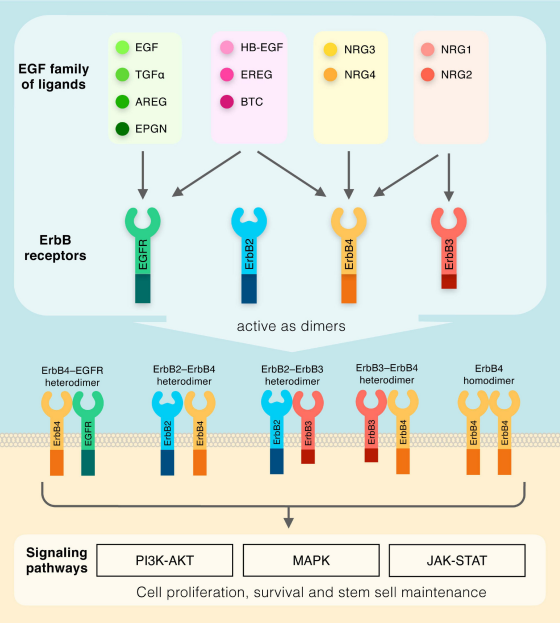
EGF(重组EGF蛋白,AbMole,M9415)是由53个氨基酸残基组成的单链多肽,分子内通过3对二硫键形成稳定的空间结构,其N端区域是其与 EGFR 结合的关键结构域。在生理条件下,EGF主要由上皮细胞、成纤维细胞及免疫细胞分泌,以自分泌或旁分泌方式作用于靶细胞;EGF 生物学效应的产生依赖于与细胞膜表面的 EGFR(受体酪氨酸激酶家族成员之一)特异性结合,结合后 EGFR 发生二聚化,激活胞内酪氨酸激酶结构域,引发自身酪氨酸残基磷酸化;磷酸化的 EGFR 进一步招募下游适配分子(如 Grb2、Shc),激活 Ras/Raf/MEK/ERK、PI3K/Akt/mTOR 及 JAK/STAT 等信号通路。其中,Ras/ERK 通路主要调控细胞增殖与分化,PI3K/Akt 通路参与细胞存活与代谢,JAK/STAT 通路则与炎症反应及细胞迁移相关。在实验体系中,EGF可通过基因工程技术高效重组表达。重组EGF蛋白(Recombinant EGF Protein,Human,AbMole,M9415)因纯度高、活性稳定,已成为实验研究用的EGF主要来源。

二、EGF(Recombinant EGF Protein)的研究应用
1. EGF(Recombinant EGF Protein)用于细胞培养
EGF(重组EGF蛋白,AbMole,M9415)是一些细胞(特别是原代细胞)培养基中重要的添加组分之一,例如在如小鼠皮肤角质形成细胞和支气管上皮细胞的培养中,添加10-50 ng/mL 的EGF可显著提高细胞贴壁率,促进细胞从 G1 期向 S 期过渡,延长细胞传代寿命;在乳腺上皮细胞(MCF-10A)培养体系中,EGF与胰岛素、Hydrocortisone 协同作用,可维持细胞的正常上皮表型,抑制细胞衰老[2]。
2. EGF(重组EGF蛋白)用于细胞迁移与侵袭实验
EGF(重组EGF蛋白,AbMole,M9415)还是重要的细胞趋化因子,可通过激活下游信号通路调控细胞骨架重排,促进细胞迁移与侵袭。EGF是Transwell 迁移/侵袭实验常用到一种生物活性分子。可在 Transwell 小室上接种细胞(如 MDA-MB-231 乳腺癌细胞、HUVEC 血管内皮细胞),然后下室添加 EGF(5-20ng/mL)作为趋化因子,培养 24-48h后通过结晶紫染色或荧光标记计数迁移/侵袭到下室的细胞数量,可直观评估EGF对细胞运动能力的促进作用[3]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
3. EGF(Recombinant EGF Protein)用于干细胞和类器官培养
EGF(重组EGF蛋白,AbMole,M9415)在干细胞培养中被广泛用于促进细胞增殖和维持干细胞的干性。研究表明,EGF能够激活下游的Ras/Raf/MAPK和PI3K/Akt等信号通路,从而促进干细胞的增殖和存活。例如,有研究发现在特定培养条件下,EGF与白血病抑制因子(LIF)协同作用,可显著增强干细胞的增殖和多能性维持[4]。表皮生长因子(EGF)还可诱导细胞的分化,例如EGF可刺激间充质干细胞(MSC)分化为骨形成细胞[5]。EGF还可以用于视网膜干细胞、神经干细胞、肠道干细胞的分化诱导[6]。
EGF(重组EGF蛋白,AbMole,M9415)在类器官培养中同样发挥着重要作用,尤其是在维持干细胞干性和促进类器官形成方面。在多种类器官培养体系中,EGF被添加到培养基中,以支持细胞的增殖和分化。
肠道类器官:在2009年,科学家Sato等成功建立了小鼠肠道类器官培养体系,该体系中添加了EGF 、Noggin和R-spondin 等因子。研究表明,这些因子能够维持肠道干细胞的自我更新和分化,形成类似小肠的隐窝-绒毛样复合体。此后,EGF被广泛用于多种类器官的培养[7]。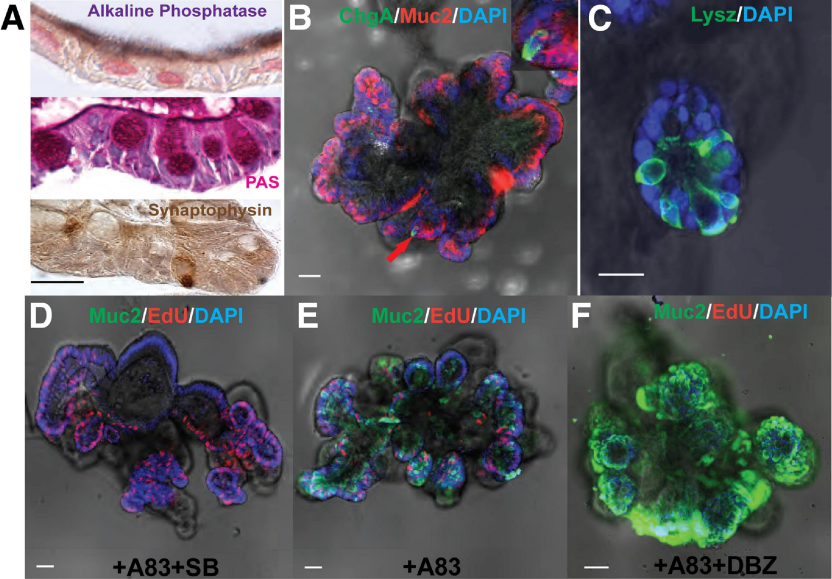

胃类器官:在胃类器官的研究中,EGF也被证明是维持胃干细胞增殖和分化所必需的。例如在从成体干细胞培养形成胃类器官时,需在培养基中添加EGF(一般为50ng/ml)[8]。并且胃腺体在这种含有 EGF 等多种生长因子的培养基中可生长为包含胃 4 种细胞谱系的三维类器官。培养基中除了需要添加EGF之外,还需加入 Wnt-3a 、Noggin(重组Noggin蛋白)、R-Spondin(R-spondin 1,RSPO1蛋白)、FGF10(KGF-2)等细胞因子。这些因子共同营造适宜的微环境,调控细胞的增殖、分化和存活,促进胃类器官的正常生长和发育[8]。
肿瘤类器官:EGF(重组EGF蛋白,AbMole,M9415)通过促进细胞增殖、分化和存活,为肿瘤类器官的形成和维持提供了重要的支持。例如在胶质母细胞瘤(GBM)类器官的培养中,使用含有EGF的培养基能够显著提高GBM类器官的培养成功率[9]。研究表明,EGF还能够显著提高结直肠癌类器官的形成率,并且EGF可与N-Acetylcystein(NAC,AbMole)、FGF2 、Y-27632 等细胞因子或调节剂协同促进结直肠癌类器官的形成,为相关研究和药物筛选提供了理想的模型[10]。除了上述几种类器官外,EGF也可用于肺类器官、甲状腺类器官、肝脏类器官、唾液腺类器官、乳腺癌类器官,头颈癌类器官的培养。
三、范例详解
Heliyon. 2024 Aug 27;10(17):e37079.
武汉市第九医院的科研人员在上述论文中探究了牙髓干细胞(DPSCs)的神经分化,以及炎症微环境中的分子机制,特别是ARMCX3基因在其中的作用。研究发现,ARMCX3在炎症微环境中对DPSCs的神经分化和炎症反应有显著影响,其机制可能涉及活性氧(ROS)信号通路。AbMole的bFGF(Recombinant Human bFGF Protein,AbMole,M9406)和EGF(Recombinant Human EGF Protein,AbMole,M9415)被用于支持DPSCs的神经分化。具体地,bFGF和EGF被添加到培养基中,以促进DPSCs向神经细胞分化。这些生长因子在培养基中的作用是提供必要的信号,以维持细胞的增殖和分化能力[11]。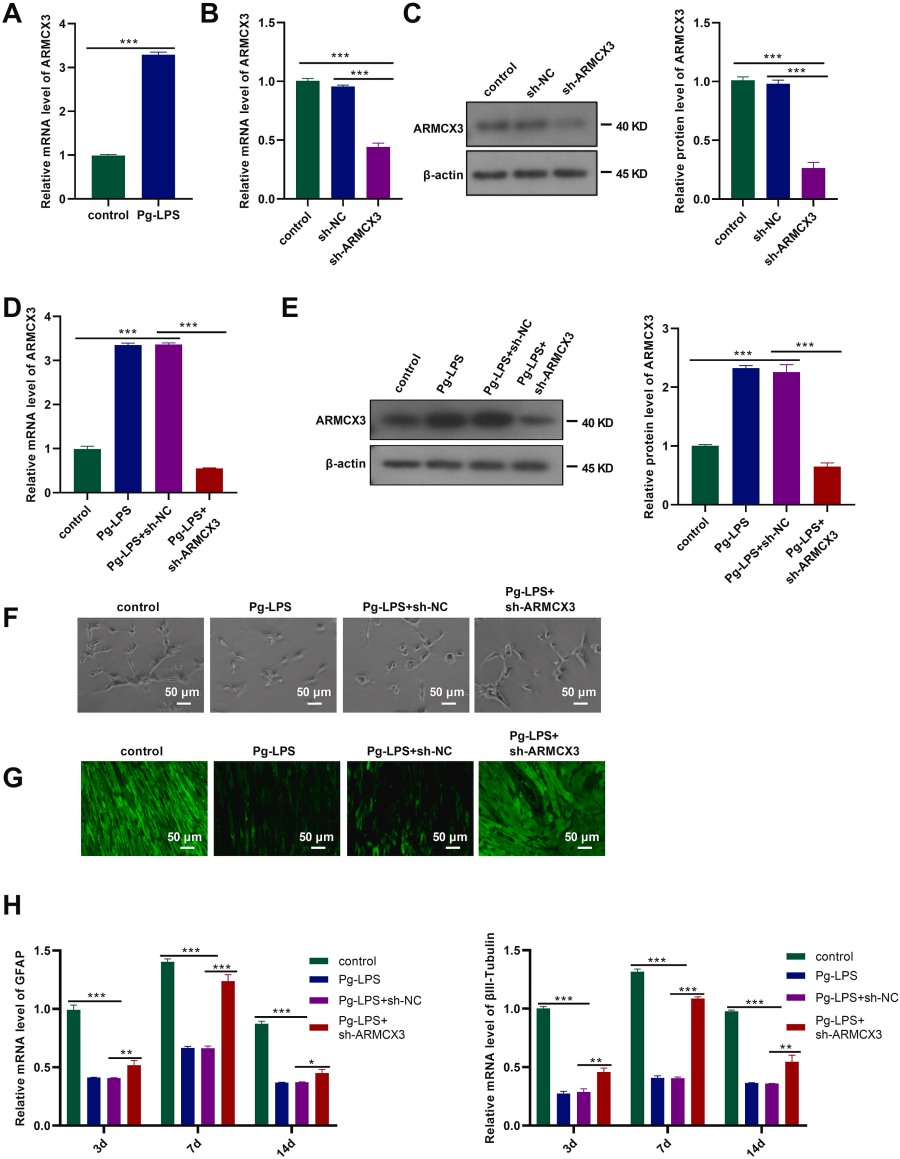

AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] Helen E Abud, Wing Hei Chan, Thierry %J Frontiers in cell Jardé, et al., Source and impact of the EGF family of ligands on intestinal stem cells, 9 (2021) 685665.
[2] Rita Yusuf, Krystyna %J Cancer Cell International Frenkel, Morphologic transformation of human breast epithelial cells MCF-10A: dependence on an oxidative microenvironment and estrogen/epidermal growth factor receptors, 10(1) (2010) 30.
[3] Verena Biswenger, Nina Baumann, Johannes Jürschick, et al., Characterization of EGF-guided MDA-MB-231 cell chemotaxis in vitro using a physiological and highly sensitive assay system, 13(9) (2018) e0203040.
[4] R. Wei, X. Zhang, X. Li, et al., A rapid and stable spontaneous reprogramming system of Spermatogonial stem cells to Pluripotent State, Cell & bioscience 13(1) (2023) 222.
[5] Irina Kratchmarova, Blagoy Blagoev, Mandana Haack-Sorensen, et al., Mechanism of divergent growth factor effects in mesenchymal stem cell differentiation, 308(5727) (2005) 1472-1477.
[6] LX Wang, F Zhu, JZ Li, et al., Epidermal growth factor promotes intestinal secretory cell differentiation in weaning piglets via Wnt/β-catenin signalling, 14(4) (2020) 790-798.
[7] Toshiro Sato, Daniel E. Stange, Marc Ferrante, et al., Long-term Expansion of Epithelial Organoids From Human Colon, Adenoma, Adenocarcinoma, and Barrett's Epithelium, Gastroenterology 141(5) (2011) 1762-1772.
[8] Kyle W McCracken, Emily M Catá, Calyn M Crawford, et al., Modelling human development and disease in pluripotent stem-cell-derived gastric organoids, 516(7531) (2014) 400-404.
[9] Maikel Verduin, Linde Hoosemans, Maxime Vanmechelen, et al., Patient-derived glioblastoma organoids reflect tumor heterogeneity and treatment sensitivity, 5(1) (2023) vdad152.
[10] Jörg Otte, Levent Dizdar, Bianca Behrens, et al., FGF signalling in the self-renewal of colon cancer organoids, 9(1) (2019) 17365.
[11] Quanying Zhou, Yi Lei, ARMCX3 regulates ROS signaling, affects neural differentiation and inflammatory microenvironment in dental pulp stem cells, Heliyon 10(17) (2024).
一、EGF(Recombinant EGF Protein)的机理
EGF(重组EGF蛋白,AbMole,M9415)是由53个氨基酸残基组成的单链多肽,分子内通过3对二硫键形成稳定的空间结构,其N端区域是其与 EGFR 结合的关键结构域。在生理条件下,EGF主要由上皮细胞、成纤维细胞及免疫细胞分泌,以自分泌或旁分泌方式作用于靶细胞;EGF 生物学效应的产生依赖于与细胞膜表面的 EGFR(受体酪氨酸激酶家族成员之一)特异性结合,结合后 EGFR 发生二聚化,激活胞内酪氨酸激酶结构域,引发自身酪氨酸残基磷酸化;磷酸化的 EGFR 进一步招募下游适配分子(如 Grb2、Shc),激活 Ras/Raf/MEK/ERK、PI3K/Akt/mTOR 及 JAK/STAT 等信号通路。其中,Ras/ERK 通路主要调控细胞增殖与分化,PI3K/Akt 通路参与细胞存活与代谢,JAK/STAT 通路则与炎症反应及细胞迁移相关。在实验体系中,EGF可通过基因工程技术高效重组表达。重组EGF蛋白(Recombinant EGF Protein,Human,AbMole,M9415)因纯度高、活性稳定,已成为实验研究用的EGF主要来源。


图 1. EGF家族成员及其各自受体[1]
二、EGF(Recombinant EGF Protein)的研究应用
1. EGF(Recombinant EGF Protein)用于细胞培养
EGF(重组EGF蛋白,AbMole,M9415)是一些细胞(特别是原代细胞)培养基中重要的添加组分之一,例如在如小鼠皮肤角质形成细胞和支气管上皮细胞的培养中,添加10-50 ng/mL 的EGF可显著提高细胞贴壁率,促进细胞从 G1 期向 S 期过渡,延长细胞传代寿命;在乳腺上皮细胞(MCF-10A)培养体系中,EGF与胰岛素、Hydrocortisone 协同作用,可维持细胞的正常上皮表型,抑制细胞衰老[2]。
2. EGF(重组EGF蛋白)用于细胞迁移与侵袭实验
EGF(重组EGF蛋白,AbMole,M9415)还是重要的细胞趋化因子,可通过激活下游信号通路调控细胞骨架重排,促进细胞迁移与侵袭。EGF是Transwell 迁移/侵袭实验常用到一种生物活性分子。可在 Transwell 小室上接种细胞(如 MDA-MB-231 乳腺癌细胞、HUVEC 血管内皮细胞),然后下室添加 EGF(5-20ng/mL)作为趋化因子,培养 24-48h后通过结晶紫染色或荧光标记计数迁移/侵袭到下室的细胞数量,可直观评估EGF对细胞运动能力的促进作用[3]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
3. EGF(Recombinant EGF Protein)用于干细胞和类器官培养
EGF(重组EGF蛋白,AbMole,M9415)在干细胞培养中被广泛用于促进细胞增殖和维持干细胞的干性。研究表明,EGF能够激活下游的Ras/Raf/MAPK和PI3K/Akt等信号通路,从而促进干细胞的增殖和存活。例如,有研究发现在特定培养条件下,EGF与白血病抑制因子(LIF)协同作用,可显著增强干细胞的增殖和多能性维持[4]。表皮生长因子(EGF)还可诱导细胞的分化,例如EGF可刺激间充质干细胞(MSC)分化为骨形成细胞[5]。EGF还可以用于视网膜干细胞、神经干细胞、肠道干细胞的分化诱导[6]。
EGF(重组EGF蛋白,AbMole,M9415)在类器官培养中同样发挥着重要作用,尤其是在维持干细胞干性和促进类器官形成方面。在多种类器官培养体系中,EGF被添加到培养基中,以支持细胞的增殖和分化。
肠道类器官:在2009年,科学家Sato等成功建立了小鼠肠道类器官培养体系,该体系中添加了EGF 、Noggin和R-spondin 等因子。研究表明,这些因子能够维持肠道干细胞的自我更新和分化,形成类似小肠的隐窝-绒毛样复合体。此后,EGF被广泛用于多种类器官的培养[7]。


图 2. 肠道类器官的细胞组成[7]
胃类器官:在胃类器官的研究中,EGF也被证明是维持胃干细胞增殖和分化所必需的。例如在从成体干细胞培养形成胃类器官时,需在培养基中添加EGF(一般为50ng/ml)[8]。并且胃腺体在这种含有 EGF 等多种生长因子的培养基中可生长为包含胃 4 种细胞谱系的三维类器官。培养基中除了需要添加EGF之外,还需加入 Wnt-3a 、Noggin(重组Noggin蛋白)、R-Spondin(R-spondin 1,RSPO1蛋白)、FGF10(KGF-2)等细胞因子。这些因子共同营造适宜的微环境,调控细胞的增殖、分化和存活,促进胃类器官的正常生长和发育[8]。
肿瘤类器官:EGF(重组EGF蛋白,AbMole,M9415)通过促进细胞增殖、分化和存活,为肿瘤类器官的形成和维持提供了重要的支持。例如在胶质母细胞瘤(GBM)类器官的培养中,使用含有EGF的培养基能够显著提高GBM类器官的培养成功率[9]。研究表明,EGF还能够显著提高结直肠癌类器官的形成率,并且EGF可与N-Acetylcystein(NAC,AbMole)、FGF2 、Y-27632 等细胞因子或调节剂协同促进结直肠癌类器官的形成,为相关研究和药物筛选提供了理想的模型[10]。除了上述几种类器官外,EGF也可用于肺类器官、甲状腺类器官、肝脏类器官、唾液腺类器官、乳腺癌类器官,头颈癌类器官的培养。
三、范例详解
Heliyon. 2024 Aug 27;10(17):e37079.
武汉市第九医院的科研人员在上述论文中探究了牙髓干细胞(DPSCs)的神经分化,以及炎症微环境中的分子机制,特别是ARMCX3基因在其中的作用。研究发现,ARMCX3在炎症微环境中对DPSCs的神经分化和炎症反应有显著影响,其机制可能涉及活性氧(ROS)信号通路。AbMole的bFGF(Recombinant Human bFGF Protein,AbMole,M9406)和EGF(Recombinant Human EGF Protein,AbMole,M9415)被用于支持DPSCs的神经分化。具体地,bFGF和EGF被添加到培养基中,以促进DPSCs向神经细胞分化。这些生长因子在培养基中的作用是提供必要的信号,以维持细胞的增殖和分化能力[11]。


图 3. ARMCX3 knockdown facilitates neural differentiation of hDPSCs[11].
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] Helen E Abud, Wing Hei Chan, Thierry %J Frontiers in cell Jardé, et al., Source and impact of the EGF family of ligands on intestinal stem cells, 9 (2021) 685665.
[2] Rita Yusuf, Krystyna %J Cancer Cell International Frenkel, Morphologic transformation of human breast epithelial cells MCF-10A: dependence on an oxidative microenvironment and estrogen/epidermal growth factor receptors, 10(1) (2010) 30.
[3] Verena Biswenger, Nina Baumann, Johannes Jürschick, et al., Characterization of EGF-guided MDA-MB-231 cell chemotaxis in vitro using a physiological and highly sensitive assay system, 13(9) (2018) e0203040.
[4] R. Wei, X. Zhang, X. Li, et al., A rapid and stable spontaneous reprogramming system of Spermatogonial stem cells to Pluripotent State, Cell & bioscience 13(1) (2023) 222.
[5] Irina Kratchmarova, Blagoy Blagoev, Mandana Haack-Sorensen, et al., Mechanism of divergent growth factor effects in mesenchymal stem cell differentiation, 308(5727) (2005) 1472-1477.
[6] LX Wang, F Zhu, JZ Li, et al., Epidermal growth factor promotes intestinal secretory cell differentiation in weaning piglets via Wnt/β-catenin signalling, 14(4) (2020) 790-798.
[7] Toshiro Sato, Daniel E. Stange, Marc Ferrante, et al., Long-term Expansion of Epithelial Organoids From Human Colon, Adenoma, Adenocarcinoma, and Barrett's Epithelium, Gastroenterology 141(5) (2011) 1762-1772.
[8] Kyle W McCracken, Emily M Catá, Calyn M Crawford, et al., Modelling human development and disease in pluripotent stem-cell-derived gastric organoids, 516(7531) (2014) 400-404.
[9] Maikel Verduin, Linde Hoosemans, Maxime Vanmechelen, et al., Patient-derived glioblastoma organoids reflect tumor heterogeneity and treatment sensitivity, 5(1) (2023) vdad152.
[10] Jörg Otte, Levent Dizdar, Bianca Behrens, et al., FGF signalling in the self-renewal of colon cancer organoids, 9(1) (2019) 17365.
[11] Quanying Zhou, Yi Lei, ARMCX3 regulates ROS signaling, affects neural differentiation and inflammatory microenvironment in dental pulp stem cells, Heliyon 10(17) (2024).
相关文章
更多 >

