重组TGF-β1的作用机理及在细胞分化、免疫及肿瘤研究中的应用
2025-10-21 来源:本站 点击次数:31
转化生长因子-β1(TGF-β1)是TGF-β家族中最重要的成员之一,具有广泛的生物学功能,包括调节细胞增殖、分化、迁移、凋亡以及免疫反应。重组转化生长因子-β1(Recombinant TGF-β1,AbMole,M9391)是通过基因工程技术生产的多功能细胞因子,可在细胞和动物实验中模拟天然的TGF-β1并触发相应的信号通路,发挥特定的生物学效应。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、TGF-β1(重组TGF-β1)的作用机理
TGF-β1(重组TGF-beta 1 Protein,AbMole,M10922)通过结合细胞膜上的特异性II型受体(TβRII)启动信号转导。TβRII随后招募并磷酸化I型受体(TβRI/ALK5),形成复合物。该复合物随后再磷酸化下游信号分子SMAD2和SMAD3。磷酸化的SMAD2/3与SMAD4形成异源复合物,被转运至细胞核,并作为转录因子调控靶基因(如纤连蛋白、PAI-1、α-SMA)的表达,上述通路称为经典SMAD依赖通路。此外,TGF-β1还能激活多种非SMAD信号通路,包括MAPK(ERK, JNK, p38)、PI3K/AKT和Rho GTPase通路,这些通路与SMAD信号协同介导TGF-β1多样化的生物学效应。
1. TGF-β1(重组TGF-β1)用于细胞增殖与凋亡研究
重组TGF-β1(Recombinant TGF-β1,AbMole,M9391)在细胞凋亡和增殖研究中展现出复杂且细胞类型依赖性的调控作用。在上皮细胞、内皮细胞中,低浓度重组TGF-β1即可通过抑制c-Myc、Cyclin D1等增殖相关基因的表达,诱导细胞周期阻滞,例如TGF-β (10 ng/mL) 可诱导角膜内皮细胞活力降低和细胞衰老[1]; TGF-β1在成纤维细胞、间充质干细胞和肿瘤细胞中,则可促进细胞增殖。例如,TGF-β1在卵巢癌细胞中促进细胞增殖和侵袭[2]。TGF-β1的这种双向调控机制可能与细胞外基质和胞内信号通路的不同有关。TGF-β1还能引起细胞凋亡: TGF-β1处理后的肺上皮细胞(MLE-12),出现细胞活力降低、而凋亡及纤维化标志物(α-SMA、Col1)表达升高等现象。而TGF-β1对细胞凋亡的作用也是有两面的:如利用含有TGF-β1(1 ng/ml)的培养基培养肺上皮细胞时,可降低cleaved caspase 3并抑制细胞的凋亡[3]。而用TGF-β1(1 ng/mL)和VEGF(30 ng/mL)同时处理内皮细胞,则可引起内皮细胞的凋亡[4]。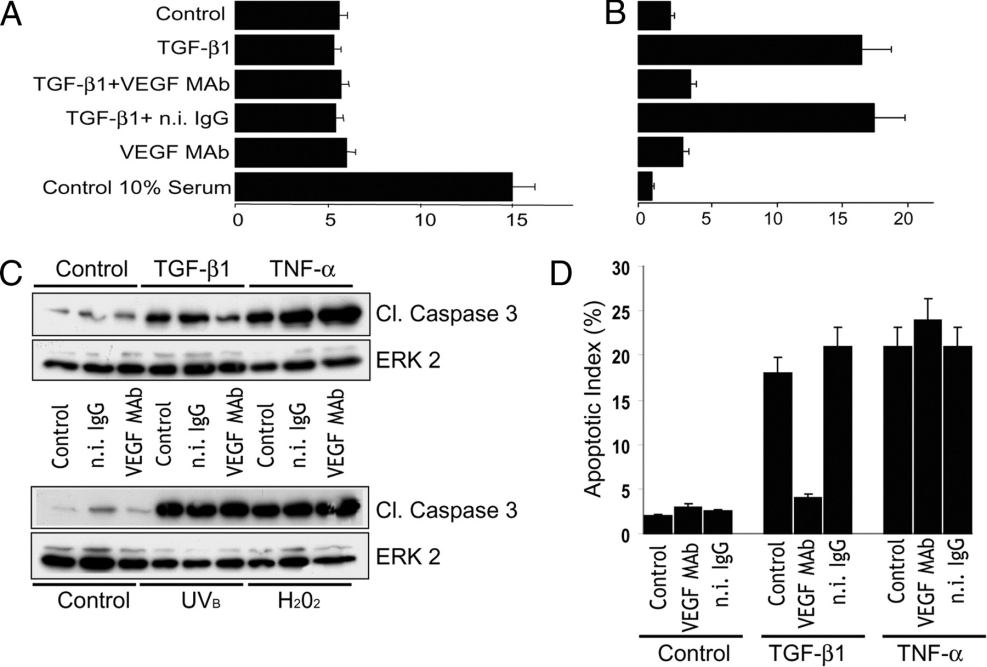

2. TGF-β1(Recombinant TGF-β1)诱导上皮-间质转化(EMT)
上皮-间质转化(EMT)是一种细胞生物学变化过程,在EMT过程中,上皮细胞失去极性和细胞间连接,获得间充质细胞的特征,如增强的迁移和侵袭能力。TGF-β1(重组TGF-beta 1 Protein,AbMole,M10922)诱导的上皮-间质转化(EMT)在多种细胞类型中得到了验证,包括癌细胞、上皮细胞和干细胞。如胶质瘤细胞(U87和U251)、胆管癌细胞(REB)和视网膜色素上皮细胞(hRPE)[5]。经TGF-β1处理的细胞形态能从上皮型(星形)转变为间充质型(纺锤状)[5]。在分子机制上,TGF-β1可通过调控转录因子(如Slug和Snail)的表达,从而在细胞的EMT过程中发挥关键作用。此外,不同的细胞类型对TGF-β1的敏感性有所不同,例如有文献利用5 ng/mL的TGF-β1处理U87细胞,在72小时后,上皮标志物(如ZO-1)的表达显著下调,而间充质标志物(如N-cadherin和Vimentin)的表达显著上调。也有文献报导用10 ng/mL的TGF-β1处理胰腺癌细胞(PANC-1)24小时后,细胞出现E-cadherin的表达下调,而N-cadherin、α-SMA和Vimentin等间充质标志物的表达上调等现象[6]。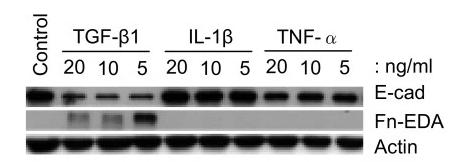

重组TGF-β1(Recombinant TGF-β1,AbMole,M9391)在多种细胞谱系的分化中发挥重要作用,例如TGF-β1促进人滋养层细胞分化,并上调钙黏蛋白-11(cadherin-11)的表达[8]。此外,TGF-β1(2 ng/ml)与RANKL(重组RANKL蛋白) 联合处理可诱导成骨细胞(OC)分化;如果使用SB431542(TGF-β1信号通路的抑制剂)则会显著抑制OC分化[9]。TGF-β1还可以在骨髓来源的间充质干细胞(MSCs)中调控成脂和成骨分化[9]。
4. TGF-β1(重组TGF-β1蛋白)用于免疫细胞研究
TGF-β1(重组TGF-beta 1 Protein,AbMole,M10922)在免疫系统中的作用复杂且多样,涉及多种免疫细胞类型和信号通路。首先,TGF-β1在调节性T细胞(Tregs)的发育和功能中起关键作用:研究表明,TGF-β1能够诱导幼稚CD4+ T细胞分化为Tregs,并维持其功能[10]。TGF-β1还在Th17细胞的分化中具有双重作用。单独存在时,TGF-β1促进调节性T细胞(Tregs)的生成;而与IL-6(白介素6)或IL-21(白介素21)共同存在时,TGF-β1则促进Th17细胞的分化[11]。TGF-β1还能够调节巨噬细胞的极化。研究表明,TGF-β1处理的巨噬细胞表现出抗炎表型,分泌较少的促炎细胞因子(如TNF-α和IL-1β),并增加抗炎细胞因子(如IL-10)的产生[12]。
三、范例详解
1. Cell Biol Toxicol. 2025 Jul 1;41(1):110.
中国人民解放军总医院的科研人员在上述论文中研究了转化生长因子β1(TGF-β1)激活的肝星状细胞(HSCs)中溶血磷脂酸受体3(LPAR3)和TEA结构域转录因子4(TEAD4)的功能,以及它们在门静脉高压(PHT)进展中的作用。研究发现,LPAR3在TGF-β1激活的HSCs中表达增加。并且在四氯化碳诱导的小鼠肝损伤模型中,LPAR3在肝脏中的表达也升高。敲低LPAR3可以减轻HSCs的激活和收缩活性,改善PHT小鼠的肝损伤和纤维化,这主要是通过抑制p38 MAPK和PI3K/AKT信号通路实现的。TEAD4在激活的HSCs和PHT小鼠肝脏中表达增强,且能结合到LPAR3启动子上促进其转录。沉默TEAD4同样可以抑制p38 MAPK和PI3K/AKT通路,减轻HSCs激活和PHT小鼠的肝纤维化,但这种效果可以通过过表达LPAR3来抵消。由AbMole提供的重组TGF-β1(Recombinant TGF-β1,AbMole,M9391)在该文章被用于诱导LX-2细胞(一种HSCs细胞系)的激活,其结果表现为α-平滑肌肌动蛋白(α-SMA)的表达增加,这表明细胞从静止状态转变为激活状态。激活后的HSCs表现出LPAR3表达的显著增加,以及p38 MAPK、PI3K和AKT的磷酸化水平升高。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。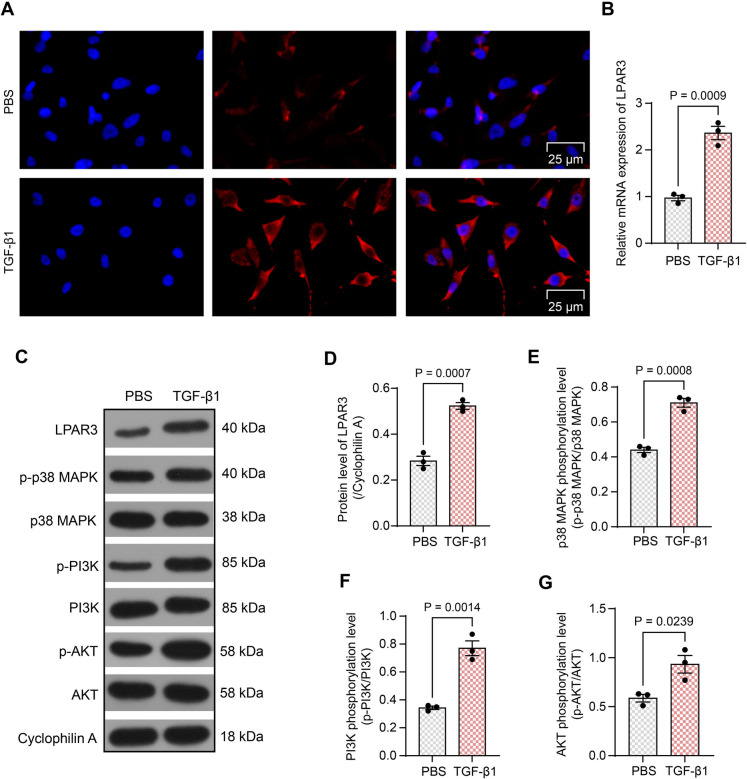

2. Toxicol Appl Pharmacol. 2024 Aug;489:117012.
山东第一医科大学的科研团队在该文章中探讨了血清剥夺蛋白反应(SDPR)在瘢痕疙瘩形成中的作用及机制。研究发现,与正常成纤维细胞(NFs)相比,瘢痕疙瘩成纤维细胞(KFs)中 的SDPR 的表达显著下调。SDPR 过表达可抑制 KFs 的增殖、迁移、侵袭及细胞外基质(ECM)的产生;而敲低 SDPR 会增强转化生长因子-β1(TGF -β1)对 NFs 上述功能的促进作用。机制研究表明,SDPR 通过抑制 ERK1/2 的激活,进而阻断 TGF - β1/SMAD 信号级联的放大,从而调控 KFs 的异常功能,提示 SDPR 可能是抗瘢痕疙瘩的潜在靶点。来自AbMole的重组TGF-β1(Recombinant TGF-β1,AbMole,M9391)在上述论文中被用于多个实验。1. 促进细胞功能异常:重组TGF-β1 可刺激 NFs 的增殖、迁移、侵袭及 ECM(如胶原蛋白 Ⅰ、Ⅲ,纤连蛋白,α-平滑肌肌动蛋白等)的产生,模拟瘢痕疙瘩中细胞的异常状态;2. 验证信号通路激活:重组TGF -β1可激活 TG -β1/SMAD 信号通路,使 SMAD2/3 磷酸化水平升高,促进 SMAD2、SMAD3、SMAD4 进入细胞核,增强该通路的转录活性;3. 验证SDPR的作用:敲低 SDPR 会增强重组TGF -β1诱导的NFs迁移和侵袭能力,通过划痕愈合实验和Transwell实验体现[14]。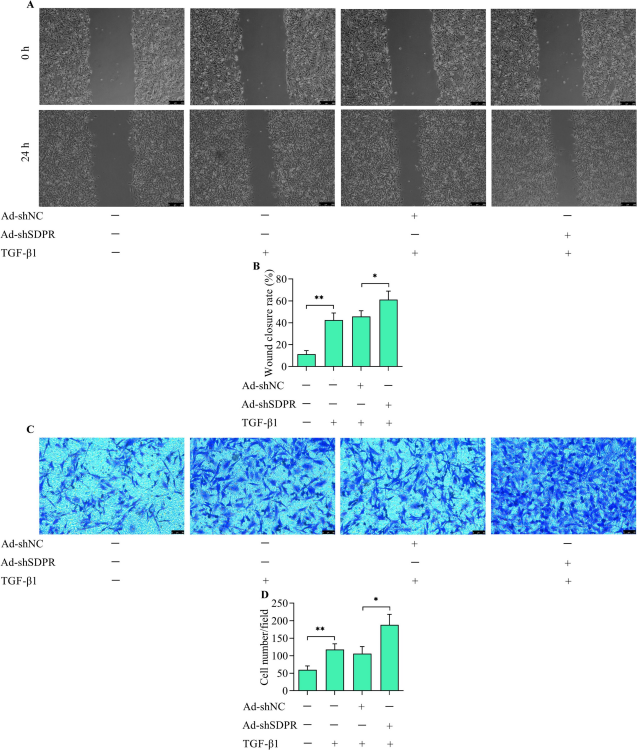

3. Int Immunopharmacol. 2024 Feb 15;128:111323.
兰州大学的科研人员探讨了 S100A11 在前列腺癌中的作用,并重点分析其通过调控癌相关成纤维细胞(CAFs)对 T 细胞浸润的影响。研究发现,前列腺癌组织中存在大量基质,而S100A11在肿瘤组织及周围基质中高表达。敲低 S100A11 可抑制前列腺癌细胞(如 DU 145、22Rv1)的增殖、迁移和侵袭;在体内实验中,下调肿瘤细胞中的 S100A11 可减少 CAFs 含量并增加 CD4⁺T 细胞浸润,但对肿瘤体积和 CD8⁺T 细胞浸润无显著影响。此外,联合敲低肿瘤细胞和 CAFs 中的 S100A11,能增强Erdafitinib 对 CAFs 的抑制作用,减少肿瘤体积,增加 CD4⁺和 CD8⁺T 细胞(尤其是有效 CD8⁺T 细胞)的浸润,且不影响调节性 T 细胞(Treg)浸润,但会降低 PD-L1 表达,从而改善肿瘤免疫微环境。在上述实验设计中,科研人员使用了由AbMole提供的三款产品:CCK-8细胞活力检测试剂盒(Cell Counting Kit-8,AbMole,M4839)、TGF-β1(重组TGF-beta 1 Protein,AbMole,M10922)和Erdafitinib(Erdafitinib,AbMole,M9715)。其中重组TGF-β1 的主要作用是预处理 NOR-10 细胞使其诱导为 CAFs,再与肿瘤细胞共注射,通过上述实验明确了 TGF-β1 在 CAFs 诱导中的作用,为后续实验模型的建立提供了方法学依据[15]。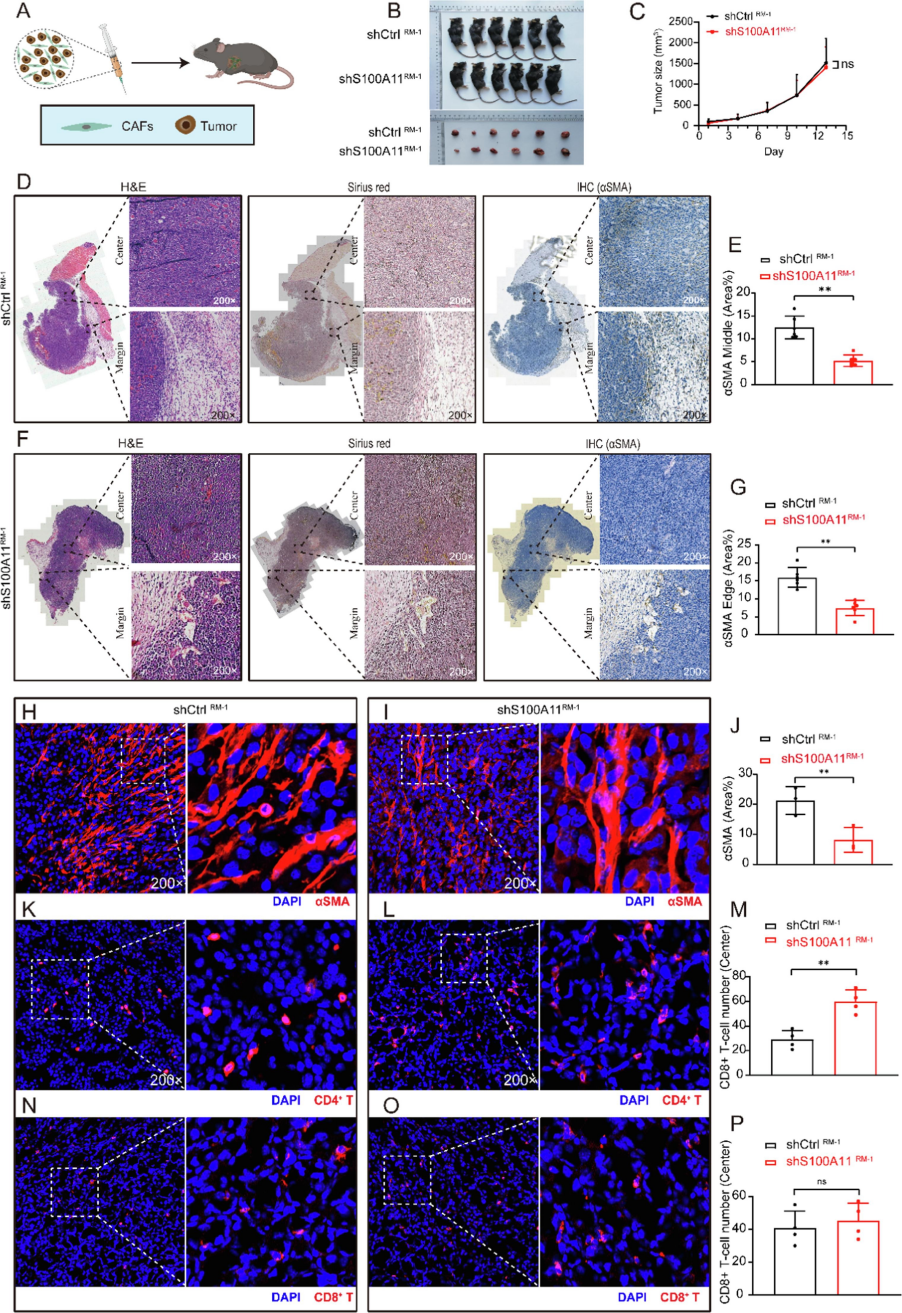

AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] Y. Bae, J. S. Hwang, Y. J. Shin, miR-30c-1 encourages human corneal endothelial cells to regenerate through ameliorating senescence, Aging 13(7) (2021) 9348-9372.
[2] G. Song, Z. Sun, M. Chu, et al., FBXO28 promotes cell proliferation, migration and invasion via upregulation of the TGF-beta1/SMAD2/3 signaling pathway in ovarian cancer, BMC cancer 24(1) (2024) 122.
[3] H. Li, G. Wang, G. Zhao, et al., TGF-beta1 maintains the developmental potential of embryonic submandibular gland epithelia separated with mesenchyme, Heliyon 10(13) (2024) e33506.
[4] G. Ferrari, G. Pintucci, G. Seghezzi, et al., VEGF, a prosurvival factor, acts in concert with TGF-beta1 to induce endothelial cell apoptosis, Proceedings of the National Academy of Sciences of the United States of America 103(46) (2006) 17260-5.
[5] Y. Su, Z. Tang, F. Wang, Role of LINC01592 in TGF-β1-induced epithelial-mesenchymal transition of retinal pigment epithelial cells, Aging 13(10) (2021) 14053-14064.
[6] S. Takano, F. Kanai, A. Jazag, et al., Smad4 is essential for down-regulation of E-cadherin induced by TGF-beta in pancreatic cancer cell line PANC-1, Journal of biochemistry 141(3) (2007) 345-51.
[7] H. Kasai, J. T. Allen, R. M. Mason, et al., TGF-beta1 induces human alveolar epithelial to mesenchymal cell transition (EMT), Respiratory research 6(1) (2005) 56.
[8] J. C. Cheng, Y. Yi, H. M. Chang, et al., TGF-β1 up-regulates cadherin-11 expression through Snail: A potential mechanism for human trophoblast cell differentiation, Cellular signalling 43 (2018) 55-61.
[9] M. Ueta, K. Takaoka, M. Yamamura, et al., Effects of TGF‑beta1 on the migration and morphology of RAW264.7 cells in vitro, Molecular medicine reports 20(5) (2019) 4331-4339.
[10] Eva N. Hadaschik, Alexander H. Enk, TGF-β1-induced regulatory T cells, Human Immunology 76(8) (2015) 561-564.
[11] H. Cheng, F. Nan, N. Ji, et al., Regulatory T cell therapy promotes TGF-β and IL-6-dependent pro-inflammatory Th17 cell generation by reducing IL-2, Nat Commun 16(1) (2025) 7644.
[12] Gillian S %J Microbes Ashcroft, infection, Bidirectional regulation of macrophage function by TGF-β, 1(15) (1999) 1275-1282.
[13] R. Qi, Z. Chang, W. Zhao, et al., TEAD4-mediated upregulation of LPAR3 augments hepatic stellate cell activation in portal hypertension, Cell biology and toxicology 41(1) (2025) 110.
[14] P. Li, M. Han, L. Wang, et al., Serum deprivation protein response intervenes in the proliferation, motility, and extracellular matrix production in keloid fibroblasts by blocking the amplification of TGF-β1/SMAD signal cascade via ERK1/2, Toxicology and applied pharmacology 489 (2024) 117012.
[15] D. Han, C. Guo, H. Cheng, et al., Downregulation of S100A11 promotes T cell infiltration by regulating cancer-associated fibroblasts in prostate cancer, International immunopharmacology 128 (2024) 111323.
一、TGF-β1(重组TGF-β1)的作用机理
TGF-β1(重组TGF-beta 1 Protein,AbMole,M10922)通过结合细胞膜上的特异性II型受体(TβRII)启动信号转导。TβRII随后招募并磷酸化I型受体(TβRI/ALK5),形成复合物。该复合物随后再磷酸化下游信号分子SMAD2和SMAD3。磷酸化的SMAD2/3与SMAD4形成异源复合物,被转运至细胞核,并作为转录因子调控靶基因(如纤连蛋白、PAI-1、α-SMA)的表达,上述通路称为经典SMAD依赖通路。此外,TGF-β1还能激活多种非SMAD信号通路,包括MAPK(ERK, JNK, p38)、PI3K/AKT和Rho GTPase通路,这些通路与SMAD信号协同介导TGF-β1多样化的生物学效应。
1. TGF-β1(重组TGF-β1)用于细胞增殖与凋亡研究
重组TGF-β1(Recombinant TGF-β1,AbMole,M9391)在细胞凋亡和增殖研究中展现出复杂且细胞类型依赖性的调控作用。在上皮细胞、内皮细胞中,低浓度重组TGF-β1即可通过抑制c-Myc、Cyclin D1等增殖相关基因的表达,诱导细胞周期阻滞,例如TGF-β (10 ng/mL) 可诱导角膜内皮细胞活力降低和细胞衰老[1]; TGF-β1在成纤维细胞、间充质干细胞和肿瘤细胞中,则可促进细胞增殖。例如,TGF-β1在卵巢癌细胞中促进细胞增殖和侵袭[2]。TGF-β1的这种双向调控机制可能与细胞外基质和胞内信号通路的不同有关。TGF-β1还能引起细胞凋亡: TGF-β1处理后的肺上皮细胞(MLE-12),出现细胞活力降低、而凋亡及纤维化标志物(α-SMA、Col1)表达升高等现象。而TGF-β1对细胞凋亡的作用也是有两面的:如利用含有TGF-β1(1 ng/ml)的培养基培养肺上皮细胞时,可降低cleaved caspase 3并抑制细胞的凋亡[3]。而用TGF-β1(1 ng/mL)和VEGF(30 ng/mL)同时处理内皮细胞,则可引起内皮细胞的凋亡[4]。


图 1 VEGF mediates the apoptotic activity of TGF-β1[4]
2. TGF-β1(Recombinant TGF-β1)诱导上皮-间质转化(EMT)
上皮-间质转化(EMT)是一种细胞生物学变化过程,在EMT过程中,上皮细胞失去极性和细胞间连接,获得间充质细胞的特征,如增强的迁移和侵袭能力。TGF-β1(重组TGF-beta 1 Protein,AbMole,M10922)诱导的上皮-间质转化(EMT)在多种细胞类型中得到了验证,包括癌细胞、上皮细胞和干细胞。如胶质瘤细胞(U87和U251)、胆管癌细胞(REB)和视网膜色素上皮细胞(hRPE)[5]。经TGF-β1处理的细胞形态能从上皮型(星形)转变为间充质型(纺锤状)[5]。在分子机制上,TGF-β1可通过调控转录因子(如Slug和Snail)的表达,从而在细胞的EMT过程中发挥关键作用。此外,不同的细胞类型对TGF-β1的敏感性有所不同,例如有文献利用5 ng/mL的TGF-β1处理U87细胞,在72小时后,上皮标志物(如ZO-1)的表达显著下调,而间充质标志物(如N-cadherin和Vimentin)的表达显著上调。也有文献报导用10 ng/mL的TGF-β1处理胰腺癌细胞(PANC-1)24小时后,细胞出现E-cadherin的表达下调,而N-cadherin、α-SMA和Vimentin等间充质标志物的表达上调等现象[6]。


图 2. Comparison of EMT-related marker expression in response to TGF-β1, IL-1β and TNF-α treatments[7]
3. TGF-β1(重组TGF-β1蛋白)诱导细胞分化重组TGF-β1(Recombinant TGF-β1,AbMole,M9391)在多种细胞谱系的分化中发挥重要作用,例如TGF-β1促进人滋养层细胞分化,并上调钙黏蛋白-11(cadherin-11)的表达[8]。此外,TGF-β1(2 ng/ml)与RANKL(重组RANKL蛋白) 联合处理可诱导成骨细胞(OC)分化;如果使用SB431542(TGF-β1信号通路的抑制剂)则会显著抑制OC分化[9]。TGF-β1还可以在骨髓来源的间充质干细胞(MSCs)中调控成脂和成骨分化[9]。
4. TGF-β1(重组TGF-β1蛋白)用于免疫细胞研究
TGF-β1(重组TGF-beta 1 Protein,AbMole,M10922)在免疫系统中的作用复杂且多样,涉及多种免疫细胞类型和信号通路。首先,TGF-β1在调节性T细胞(Tregs)的发育和功能中起关键作用:研究表明,TGF-β1能够诱导幼稚CD4+ T细胞分化为Tregs,并维持其功能[10]。TGF-β1还在Th17细胞的分化中具有双重作用。单独存在时,TGF-β1促进调节性T细胞(Tregs)的生成;而与IL-6(白介素6)或IL-21(白介素21)共同存在时,TGF-β1则促进Th17细胞的分化[11]。TGF-β1还能够调节巨噬细胞的极化。研究表明,TGF-β1处理的巨噬细胞表现出抗炎表型,分泌较少的促炎细胞因子(如TNF-α和IL-1β),并增加抗炎细胞因子(如IL-10)的产生[12]。
三、范例详解
1. Cell Biol Toxicol. 2025 Jul 1;41(1):110.
中国人民解放军总医院的科研人员在上述论文中研究了转化生长因子β1(TGF-β1)激活的肝星状细胞(HSCs)中溶血磷脂酸受体3(LPAR3)和TEA结构域转录因子4(TEAD4)的功能,以及它们在门静脉高压(PHT)进展中的作用。研究发现,LPAR3在TGF-β1激活的HSCs中表达增加。并且在四氯化碳诱导的小鼠肝损伤模型中,LPAR3在肝脏中的表达也升高。敲低LPAR3可以减轻HSCs的激活和收缩活性,改善PHT小鼠的肝损伤和纤维化,这主要是通过抑制p38 MAPK和PI3K/AKT信号通路实现的。TEAD4在激活的HSCs和PHT小鼠肝脏中表达增强,且能结合到LPAR3启动子上促进其转录。沉默TEAD4同样可以抑制p38 MAPK和PI3K/AKT通路,减轻HSCs激活和PHT小鼠的肝纤维化,但这种效果可以通过过表达LPAR3来抵消。由AbMole提供的重组TGF-β1(Recombinant TGF-β1,AbMole,M9391)在该文章被用于诱导LX-2细胞(一种HSCs细胞系)的激活,其结果表现为α-平滑肌肌动蛋白(α-SMA)的表达增加,这表明细胞从静止状态转变为激活状态。激活后的HSCs表现出LPAR3表达的显著增加,以及p38 MAPK、PI3K和AKT的磷酸化水平升高。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。


图 3. The LPAR3/p38 MAPK/PI3K/AKT cascades are activated in TGF-β1-stimulated HSCs[13].
2. Toxicol Appl Pharmacol. 2024 Aug;489:117012.
山东第一医科大学的科研团队在该文章中探讨了血清剥夺蛋白反应(SDPR)在瘢痕疙瘩形成中的作用及机制。研究发现,与正常成纤维细胞(NFs)相比,瘢痕疙瘩成纤维细胞(KFs)中 的SDPR 的表达显著下调。SDPR 过表达可抑制 KFs 的增殖、迁移、侵袭及细胞外基质(ECM)的产生;而敲低 SDPR 会增强转化生长因子-β1(TGF -β1)对 NFs 上述功能的促进作用。机制研究表明,SDPR 通过抑制 ERK1/2 的激活,进而阻断 TGF - β1/SMAD 信号级联的放大,从而调控 KFs 的异常功能,提示 SDPR 可能是抗瘢痕疙瘩的潜在靶点。来自AbMole的重组TGF-β1(Recombinant TGF-β1,AbMole,M9391)在上述论文中被用于多个实验。1. 促进细胞功能异常:重组TGF-β1 可刺激 NFs 的增殖、迁移、侵袭及 ECM(如胶原蛋白 Ⅰ、Ⅲ,纤连蛋白,α-平滑肌肌动蛋白等)的产生,模拟瘢痕疙瘩中细胞的异常状态;2. 验证信号通路激活:重组TGF -β1可激活 TG -β1/SMAD 信号通路,使 SMAD2/3 磷酸化水平升高,促进 SMAD2、SMAD3、SMAD4 进入细胞核,增强该通路的转录活性;3. 验证SDPR的作用:敲低 SDPR 会增强重组TGF -β1诱导的NFs迁移和侵袭能力,通过划痕愈合实验和Transwell实验体现[14]。


图 4. Silencing of SDPR enhanced TGF-β1-induced motility and invasion of NFs[14].
3. Int Immunopharmacol. 2024 Feb 15;128:111323.
兰州大学的科研人员探讨了 S100A11 在前列腺癌中的作用,并重点分析其通过调控癌相关成纤维细胞(CAFs)对 T 细胞浸润的影响。研究发现,前列腺癌组织中存在大量基质,而S100A11在肿瘤组织及周围基质中高表达。敲低 S100A11 可抑制前列腺癌细胞(如 DU 145、22Rv1)的增殖、迁移和侵袭;在体内实验中,下调肿瘤细胞中的 S100A11 可减少 CAFs 含量并增加 CD4⁺T 细胞浸润,但对肿瘤体积和 CD8⁺T 细胞浸润无显著影响。此外,联合敲低肿瘤细胞和 CAFs 中的 S100A11,能增强Erdafitinib 对 CAFs 的抑制作用,减少肿瘤体积,增加 CD4⁺和 CD8⁺T 细胞(尤其是有效 CD8⁺T 细胞)的浸润,且不影响调节性 T 细胞(Treg)浸润,但会降低 PD-L1 表达,从而改善肿瘤免疫微环境。在上述实验设计中,科研人员使用了由AbMole提供的三款产品:CCK-8细胞活力检测试剂盒(Cell Counting Kit-8,AbMole,M4839)、TGF-β1(重组TGF-beta 1 Protein,AbMole,M10922)和Erdafitinib(Erdafitinib,AbMole,M9715)。其中重组TGF-β1 的主要作用是预处理 NOR-10 细胞使其诱导为 CAFs,再与肿瘤细胞共注射,通过上述实验明确了 TGF-β1 在 CAFs 诱导中的作用,为后续实验模型的建立提供了方法学依据[15]。


图 5. Downregulation of S100A11 in tumor cells decreases the content of CAFs and increases CD4+ T cell in mouse prostate cancer tissue[15].
AbMole是ChemBridge中国区官方指定合作伙伴。


参考文献及鸣谢
[1] Y. Bae, J. S. Hwang, Y. J. Shin, miR-30c-1 encourages human corneal endothelial cells to regenerate through ameliorating senescence, Aging 13(7) (2021) 9348-9372.
[2] G. Song, Z. Sun, M. Chu, et al., FBXO28 promotes cell proliferation, migration and invasion via upregulation of the TGF-beta1/SMAD2/3 signaling pathway in ovarian cancer, BMC cancer 24(1) (2024) 122.
[3] H. Li, G. Wang, G. Zhao, et al., TGF-beta1 maintains the developmental potential of embryonic submandibular gland epithelia separated with mesenchyme, Heliyon 10(13) (2024) e33506.
[4] G. Ferrari, G. Pintucci, G. Seghezzi, et al., VEGF, a prosurvival factor, acts in concert with TGF-beta1 to induce endothelial cell apoptosis, Proceedings of the National Academy of Sciences of the United States of America 103(46) (2006) 17260-5.
[5] Y. Su, Z. Tang, F. Wang, Role of LINC01592 in TGF-β1-induced epithelial-mesenchymal transition of retinal pigment epithelial cells, Aging 13(10) (2021) 14053-14064.
[6] S. Takano, F. Kanai, A. Jazag, et al., Smad4 is essential for down-regulation of E-cadherin induced by TGF-beta in pancreatic cancer cell line PANC-1, Journal of biochemistry 141(3) (2007) 345-51.
[7] H. Kasai, J. T. Allen, R. M. Mason, et al., TGF-beta1 induces human alveolar epithelial to mesenchymal cell transition (EMT), Respiratory research 6(1) (2005) 56.
[8] J. C. Cheng, Y. Yi, H. M. Chang, et al., TGF-β1 up-regulates cadherin-11 expression through Snail: A potential mechanism for human trophoblast cell differentiation, Cellular signalling 43 (2018) 55-61.
[9] M. Ueta, K. Takaoka, M. Yamamura, et al., Effects of TGF‑beta1 on the migration and morphology of RAW264.7 cells in vitro, Molecular medicine reports 20(5) (2019) 4331-4339.
[10] Eva N. Hadaschik, Alexander H. Enk, TGF-β1-induced regulatory T cells, Human Immunology 76(8) (2015) 561-564.
[11] H. Cheng, F. Nan, N. Ji, et al., Regulatory T cell therapy promotes TGF-β and IL-6-dependent pro-inflammatory Th17 cell generation by reducing IL-2, Nat Commun 16(1) (2025) 7644.
[12] Gillian S %J Microbes Ashcroft, infection, Bidirectional regulation of macrophage function by TGF-β, 1(15) (1999) 1275-1282.
[13] R. Qi, Z. Chang, W. Zhao, et al., TEAD4-mediated upregulation of LPAR3 augments hepatic stellate cell activation in portal hypertension, Cell biology and toxicology 41(1) (2025) 110.
[14] P. Li, M. Han, L. Wang, et al., Serum deprivation protein response intervenes in the proliferation, motility, and extracellular matrix production in keloid fibroblasts by blocking the amplification of TGF-β1/SMAD signal cascade via ERK1/2, Toxicology and applied pharmacology 489 (2024) 117012.
[15] D. Han, C. Guo, H. Cheng, et al., Downregulation of S100A11 promotes T cell infiltration by regulating cancer-associated fibroblasts in prostate cancer, International immunopharmacology 128 (2024) 111323.
相关文章
更多 >

